名校
1 . KSCN是实验室常用的化学试剂。
(1)探究KCl浓度对Fe3+与SCN-显色反应的影响
将25mL0.005mol•L-1FeCl3与25mL0.01mol•L-1KSCN溶液混合得红色溶液,各取3mL溶液分别加KCl晶体进行透光实验,结果如图所示。
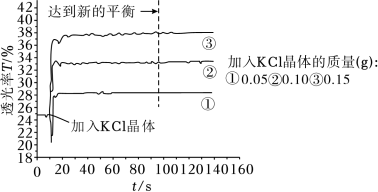
已知:i.溶液颜色越浅,透光率(T)越高;
ii.FeCl3溶液中存在Fe3++4Cl- [FeCl4]-(黄色)。
[FeCl4]-(黄色)。
①采用FeCl3稀溶液是为了避免_______ (填离子符号)的颜色对实验干扰。
②由实验结果分析,随着KCl浓度增大,Fe(SCN)3的浓度_______ (填“增大”“减小”或“不变”),从平衡移动的角度分析可能的原因_______ 。
(2)探究KSCN在铜含量测定过程中的作用
步骤如下:取1.0g铜盐样品溶于稀盐酸配成250mL溶液,取10.00mL加入过量KI充分反应,用0.0100mol•L-1的Na2S2O3标准液滴定至终点。
已知:i.2Cu2++4I-=2CuI↓+I2;2S2O +I2=S4O
+I2=S4O +2I-;
+2I-;
ii.I2+I- I
I ,CuI沉淀强烈吸附I
,CuI沉淀强烈吸附I ;
;
iii.Ksp(CuI)=1.0×10-12;Ksp(CuSCN)=4.8×10-15
①以淀粉为指示剂,滴定终点的颜色变化为_______ ;根据信息预测最终测定的结果将_______ (填“偏大”“偏小”或“无影响”)。
②通过实验探究,在滴定过程中加入KSCN可使测定结果更准确,写出发生反应的离子方程式_______ ;到达滴定终点时消耗标准液20.00mL,样品中铜元素质量分数为_______ ,滴定后仍存在少量CuI沉淀,测得溶液中c(I-)=0.2mol•L-1,则c(SCN-)=_______ 。
(1)探究KCl浓度对Fe3+与SCN-显色反应的影响
将25mL0.005mol•L-1FeCl3与25mL0.01mol•L-1KSCN溶液混合得红色溶液,各取3mL溶液分别加KCl晶体进行透光实验,结果如图所示。

已知:i.溶液颜色越浅,透光率(T)越高;
ii.FeCl3溶液中存在Fe3++4Cl-
 [FeCl4]-(黄色)。
[FeCl4]-(黄色)。①采用FeCl3稀溶液是为了避免
②由实验结果分析,随着KCl浓度增大,Fe(SCN)3的浓度
(2)探究KSCN在铜含量测定过程中的作用
步骤如下:取1.0g铜盐样品溶于稀盐酸配成250mL溶液,取10.00mL加入过量KI充分反应,用0.0100mol•L-1的Na2S2O3标准液滴定至终点。
已知:i.2Cu2++4I-=2CuI↓+I2;2S2O
 +I2=S4O
+I2=S4O +2I-;
+2I-;ii.I2+I-
 I
I ,CuI沉淀强烈吸附I
,CuI沉淀强烈吸附I ;
;iii.Ksp(CuI)=1.0×10-12;Ksp(CuSCN)=4.8×10-15
①以淀粉为指示剂,滴定终点的颜色变化为
②通过实验探究,在滴定过程中加入KSCN可使测定结果更准确,写出发生反应的离子方程式
您最近一年使用:0次
2024-04-05更新
|
61次组卷
|
3卷引用:湖南省岳阳市岳阳县第一中学2023-2024学年高二下学期开学化学试题
名校
2 . 当今世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。其中用 、
、 为原料合成甲醇(
为原料合成甲醇( )过程主要涉及以下反应:
)过程主要涉及以下反应:
反应Ⅰ:

反应Ⅱ:

反应Ⅲ:
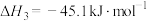
(1)根据盖斯定律,反应Ⅰ的
_______ 。
(2)我国学者结合实验与计算机模拟结果,研究了 与
与 在
在 /Cu催化剂表面生成
/Cu催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
_______ eV。并写出该历程的化学方程式_______ 。
(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______(填字母)。
(4)加压,甲醇产率将_______ (填“升高”“不变”“降低”或“无法确定”);若原料二氧化碳中掺混一氧化碳,随一氧化碳含量的增加,甲醇产率将_______ (填“升高”“不变”“降低”或“无法确定”)。
(5)加入新催化剂使1mol 和3mol
和3mol  在1L密闭容器中只发生反应Ⅰ、Ⅱ,
在1L密闭容器中只发生反应Ⅰ、Ⅱ, 平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的
平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的 物质的量分数)与温度的变化趋势如图所示。
物质的量分数)与温度的变化趋势如图所示。_______ (填“473K”“513K”或“553K”)。
②553K时,若反应后体系的总压为p,反应Ⅰ的
_______ (列出计算式)。( 为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
 、
、 为原料合成甲醇(
为原料合成甲醇( )过程主要涉及以下反应:
)过程主要涉及以下反应:反应Ⅰ:


反应Ⅱ:


反应Ⅲ:

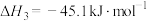
(1)根据盖斯定律,反应Ⅰ的

(2)我国学者结合实验与计算机模拟结果,研究了
 与
与 在
在 /Cu催化剂表面生成
/Cu催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。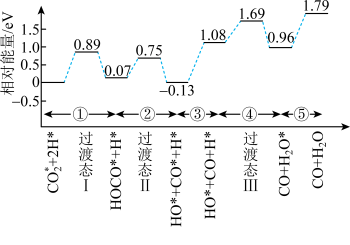

(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______(填字母)。
| A.升高温度,反应Ⅱ正向移动,反应Ⅲ逆向移动 |
| B.加入反应Ⅰ的催化剂,可以降低反应的活化能及反应热 |
C.增大 的浓度,有利于提高 的浓度,有利于提高 的平衡转化率 的平衡转化率 |
D.及时分离出 ,可以使得反应Ⅰ的正反应速率增大 ,可以使得反应Ⅰ的正反应速率增大 |
(4)加压,甲醇产率将
(5)加入新催化剂使1mol
 和3mol
和3mol  在1L密闭容器中只发生反应Ⅰ、Ⅱ,
在1L密闭容器中只发生反应Ⅰ、Ⅱ, 平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的
平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的 物质的量分数)与温度的变化趋势如图所示。
物质的量分数)与温度的变化趋势如图所示。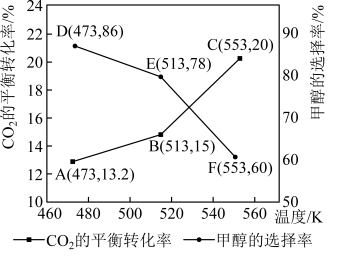
②553K时,若反应后体系的总压为p,反应Ⅰ的

 为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
您最近一年使用:0次
2023-09-30更新
|
260次组卷
|
5卷引用:湖南省平江县颐华高级中学2023-2024学年高三下学期入学考试化学试题
名校
解题方法
3 . 下列有关实验现象和解释或结论都正确的组合是
| 选项 | 实验操作 | 现象 | 解释或结论 |
A | 相同条件下,分别测量0.1molL1和0.01molL1醋酸溶液的导电性 | 前者的导电性强 | 醋酸浓度越大,电离程度越大 |
B | 向FeCl3和KSCN的混合溶液中加入KCl固体 | 血红色溶液变浅 | 增大KCl的浓度,使得平衡逆向移动 |
C | 两支试管各盛4mL0.1mol/L酸性高锰酸钾溶液,分别加入2mL0.1mol/L草酸溶液和2mL0.2mol/L草酸溶液 | 加入0.2mol/L草酸溶液的试管中,高锰酸钾溶液褪色更快 | 反应物浓度越大,反应速率越快 |
D | 把充有NO2和N2O4的平衡球装置分别放入热水和冷水中 | 热水中颜色更深 | 其他条件不变时,温度升高,平衡向吸热反应方向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-04更新
|
597次组卷
|
4卷引用:湖南师范大学附属中学2023-2024学年高二上学期入学考试化学试题
名校
4 . 铅铬黄是一种颜料,主要成分是铬酸铅 (摩尔质量323g/mol)。现以
(摩尔质量323g/mol)。现以 和
和 等为原料制备该物质,并测定产物纯度。
等为原料制备该物质,并测定产物纯度。

回答下列问题:
(1)已知 不溶于水,具有两性。第①步所得绿色溶液中的有色离子是
不溶于水,具有两性。第①步所得绿色溶液中的有色离子是___________ 。
(2)第②步生成了 ,写出该步骤的离子方程式
,写出该步骤的离子方程式___________ 。为了使 反应充分而不剩余,以下方案中最合理的是
反应充分而不剩余,以下方案中最合理的是___________ (填序号)。
A.首先加热绿色溶液,然后将一定量 浓溶液滴入其中
浓溶液滴入其中
B.首先加热 浓溶液,然后转入热的绿色溶液中
浓溶液,然后转入热的绿色溶液中
C.首先将一定量 浓溶液滴入绿色溶液中,然后加热煮沸
浓溶液滴入绿色溶液中,然后加热煮沸
(3)第③步调节pH=5的目的是为了将 转化为
转化为___________ (填写离子符号),并且防止在碱性条件下___________ 形成沉淀。
(4)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④步中逐滴滴加 溶液后,产生
溶液后,产生 黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:
黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:___________ 。
 (摩尔质量323g/mol)。现以
(摩尔质量323g/mol)。现以 和
和 等为原料制备该物质,并测定产物纯度。
等为原料制备该物质,并测定产物纯度。
回答下列问题:
(1)已知
 不溶于水,具有两性。第①步所得绿色溶液中的有色离子是
不溶于水,具有两性。第①步所得绿色溶液中的有色离子是(2)第②步生成了
 ,写出该步骤的离子方程式
,写出该步骤的离子方程式 反应充分而不剩余,以下方案中最合理的是
反应充分而不剩余,以下方案中最合理的是A.首先加热绿色溶液,然后将一定量
 浓溶液滴入其中
浓溶液滴入其中B.首先加热
 浓溶液,然后转入热的绿色溶液中
浓溶液,然后转入热的绿色溶液中C.首先将一定量
 浓溶液滴入绿色溶液中,然后加热煮沸
浓溶液滴入绿色溶液中,然后加热煮沸(3)第③步调节pH=5的目的是为了将
 转化为
转化为(4)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④步中逐滴滴加
 溶液后,产生
溶液后,产生 黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:
黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:
您最近一年使用:0次
5 . 一定条件下, 苯基丙炔(
苯基丙炔( )可与
)可与 发生催化加成,反应如下:
发生催化加成,反应如下:不正确 的是
 苯基丙炔(
苯基丙炔( )可与
)可与 发生催化加成,反应如下:
发生催化加成,反应如下: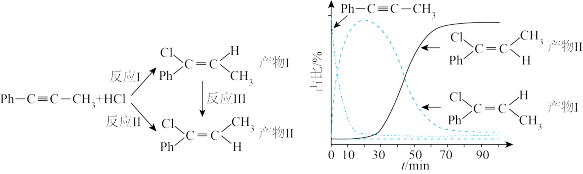
| A.反应焓变:反应I>反应Ⅱ |
| B.反应活化能:反应I<反应Ⅱ |
C.增加 浓度可增加平衡时产物Ⅱ和产物I的比例 浓度可增加平衡时产物Ⅱ和产物I的比例 |
| D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ |
您最近一年使用:0次
2023-06-21更新
|
7749次组卷
|
28卷引用:湖南省岳阳市第一中学2023-2024学年高三下学期开学化学试题
湖南省岳阳市第一中学2023-2024学年高三下学期开学化学试题2023年高考浙江卷化学真题(6月)(已下线)2023年高考浙江卷化学真题(6月)变式题(选择题11-16)(已下线)专题08 反应速率与化学平衡-2023年高考化学真题题源解密(新高考专用)(已下线)专题11 化学反应速率与化学平衡-2023年高考化学真题题源解密(全国通用)(已下线)考点25 化学反应速率与平衡图象(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第23讲化学反应与热能(已下线)第26讲化学反应速率及影响因素(已下线)实验03 探究外界条件对化学平衡移动的影响-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)辽宁省东北育才学校2023-2024学年高二上学期第一次月考化学试题(已下线)考点1 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)江苏省扬州中学2023-2024学年高三上学期10月月考化学试题浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷浙江省杭州第二中学2023-2024学年高二上学期期中考试化学试题江苏省海安高级中学2023-2024学年高三上学期11月月考化学试题山东省实验中学2023-2024学年高三上学期11月二诊化学试题(已下线)题型06 反应热的判断及计算-2024年高考化学答题技巧与模板构建陕西省西安中学2023-2024学年高三(实验版)上学期12月练考理科综合试题(已下线)题型10 反应微观机理分析 速率方程及其应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题03 化学平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)(已下线)题型12 化学平衡图表分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)06-2023新东方高二上期中考化学10-2023新东方高二上期中考化学湖北省沙市中学2023-2024学年高三下学期3月月考化学试题浙江省余姚中学2023-2024学年高二下学期3月质量检测化学试题2024届南昌市第十九中学高三下学期模拟预测化学试题江西省南昌市八一中学2024届高三下学期三模测试化学试题
名校
6 . 工业合成氨是人类科学技术的一项重大突破。其合成原理为: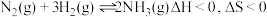 。
。
(1)下列关于工业合成氨的说法正确的是_______。
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是_______。
(3)某科研小组研究:在其他条件不变的情况下,不同温度时,固定氮气的投入量,起始氢气的物质的量与平衡时氨气的百分含量关系如图:
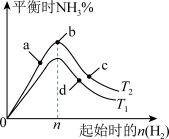
①图像中 和
和 的关系是:
的关系是:
_______  (填“>,<或=”)。
(填“>,<或=”)。
②a、b、c、d四点所处的平衡状态中,反应物 的转化率最高的是:
的转化率最高的是:_______ 。
③合成氨工业中,为提高氨气的平衡产率,除适当控制反应的温度和压强外,还可采取的措施是_______ 。
(4)恒温下,向一个4L的恒容密闭容器中充入 和
和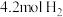 ,反应过程中对
,反应过程中对 的浓度进行检测
的浓度进行检测
①20min后,反应达平衡,氨气的浓度为 ,用
,用 表示的平均反应速率为
表示的平均反应速率为_______  。且此时,混合气体的总压强为p,则该反应的化学平衡常数
。且此时,混合气体的总压强为p,则该反应的化学平衡常数
_______ [对于气相反应,用某组分B的平衡压强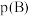 代替物质的量浓度
代替物质的量浓度 也可表示平衡常数,记作
也可表示平衡常数,记作 ,如
,如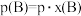 ,p为平衡总压强,
,p为平衡总压强,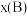 为平衡系统中B的物质的量分数]。
为平衡系统中B的物质的量分数]。
②若维持容器体积不变,温度不变,向原平衡体系中再加入 和
和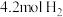 ,再次达平衡后,氨气的浓度
,再次达平衡后,氨气的浓度_______  (填“大于”或“小于”或“等于”)。
(填“大于”或“小于”或“等于”)。
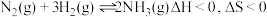 。
。(1)下列关于工业合成氨的说法正确的是_______。
A.因为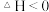 ,所以该反应一定能自发进行 ,所以该反应一定能自发进行 |
B.因为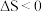 ,所以该反应一定不能自发进行 ,所以该反应一定不能自发进行 |
| C.在高温下进行是为了提高反应物的转化率 |
| D.该反应在低温下能自发进行 |
A.容器内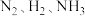 的浓度之比为1∶3∶2 的浓度之比为1∶3∶2 |
B. 百分含量保持不变 百分含量保持不变 |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |

①图像中
 和
和 的关系是:
的关系是:
 (填“>,<或=”)。
(填“>,<或=”)。②a、b、c、d四点所处的平衡状态中,反应物
 的转化率最高的是:
的转化率最高的是:③合成氨工业中,为提高氨气的平衡产率,除适当控制反应的温度和压强外,还可采取的措施是
(4)恒温下,向一个4L的恒容密闭容器中充入
 和
和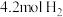 ,反应过程中对
,反应过程中对 的浓度进行检测
的浓度进行检测①20min后,反应达平衡,氨气的浓度为
 ,用
,用 表示的平均反应速率为
表示的平均反应速率为 。且此时,混合气体的总压强为p,则该反应的化学平衡常数
。且此时,混合气体的总压强为p,则该反应的化学平衡常数
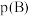 代替物质的量浓度
代替物质的量浓度 也可表示平衡常数,记作
也可表示平衡常数,记作 ,如
,如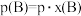 ,p为平衡总压强,
,p为平衡总压强,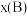 为平衡系统中B的物质的量分数]。
为平衡系统中B的物质的量分数]。②若维持容器体积不变,温度不变,向原平衡体系中再加入
 和
和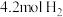 ,再次达平衡后,氨气的浓度
,再次达平衡后,氨气的浓度 (填“大于”或“小于”或“等于”)。
(填“大于”或“小于”或“等于”)。
您最近一年使用:0次
2022-12-07更新
|
705次组卷
|
3卷引用:湖南省长沙市第一中学2022-2023学年高二下学期入学考试化学试题
名校
7 . 环保是21世纪人类社会的主要研究课题之一、火电厂、燃煤锅炉是SO2污染集中、规模大的行业,石灰石-石膏烟气脱硫是除去SO2的一种常用方法,其具体过程如下图所示:

研究发现:pH和温度对石灰石浆液的脱硫效率产生一定影响;当烟气通入速度一定时,石灰石浆液的脱硫率与浆液pH的关系如图。下列有关说法正确的是


研究发现:pH和温度对石灰石浆液的脱硫效率产生一定影响;当烟气通入速度一定时,石灰石浆液的脱硫率与浆液pH的关系如图。下列有关说法正确的是

| A.烟气通入石灰石浆液时的温度越高吸收越快,吸收率也越高 |
B.将脱硫后的气体通入 溶液,可粗略判断烟气脱硫效率 溶液,可粗略判断烟气脱硫效率 |
C.上述方法中用石灰石浆液每吸收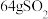 理论上同时生成 理论上同时生成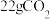 |
| D.石灰石浆液pH>5.7即碱性增强烟气脱硫效果降低的原因是此时石灰石的稳定性变差 |
您最近一年使用:0次
名校
8 . 下列实验事实不能 用勒夏特列原理解释的是
| A.打开啤酒瓶盖,喷出大量泡沫 |
| B.新制的氯水在光照下颜色逐渐变浅 |
| C.实验室用排饱和食盐水而不用排水法收集氯气 |
| D.H2、I2、HI平衡混合气加压后颜色变深 |
您最近一年使用:0次
2022-02-28更新
|
129次组卷
|
3卷引用:湖南省常德市汉寿县第一中学2023-2024学年高二下学期开学化学试题
名校
9 . 下列事实不能用平衡移动原理解释的是


| A.图甲工厂采用高压条件下合成氨 |
| B.图乙由H2(g)、I2(g)、HI(g)组成的平衡体系加压后颜色变深 |
| C.图丙工业生产硫酸的过程中使用过量的氧气 |
| D.图丁试管浸泡热水后,溶液红色加深 |
您最近一年使用:0次
2022-02-22更新
|
60次组卷
|
2卷引用:湖南省百所学校大联考2021-2022学年高二下学期入学考试化学试题
名校
解题方法
10 . 一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)  CO(g)+3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压条件下,平衡时CH4的体积分数φ(CH4)与Z和温度T的关系如图所示,下列说法正确的是
CO(g)+3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压条件下,平衡时CH4的体积分数φ(CH4)与Z和温度T的关系如图所示,下列说法正确的是

 CO(g)+3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压条件下,平衡时CH4的体积分数φ(CH4)与Z和温度T的关系如图所示,下列说法正确的是
CO(g)+3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压条件下,平衡时CH4的体积分数φ(CH4)与Z和温度T的关系如图所示,下列说法正确的是
| A.图中X点对应的平衡混合物中n(H2O)/n(CH4)=3 |
| B.图中Z的大小关系为a>3>b |
| C.该反应的焓变ΔH>0 |
| D.温度不变时,增大X点对应的平衡体系的压强后,φ(CH4)减小 |
您最近一年使用:0次
2022-08-28更新
|
509次组卷
|
5卷引用:湖南省长沙市南雅中学2020-2021学年度高二上学期入学考试化学试题
湖南省长沙市南雅中学2020-2021学年度高二上学期入学考试化学试题广东省广州真光中学2021-2022学年高二上学期12月月考化学试题(已下线)2.2.3 浓度、压强对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)(已下线)第10讲 影响化学平衡的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)广东省广州市真光中学2022-2023学年高二上学期期中考试化学试题



