1 . 探究外界因素对化学平衡的影响
Ⅰ. 利用“[Cu(H2O)4]2+(蓝色)+4Cl- [CuCl4]2-(黄色)+4H2O ΔH > 0”探究温度和浓度对化学平衡的影响。
[CuCl4]2-(黄色)+4H2O ΔH > 0”探究温度和浓度对化学平衡的影响。
实验过程:常温下,将CuCl2溶于水中得到CuCl2浓溶液,获得黄绿色溶液。并平均分为5份置于5个试管中并标记为a、b、c、d、e号试管
(1)b号试管的实验现象为________ ,c号试管相对于a号试管来说,c的溶液由黄绿色变为________ (填“蓝”或“黄”)色。对比a、b、c三支试管颜色变化,得到的结论是________________ 。
(2)对比a、d、e三支试管颜色变化,得到的结论是________ 。
Ⅱ.利用2N2O5(g) 4NO2(g) +O2(g)探究压强对化学平衡的影响。(已知:N2O5是一种无色气体)
4NO2(g) +O2(g)探究压强对化学平衡的影响。(已知:N2O5是一种无色气体)
在初始体积为V 的、无色透明的、带有活塞的石英玻璃容器中充入一定量N2O5,将温度升到一定温度并保持不变使其充分反应,如下图所示。
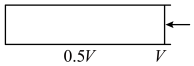
(3)待反应充分反应后,将容器的容积压缩为0.5V,可以观察到“混合气体颜色先快速变深,然后缓慢变浅”,说明该反应的平衡________ (填“正向”、“逆向”或“不”)移动;再将容积扩大到V,可以观察到“混合气体颜色先快速变浅,然后缓慢加深”,说明该反应的平衡________ (填“正向”、“逆向”或“不”)移动;
(4)通过上述实验,压强对化学平衡的影响是:________ 。
Ⅰ. 利用“[Cu(H2O)4]2+(蓝色)+4Cl-
 [CuCl4]2-(黄色)+4H2O ΔH > 0”探究温度和浓度对化学平衡的影响。
[CuCl4]2-(黄色)+4H2O ΔH > 0”探究温度和浓度对化学平衡的影响。实验过程:常温下,将CuCl2溶于水中得到CuCl2浓溶液,获得黄绿色溶液。并平均分为5份置于5个试管中并标记为a、b、c、d、e号试管
| 试管编号 | 处理方式 |
| a | 加入1ml 的水 |
| b | 加入1mL 0.1mol·L-1 AgNO3溶液(足量)充分反应 |
| c | 加入1ml 0.1mol·L-1 NaCl溶液(足量)充分反应 |
| d | 加入1mL 的水 并置于50℃的热水浴中充分反应 |
| e | 加入1mL 的水 并置于冰水浴中充分反应 |
(1)b号试管的实验现象为
(2)对比a、d、e三支试管颜色变化,得到的结论是
Ⅱ.利用2N2O5(g)
 4NO2(g) +O2(g)探究压强对化学平衡的影响。(已知:N2O5是一种无色气体)
4NO2(g) +O2(g)探究压强对化学平衡的影响。(已知:N2O5是一种无色气体)在初始体积为V 的、无色透明的、带有活塞的石英玻璃容器中充入一定量N2O5,将温度升到一定温度并保持不变使其充分反应,如下图所示。

(3)待反应充分反应后,将容器的容积压缩为0.5V,可以观察到“混合气体颜色先快速变深,然后缓慢变浅”,说明该反应的平衡
(4)通过上述实验,压强对化学平衡的影响是:
您最近一年使用:0次
解题方法
2 . 在一定条件下,反应x A+yB zC达到平衡:
zC达到平衡:
(1)若A、B、C均为气体,减压后平衡向逆反应方向移动,则x、y、z间的关系是_______ ;
(2)若已知C是气体,且x+y=z。在增大压强时,若平衡发生移动,则一定向______ (填“正”或“逆”)反应方向移动;
(3)已知B、C是气体,当其他条件不变时,增大A的物质的量,平衡不移动,则A为____ 态;
(4)加热后C的质量分数减少,则正反应是________ (填“放热”或“吸热”)反应。升高温度达到新的平衡后,该反应的平衡常数将变___ (填“大”或“小”)。
 zC达到平衡:
zC达到平衡:(1)若A、B、C均为气体,减压后平衡向逆反应方向移动,则x、y、z间的关系是
(2)若已知C是气体,且x+y=z。在增大压强时,若平衡发生移动,则一定向
(3)已知B、C是气体,当其他条件不变时,增大A的物质的量,平衡不移动,则A为
(4)加热后C的质量分数减少,则正反应是
您最近一年使用:0次
2022-12-05更新
|
48次组卷
|
2卷引用:贵州省金沙县精诚中学2021-2022学年高二上学期期中理综化学试题
名校
3 . I.在水溶液中橙色的 与黄色的
与黄色的 有下列平衡关系:
有下列平衡关系: +H2O⇌2
+H2O⇌2 +2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
(1)向上述溶液中加入NaOH溶液,溶液呈_______ 色。因为_______ 。
(2)向上述溶液中加入较浓硫酸,则溶液呈_______ 色,因为_______ 。
II.KI溶液在酸性条件下能被氧气氧化为I2.现有以下实验记录,回答:
(1)该实验的目的是_______ 。
(2)实验试剂除了1mol/LKI溶液、0.1mol/LH2SO4溶液外,还需要的试剂是_______ 。
(3)由上述实验记录可得出的结论是_______ 。
 与黄色的
与黄色的 有下列平衡关系:
有下列平衡关系: +H2O⇌2
+H2O⇌2 +2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。(1)向上述溶液中加入NaOH溶液,溶液呈
(2)向上述溶液中加入较浓硫酸,则溶液呈
II.KI溶液在酸性条件下能被氧气氧化为I2.现有以下实验记录,回答:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度/℃ | 30 | 40 | 50 | 60 | 70 |
| 显色时间/s | 160 | 80 | 40 | 20 | 10 |
(2)实验试剂除了1mol/LKI溶液、0.1mol/LH2SO4溶液外,还需要的试剂是
(3)由上述实验记录可得出的结论是
您最近一年使用:0次
2021-07-28更新
|
184次组卷
|
2卷引用:贵州省毕节市金沙县第一中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
4 . 已知下列数据:
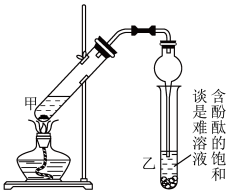
某学生在实验室制取乙酸乙酯的主要步骤如下:
①配制2 mL浓硫酸、3 mL乙醇(含18O)和2 mL乙酸的混合溶液。
②按图连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3~5 min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥。
(1)配制①中混合溶液的方法为____________ ;反应中浓硫酸的作用是________________ ;写出制取乙酸乙酯的化学方程式:____________ 。
(2)上述实验中饱和碳酸钠溶液的作用是(填字母)_________ 。
A.中和乙酸和乙醇 B.中和乙酸并吸收乙醇
C.减少乙酸乙酯的溶解 D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是_______ ;步骤③所观察到的现象是_________ ;欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有________ ;分离时,乙酸乙酯应从仪器________________ (填“下口放”或“上口倒”)出。
(4)该同学反复实验,得出乙醇与乙酸的用量和得到的乙酸乙酯生成量如下表:
表中数据x的范围是__________________ ;实验①②⑤探究的是_____________ 。
| 物质 | 熔点(℃) | 沸点(℃) | 密度g·cm-3 |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |

某学生在实验室制取乙酸乙酯的主要步骤如下:
①配制2 mL浓硫酸、3 mL乙醇(含18O)和2 mL乙酸的混合溶液。
②按图连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3~5 min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥。
(1)配制①中混合溶液的方法为
(2)上述实验中饱和碳酸钠溶液的作用是(填字母)
A.中和乙酸和乙醇 B.中和乙酸并吸收乙醇
C.减少乙酸乙酯的溶解 D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是
(4)该同学反复实验,得出乙醇与乙酸的用量和得到的乙酸乙酯生成量如下表:
| 实验 | 乙醇(mL) | 乙酸(mL) | 乙酸乙酯(mL) |
| ① | 2 | 2 | 1.33 |
| ② | 3 | 2 | 1.57 |
| ③ | 4 | 2 | x |
| ④ | 5 | 2 | 1.76 |
| ⑤ | 2 | 3 | 1.55 |
您最近一年使用:0次
2020-02-17更新
|
121次组卷
|
2卷引用:贵州省雷山县第四中学2019-2020学年高二上学期期末考试化学试题
5 . I.已知:Al2O3(s)+3C(s)====2Al(s)+3CO(g) △H1=+akJ·mol-1
2AlC13(g) 2Al(s)+3C12(g) △H2=+bkJ·mol-1(a>b)
2Al(s)+3C12(g) △H2=+bkJ·mol-1(a>b)
则由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为______________________________ 。
II.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表
回答下列问题:
(1)该反应为___________ 反应(填"吸热"或"放热")。
(2)某温度下,各物质的平衡浓度符合关系式:9c(CO2)·c(H2)=10c(CO)·c(H2O),试判断此时的温度为______________ 。
(3)830℃时,向体积为2L的密闭容器中通入1molCO2(g)和1molH2(g),下列能说明该反应达到化学平衡状态的是___________ 。(填序号)
①CO2(g)和H2(g)浓度相等;
②CO(g)的生成速率和H2O(g)消耗速率相等
③混合气体的密度不再改变;
④CO(g)体积分数不再改变;
(4)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积,平衡___________ 移动(填“向正反应方向”“向逆反应方向”或“不”)。
III.(1)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为______________________ 。
(2)若以该电池为电源,用石墨作电极电解200mL含有以下离子的溶液。
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为___________ mol。
2AlC13(g)
 2Al(s)+3C12(g) △H2=+bkJ·mol-1(a>b)
2Al(s)+3C12(g) △H2=+bkJ·mol-1(a>b)则由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为
II.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表T/℃ | 800 | 830 | 1000 | 1200 |
K | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为
(2)某温度下,各物质的平衡浓度符合关系式:9c(CO2)·c(H2)=10c(CO)·c(H2O),试判断此时的温度为
(3)830℃时,向体积为2L的密闭容器中通入1molCO2(g)和1molH2(g),下列能说明该反应达到化学平衡状态的是
①CO2(g)和H2(g)浓度相等;
②CO(g)的生成速率和H2O(g)消耗速率相等
③混合气体的密度不再改变;
④CO(g)体积分数不再改变;
(4)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积,平衡
III.(1)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为
(2)若以该电池为电源,用石墨作电极电解200mL含有以下离子的溶液。
离子 | Cu2+ | H+ | Cl- | SO42- |
c/mol·L-1 | 1 | 4 | 4 | 1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为
您最近一年使用:0次
6 . 某化学兴趣小组为验证SO2的还原性,特邀你参与以下探究活动。
I.理论预测
该兴趣小组实验实施前进行了充分的讨论交流,确定选择SO2和FeCl3溶液的反应来探究,并预测将SO2通入FeCl3溶液中的现象。小组同学想听听你的分析,你认为可能观察到的现象是:_____________ ,你预测的理论依据是(用离子方程式表示):________________________ 。
II.实验探究
(1)配制1mol/LFeCl3溶液(未用盐酸酸化)
①下面是小组四位同学在配制溶液时的“转移”操作,其中正确的是:_______________ 。
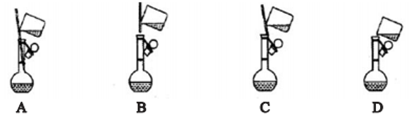
②测溶液的pH得知溶液呈酸性,其原因是:____________________ (用离子方程式表示)。
(2)SO2通入FeCl3溶液至饱和,观察到溶液由棕黄色变为红棕色,并没有观察到预期的现象。将反应后的溶液放置12小时后又出现了预期的结果。
查阅资料得知[Fe(HSO3)]2+为红棕色,生成[Fe(HSO3)]2+的反应为可逆反应。请你用化学方程式解释将SO2通入FeCl3溶液至饱和时观察到的现象:_______________ 。
(3)为了探究如何缩短红棕色变为预期颜色的时间,小组继续探究:另取少量FeCl3溶液,再通入SO2溶液变为红棕色,加浓HCl酸化,几分钟后变为预期颜色。
请你推测小组在实验方案设计中“加浓HCl酸化”的目的是:_______________ 。
III.感悟与分享
通过探究,小组同学深受启发、感悟良多。比如,有同学认为“实验才是化学的最高法庭”。请写出一种你的感悟与同学分享:______________________ 。
I.理论预测
该兴趣小组实验实施前进行了充分的讨论交流,确定选择SO2和FeCl3溶液的反应来探究,并预测将SO2通入FeCl3溶液中的现象。小组同学想听听你的分析,你认为可能观察到的现象是:
II.实验探究
(1)配制1mol/LFeCl3溶液(未用盐酸酸化)
①下面是小组四位同学在配制溶液时的“转移”操作,其中正确的是:

②测溶液的pH得知溶液呈酸性,其原因是:
(2)SO2通入FeCl3溶液至饱和,观察到溶液由棕黄色变为红棕色,并没有观察到预期的现象。将反应后的溶液放置12小时后又出现了预期的结果。
查阅资料得知[Fe(HSO3)]2+为红棕色,生成[Fe(HSO3)]2+的反应为可逆反应。请你用化学方程式解释将SO2通入FeCl3溶液至饱和时观察到的现象:
(3)为了探究如何缩短红棕色变为预期颜色的时间,小组继续探究:另取少量FeCl3溶液,再通入SO2溶液变为红棕色,加浓HCl酸化,几分钟后变为预期颜色。
请你推测小组在实验方案设计中“加浓HCl酸化”的目的是:
III.感悟与分享
通过探究,小组同学深受启发、感悟良多。比如,有同学认为“实验才是化学的最高法庭”。请写出一种你的感悟与同学分享:
您最近一年使用:0次



