1 . 硫酸是重要的化工原料,工业制取硫酸最重要的一步反应为: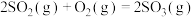

(1)为提高 的转化率,可通入过量
的转化率,可通入过量 ,用平衡移动原理解释其原因:
,用平衡移动原理解释其原因:___________ 。
(2)某兴趣小组在实验室对该反应进行研究,部分实验数据和图象(如图)如下。反应条件:催化剂、一定温度、容积10L。

①实验i中 的转化率为
的转化率为___________ 。
②
___________ 。
③ 、
、 、
、 中,达到化学平衡状态的是
中,达到化学平衡状态的是___________ 。
(3)已知 :
: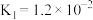 、
、 ,常温下,将
,常温下,将 通入氨水中,当溶液中的
通入氨水中,当溶液中的 时,此时使溶液的PH为
时,此时使溶液的PH为___________ 。
(4) 具有还原性,现用0.001
具有还原性,现用0.001 酸性
酸性 溶液滴定未知浓度的
溶液滴定未知浓度的 溶液,反应的离子方程式是
溶液,反应的离子方程式是 。实验时,应用
。实验时,应用___________ (填“酸式”或“碱式”)滴定管量取酸性高锰酸钾溶液,滴定达到终点的标志是___________ 。
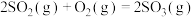

(1)为提高
 的转化率,可通入过量
的转化率,可通入过量 ,用平衡移动原理解释其原因:
,用平衡移动原理解释其原因:(2)某兴趣小组在实验室对该反应进行研究,部分实验数据和图象(如图)如下。反应条件:催化剂、一定温度、容积10L。
| 实验 | 起始物质的量/mol | 平衡时 物质的量/mol 物质的量/mol | ||
 |  |  | ||
| i | 0.2 | 0.1 | 0 | 0.14 |
| ii | 0 | 0 | 0.2 | a |

①实验i中
 的转化率为
的转化率为②

③
 、
、 、
、 中,达到化学平衡状态的是
中,达到化学平衡状态的是(3)已知
 :
: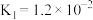 、
、 ,常温下,将
,常温下,将 通入氨水中,当溶液中的
通入氨水中,当溶液中的 时,此时使溶液的PH为
时,此时使溶液的PH为(4)
 具有还原性,现用0.001
具有还原性,现用0.001 酸性
酸性 溶液滴定未知浓度的
溶液滴定未知浓度的 溶液,反应的离子方程式是
溶液,反应的离子方程式是 。实验时,应用
。实验时,应用
您最近一年使用:0次
名校
2 . 探究化学反应的快慢和限度具有十分重要的意义。
Ⅰ.某实验小组欲通过用酸性KMnO4和H2C2O4(草酸)反应测定单位时间内生成CO2的速率研究影响反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:

(1)上述反应的离子方程式为:___ ,该实验探究的是___ 对化学反应速率的影响。
(2)若实验①在2min末收集了4.48mLCO2(标准状况下),则在2min末,c(MnO )=
)=____ mol·L-1(假设混合溶液的体积为50mL,反应前后体积变化忽略不计)。
(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定____ 来比较化学反应速率。
(4)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:___ 。
Ⅱ.K2Cr2O7溶液中存在平衡:Cr2O (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+。用K2Cr2O7溶液进行下列实验:
(黄色)+2H+。用K2Cr2O7溶液进行下列实验:

(5)向K2Cr2O7溶液中加入30%NaOH溶液,溶液呈____ 色,若再加入过量稀硫酸,则溶液呈____ 色。
(6)向K2Cr2O7溶液中逐滴加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡向着____ 方向移动,溶液颜色变化为___ 。对比实验②和④可得出的结论是___ 。
Ⅰ.某实验小组欲通过用酸性KMnO4和H2C2O4(草酸)反应测定单位时间内生成CO2的速率研究影响反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:

| 实验序号 | A溶液 | B溶液 |
| ① | 20mL0.1mol·L-1 H2C2O4溶液 | 30mL0.01mol·L-1 KMnO4溶液 |
| ② | 20mL0.2mol·L-1 H2C2O4溶液 | 30mL0.01mol·L-1 KMnO4溶液 |
(2)若实验①在2min末收集了4.48mLCO2(标准状况下),则在2min末,c(MnO
 )=
)=(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定
(4)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:
Ⅱ.K2Cr2O7溶液中存在平衡:Cr2O
 (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+。用K2Cr2O7溶液进行下列实验:
(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
(5)向K2Cr2O7溶液中加入30%NaOH溶液,溶液呈
(6)向K2Cr2O7溶液中逐滴加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡向着
您最近一年使用:0次
2021-09-30更新
|
430次组卷
|
3卷引用:广西博白县中学2021-2022学年高二上学期第一次月考理综化学试题
解题方法
3 . 某电子厂排放的酸性废液中含有Fe3+、Cu2+、Fe2+、Cl-等离子,以这种废液为原料设计制备高纯Fe2O3的工艺流程如图(部分操作和条件略):

已知:①HCl(浓)+FeCl3 HFeCl4(易溶于有机溶剂);
HFeCl4(易溶于有机溶剂);
②Ksp[Fe(OH)3]=8.0×10-38,lg2=0.3。
回答下列问题:
(1)工厂废液浓缩的目的是_______ ,通入氯气发生的氧化还原反应离子方程式为_______ 。
(2)萃取剂要求:①被萃取物在其中的溶解度要大、②与原溶剂不互溶、③_______ ,加水反萃取能发生的原因是_______ (从化学平衡的角度进行解释)。
(3)加入氨水得到的沉淀常用冰水洗涤,目的是_______ ,检验洗涤是否干净的操作为:取最后一次洗出液,向其中滴加_______ ,观察是否有沉淀生成。
(4)加入氨水使溶液中的Fe3+沉淀完全(浓度小于1×10-5 mol·L-1),需调节溶液pH范围为_______ 。

已知:①HCl(浓)+FeCl3
 HFeCl4(易溶于有机溶剂);
HFeCl4(易溶于有机溶剂);②Ksp[Fe(OH)3]=8.0×10-38,lg2=0.3。
回答下列问题:
(1)工厂废液浓缩的目的是
(2)萃取剂要求:①被萃取物在其中的溶解度要大、②与原溶剂不互溶、③
(3)加入氨水得到的沉淀常用冰水洗涤,目的是
(4)加入氨水使溶液中的Fe3+沉淀完全(浓度小于1×10-5 mol·L-1),需调节溶液pH范围为
您最近一年使用:0次
2021-03-18更新
|
213次组卷
|
2卷引用:广西河池市九校2020-2021学年高二下学期第二次联考化学试题
10-11高三上·江苏盐城·期中
名校
4 . 重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O

试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:___________ 。
(2)操作③的目的是什么,用简要的文字说明:____________________________ 。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:_______ 。
(4)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是:________________ ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度(设整个过程中其它杂质不参与反应)____________ 。
 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:
(2)操作③的目的是什么,用简要的文字说明:
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
(4)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判断达到滴定终点的依据是:
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度(设整个过程中其它杂质不参与反应)
您最近一年使用:0次
名校
5 . 在密闭容器中进行反应:①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1=a kJ·mol-1反应②2CO(g)+O2(g)
FeO(s)+CO(g) ΔH1=a kJ·mol-1反应②2CO(g)+O2(g) 2CO2(g) △H2=bkJ·mol-1
2CO2(g) △H2=bkJ·mol-1
(1)写出铁块与氧气生成1mol氧化亚铁固体的热化学方程式____ 。
(2)反应①的化学平衡常数表达式K=___ ,已知500℃时反应①的平衡常数K=1.0,在此温度下2L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为___ ,CO的平衡浓度为____ 。
(3)反应②的逆反应速率与时间的关系如图所示。由图可知,反应在t1、t3时都达到了平衡,而t2、t4时都只改变了一种条件,试判断改变的条件:t2时___ ;t4时____ 。

 FeO(s)+CO(g) ΔH1=a kJ·mol-1反应②2CO(g)+O2(g)
FeO(s)+CO(g) ΔH1=a kJ·mol-1反应②2CO(g)+O2(g) 2CO2(g) △H2=bkJ·mol-1
2CO2(g) △H2=bkJ·mol-1(1)写出铁块与氧气生成1mol氧化亚铁固体的热化学方程式
(2)反应①的化学平衡常数表达式K=
(3)反应②的逆反应速率与时间的关系如图所示。由图可知,反应在t1、t3时都达到了平衡,而t2、t4时都只改变了一种条件,试判断改变的条件:t2时

您最近一年使用:0次
解题方法
6 . 铜及其化合物有广泛的应用。氯化亚铜(CuCl)微溶于水,不溶于酒精,在潮湿空气中易水解氧化。某课外小组以某工业废渣(主要成分为硅、铜、碳等)为原料制备CuCl的流程示意图如图所示。
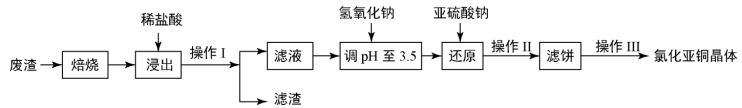
(1)“滤渣”的主要成分为______ (填化学式)。
(2)“还原”过程中Cu2+还原为CuCl,请写出反应的离子方程式:_________ 。
(3)还原过程中加入的Na2SO3过量,目的是除去氧气防止CuCl被氧化,原理是______ (用化学方程式表示)。
(4)CuCl在潮湿的环境中容易被氧化生成Cu2(OH)3Cl,反应化学方程式是__________ 。
(5)CuCl粗品中含有Cu2+加入铜粉和盐酸,Cu2+转化为CuCl,反应的离子方程式是__________ ,操作Ⅲ中包括对滤饼的醇洗,醇洗的目的是_________ 。
(6)CuCl在含有Cl-的溶液中存在平衡:CuCl+2Cl- [CuCl3]2-,加水稀释,Cl-浓度
[CuCl3]2-,加水稀释,Cl-浓度__________ (填写“变大”、“变小”或“”不变)。

(1)“滤渣”的主要成分为
(2)“还原”过程中Cu2+还原为CuCl,请写出反应的离子方程式:
(3)还原过程中加入的Na2SO3过量,目的是除去氧气防止CuCl被氧化,原理是
(4)CuCl在潮湿的环境中容易被氧化生成Cu2(OH)3Cl,反应化学方程式是
(5)CuCl粗品中含有Cu2+加入铜粉和盐酸,Cu2+转化为CuCl,反应的离子方程式是
(6)CuCl在含有Cl-的溶液中存在平衡:CuCl+2Cl-
 [CuCl3]2-,加水稀释,Cl-浓度
[CuCl3]2-,加水稀释,Cl-浓度
您最近一年使用:0次
解题方法
7 . 化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g) 2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
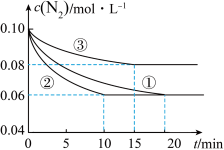
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=__________________ ;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的__________ 、__________ (填字母编号)。
a.增大压强
b.减小压强
c.升高温度
d.降低温度
e.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05mol/L,则该反应的平衡常数K=__________ ;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将__________ (填“增大”、“减小”或“不变”)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时间的变化如图所示。下列说法正确的是__________ (填字母编号)。
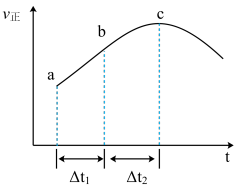
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.Δt1=Δt2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a______ b。 (填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数Kb=
H2O的电离平衡常数Kb=________________ 。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g)
 2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=
a.增大压强
b.减小压强
c.升高温度
d.降低温度
e.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g)
 N2O4(g)。
N2O4(g)。①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05mol/L,则该反应的平衡常数K=
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时间的变化如图所示。下列说法正确的是

A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.Δt1=Δt2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a
 H2O的电离平衡常数Kb=
H2O的电离平衡常数Kb=
您最近一年使用:0次
2016-12-09更新
|
406次组卷
|
3卷引用:2016届广西来宾市高三上学期期末调研理综化学试卷



