化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g) 2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
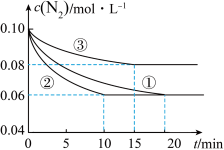
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=__________________ ;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的__________ 、__________ (填字母编号)。
a.增大压强
b.减小压强
c.升高温度
d.降低温度
e.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05mol/L,则该反应的平衡常数K=__________ ;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将__________ (填“增大”、“减小”或“不变”)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时间的变化如图所示。下列说法正确的是__________ (填字母编号)。
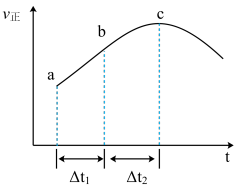
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.Δt1=Δt2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a______ b。 (填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数Kb=
H2O的电离平衡常数Kb=________________ 。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g)
 2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=
a.增大压强
b.减小压强
c.升高温度
d.降低温度
e.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g)
 N2O4(g)。
N2O4(g)。①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05mol/L,则该反应的平衡常数K=
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时间的变化如图所示。下列说法正确的是

A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.Δt1=Δt2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a
 H2O的电离平衡常数Kb=
H2O的电离平衡常数Kb=
更新时间:2016-12-09 14:53:21
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】工业上常用如下反应来消除 污染:
污染:
 ,请回答下列有关问题(不考虑
,请回答下列有关问题(不考虑 和
和 的相互转化):
的相互转化):
(1)600℃时,在 恒容密闭容器中加入一定量的反应物,选用不同的催化剂A、B、C进行反应,产生
恒容密闭容器中加入一定量的反应物,选用不同的催化剂A、B、C进行反应,产生 的物质的量随时间的变化如图所示:
的物质的量随时间的变化如图所示:
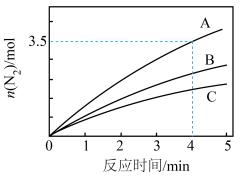
①在催化剂A的作用下 内的
内的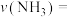
___________ ,三种条件下的活化能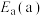 、
、 、
、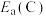 中最大的是
中最大的是___________ 。
②若在恒容密闭的绝热容器中按照 充入反应物,在起始温度600℃下发生反应。下列不能判断该反应达到平衡状态的是
充入反应物,在起始温度600℃下发生反应。下列不能判断该反应达到平衡状态的是___________ (填序号)。
a.容器中混合气体的压强不变
b.容器中混合气体的颜色不变
c.容器中混合气体的密度不变
d.容器中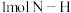 键断裂的同时,有
键断裂的同时,有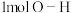 健形成
健形成
e.容器中的温度保持不变
(2)其他条件相同,以一定流速分别向含催化剂A和B的反应管中通入一定比例的 和
和 ,测得
,测得 的去除率与温度的关系如图所示。使用催化剂B,360℃下的
的去除率与温度的关系如图所示。使用催化剂B,360℃下的 的去除率为80%,此时反应是否已达到平衡状态?
的去除率为80%,此时反应是否已达到平衡状态?___________ (填“是”或“否”)。若在360℃、催化剂B的条件下,该反应速率 ,
,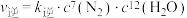 (
( 、
、 分别是正、逆反应速率常数),则该反应的平衡常数
分别是正、逆反应速率常数),则该反应的平衡常数
___________ (用含 、
、 的代数式表示)。
的代数式表示)。

(3)在某密闭容器中加入一定量的 和
和 ,反应中
,反应中 的平衡转化率与温度、压强的关系如图所示,则
的平衡转化率与温度、压强的关系如图所示,则
___________  (填“>”“<”或“=”,下同),若在
(填“>”“<”或“=”,下同),若在 和
和 的条件下,a点对应
的条件下,a点对应 的
的
___________  。
。

 污染:
污染:
 ,请回答下列有关问题(不考虑
,请回答下列有关问题(不考虑 和
和 的相互转化):
的相互转化):(1)600℃时,在
 恒容密闭容器中加入一定量的反应物,选用不同的催化剂A、B、C进行反应,产生
恒容密闭容器中加入一定量的反应物,选用不同的催化剂A、B、C进行反应,产生 的物质的量随时间的变化如图所示:
的物质的量随时间的变化如图所示:
①在催化剂A的作用下
 内的
内的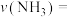
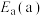 、
、 、
、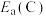 中最大的是
中最大的是②若在恒容密闭的绝热容器中按照
 充入反应物,在起始温度600℃下发生反应。下列不能判断该反应达到平衡状态的是
充入反应物,在起始温度600℃下发生反应。下列不能判断该反应达到平衡状态的是a.容器中混合气体的压强不变
b.容器中混合气体的颜色不变
c.容器中混合气体的密度不变
d.容器中
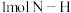 键断裂的同时,有
键断裂的同时,有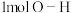 健形成
健形成e.容器中的温度保持不变
(2)其他条件相同,以一定流速分别向含催化剂A和B的反应管中通入一定比例的
 和
和 ,测得
,测得 的去除率与温度的关系如图所示。使用催化剂B,360℃下的
的去除率与温度的关系如图所示。使用催化剂B,360℃下的 的去除率为80%,此时反应是否已达到平衡状态?
的去除率为80%,此时反应是否已达到平衡状态? ,
,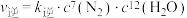 (
( 、
、 分别是正、逆反应速率常数),则该反应的平衡常数
分别是正、逆反应速率常数),则该反应的平衡常数
 、
、 的代数式表示)。
的代数式表示)。
(3)在某密闭容器中加入一定量的
 和
和 ,反应中
,反应中 的平衡转化率与温度、压强的关系如图所示,则
的平衡转化率与温度、压强的关系如图所示,则
 (填“>”“<”或“=”,下同),若在
(填“>”“<”或“=”,下同),若在 和
和 的条件下,a点对应
的条件下,a点对应 的
的
 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】将CO2转化为更有价值的化工原料,正成为科学家们研究的一个重要领域。回答下列问题:
Ⅰ.在活性Fe的催化下将CO2加氢转化为CO,经历的两个基元反应如下:
反应①:Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1 平衡常数为K1;
FeO(s)+CO(g) ΔH1 平衡常数为K1;
反应②:FeO(s)+H2(g) Fe(s)+H2O(g) ΔH2 平衡常数为K2;
Fe(s)+H2O(g) ΔH2 平衡常数为K2;
在不同温度时K1、K2的值如下表:
(1)由表中数据可知反应①是________ (填“吸热”或“放热”)反应。700℃时总反应CO2(g)+H2(g) CO(g)+H2O(g)的化学平衡常数K3=
CO(g)+H2O(g)的化学平衡常数K3=________ 。
Ⅱ. CO2和CO加氢都可以制CH3OH,热化学方程式分别为:
③ CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3 = -49kJ·mol-1,
CH3OH(g)+H2O(g) ΔH3 = -49kJ·mol-1,
④ CO(g)+2H2(g) CH3OH(g) ΔH4 = -90 kJ·mol-1
CH3OH(g) ΔH4 = -90 kJ·mol-1
(2)CO2(g)+H2(g) CO(g)+H2O(g)的反应为 ΔH =
CO(g)+H2O(g)的反应为 ΔH =________ ;
(3)CO2加氢制CH3OH的过程中,为了提高CO2的转化率,可以采取的措施是____________ (任写1条)。
(4)已知反应④CO(g)+2H2(g) CH3OH(g) 的速率表达式为v(CO) =k·cm(CO)·cn(H2) (k、m、n待测,k为速率常数,一般只受温度影响)。T℃时测得有关实验数据如下:
CH3OH(g) 的速率表达式为v(CO) =k·cm(CO)·cn(H2) (k、m、n待测,k为速率常数,一般只受温度影响)。T℃时测得有关实验数据如下:
分析上表中的数据,当速率以mol·L-1·s-1为单位时,k =________ 、m =________ 、n =________ ;在该温度下、在的密闭容器中,充入0.1mol ·L-1 CO 和0.2 mol·L-1 H2,则起始化学反应速率v(H2)= ________ 。
Ⅰ.在活性Fe的催化下将CO2加氢转化为CO,经历的两个基元反应如下:
反应①:Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH1 平衡常数为K1;
FeO(s)+CO(g) ΔH1 平衡常数为K1;反应②:FeO(s)+H2(g)
 Fe(s)+H2O(g) ΔH2 平衡常数为K2;
Fe(s)+H2O(g) ΔH2 平衡常数为K2;在不同温度时K1、K2的值如下表:
| 700℃ | 900℃ | |
| K1 | 1.5 | 2.0 |
| K2 | 0.4 | 0.6 |
(1)由表中数据可知反应①是
 CO(g)+H2O(g)的化学平衡常数K3=
CO(g)+H2O(g)的化学平衡常数K3=Ⅱ. CO2和CO加氢都可以制CH3OH,热化学方程式分别为:
③ CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH3 = -49kJ·mol-1,
CH3OH(g)+H2O(g) ΔH3 = -49kJ·mol-1,④ CO(g)+2H2(g)
 CH3OH(g) ΔH4 = -90 kJ·mol-1
CH3OH(g) ΔH4 = -90 kJ·mol-1 (2)CO2(g)+H2(g)
 CO(g)+H2O(g)的反应为 ΔH =
CO(g)+H2O(g)的反应为 ΔH =(3)CO2加氢制CH3OH的过程中,为了提高CO2的转化率,可以采取的措施是
(4)已知反应④CO(g)+2H2(g)
 CH3OH(g) 的速率表达式为v(CO) =k·cm(CO)·cn(H2) (k、m、n待测,k为速率常数,一般只受温度影响)。T℃时测得有关实验数据如下:
CH3OH(g) 的速率表达式为v(CO) =k·cm(CO)·cn(H2) (k、m、n待测,k为速率常数,一般只受温度影响)。T℃时测得有关实验数据如下:| 序号 | c(CO)/(mol·L-1) | c(H2)/(mol·L-1) | v(CO)/(mol·L-1·s-1) |
| ① | 0.01 | 0.01 | 2.0×10-6 |
| ② | 0.02 | 0.01 | 4.0×10-6 |
| ③ | 0.01 | 0.02 | 8.0×10-6 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】甲醇是重要的化工原料,利用煤化工生产中的CO和 ,可制取甲醇,发生的反应为
,可制取甲醇,发生的反应为
 。
。
(1)关于反应 ,下列说法正确的是
,下列说法正确的是__________ (填序号)。
A.该反应在任何温度下都能自发进行
B.升高温度,正反应速率增大,逆反应速率减小
C.使用催化剂,不能提高CO的平衡转化率
D.增大压强,该反应的化学平衡常数不变
(2)在某温度下,将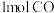 与
与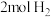 充入体积为
充入体积为 的钢瓶中,发生反应
的钢瓶中,发生反应 ,在第
,在第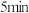 达到化学平衡状态,此时甲醇的物质的量分数为
达到化学平衡状态,此时甲醇的物质的量分数为 。已知甲醇的浓度随时间的变化情况如图所示:
。已知甲醇的浓度随时间的变化情况如图所示:

①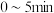 内,用甲醇表示的平均反应速率为
内,用甲醇表示的平均反应速率为_______________ 。
② 的平衡转化率
的平衡转化率
_________________ ,化学平衡常数K=_____________ (保留两位有效数字)。
③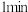 时,v正
时,v正__________ (填“大于”“小于”或“等于”)v逆。
④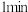 时v正
时v正_____________ (填“大于”“小于”或“等于”)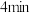 时v逆。
时v逆。
⑤若将钢瓶换成等容积的绝热容器,重复上述实验,平衡时甲醇的物质的量分数______________ (填“大于”“小于”或“等于”) 。
。
 ,可制取甲醇,发生的反应为
,可制取甲醇,发生的反应为
 。
。(1)关于反应
 ,下列说法正确的是
,下列说法正确的是A.该反应在任何温度下都能自发进行
B.升高温度,正反应速率增大,逆反应速率减小
C.使用催化剂,不能提高CO的平衡转化率
D.增大压强,该反应的化学平衡常数不变
(2)在某温度下,将
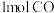 与
与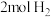 充入体积为
充入体积为 的钢瓶中,发生反应
的钢瓶中,发生反应 ,在第
,在第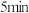 达到化学平衡状态,此时甲醇的物质的量分数为
达到化学平衡状态,此时甲醇的物质的量分数为 。已知甲醇的浓度随时间的变化情况如图所示:
。已知甲醇的浓度随时间的变化情况如图所示:
①
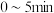 内,用甲醇表示的平均反应速率为
内,用甲醇表示的平均反应速率为②
 的平衡转化率
的平衡转化率
③
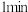 时,v正
时,v正④
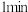 时v正
时v正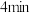 时v逆。
时v逆。⑤若将钢瓶换成等容积的绝热容器,重复上述实验,平衡时甲醇的物质的量分数
 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某实验小组同学用KSCN探究久置FeSO4固体变质的情况。将0.3gFeSO4固体用10mL蒸馏水溶解,配成待测液,进行实验。
【初步实验】
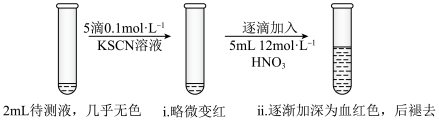
(1)用KSCN检验Fe3+的原理是___________ (用离子方程式表示)。
(2)甲同学认为FeSO4固体几乎未变质,ⅱ中变血红色是由于Fe2+被___________ (填化学式)氧化。结合平衡移动原理解释ⅱ中血红色褪去的可能原因___________ 。
(3)乙同学不认同甲对现象的解释,他推测加入浓硝酸后ⅱ中变血红色还可能与其它因素有关,可能的影响因素是___________ 。
为验证该猜测,乙同学继续进行了以下实验。【继续探究】
(4)请补全步骤Ⅱ中的操作:___________ 。
(5)由Ⅰ~Ⅲ推测FeSO4固体变质的情况是___________ (填字母序号)。
a.几乎未变质 b.部分变质 c.完全变质
【反思与迁移】
(6)从上述探究中获得启发,在用KSCN检验Fe3+及进行Fe2+还原性验证实验时,需要注意的事项有___________ (至少2条)。
【初步实验】

(1)用KSCN检验Fe3+的原理是
(2)甲同学认为FeSO4固体几乎未变质,ⅱ中变血红色是由于Fe2+被
(3)乙同学不认同甲对现象的解释,他推测加入浓硝酸后ⅱ中变血红色还可能与其它因素有关,可能的影响因素是
为验证该猜测,乙同学继续进行了以下实验。【继续探究】
| 步骤 | 操作 | 现象 |
| Ⅰ | 取2mL待测液,加入5滴0.1mol·L-1KSCN溶液,再加入5mL浓KNO3溶液 | 溶液无明显变化 |
| Ⅱ | 取2mL待测液,加入5滴0.1mol·L-1KSCN溶液,___________ | 溶液变为红色 |
| Ⅲ | 向Ⅱ中所得溶液中逐滴加入浓硝酸,边加边振荡 | 溶液逐渐加深为血红色,继续滴加浓硝酸,溶液褪色,pH变化始终不明显 |
(4)请补全步骤Ⅱ中的操作:
(5)由Ⅰ~Ⅲ推测FeSO4固体变质的情况是
a.几乎未变质 b.部分变质 c.完全变质
【反思与迁移】
(6)从上述探究中获得启发,在用KSCN检验Fe3+及进行Fe2+还原性验证实验时,需要注意的事项有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】I2O5是白色粉末状固体,在合成氨工业中常用I2O5来定量测量CO的含量。
已知:(I)2I2(s)+5O2(g)=2I2O5(s)
(Π)I2O5(s)+5CO(g) 5CO2(g)+I2(s)
5CO2(g)+I2(s)
(1)结合反应I和反应II分析,I2在CO转化为CO2的反应中所起的作用是______ 。20℃时向装有足量I2O5的2L恒容密闭容器中充入2molCO,发生反应II,反应达到平衡后固体质量减小8g,该温度下反应的平衡常数K=______ (写出计算过程,结果用分数表示)。
(2)若在恒温恒容的密闭体系中进行上述反应II,下列不能说明反应II达到平衡状态的是______ 。
(3)10℃时,某恒容密闭容器中充有足量的I2O5,向该容器中充入CO,发生反应II,平衡时CO2与充入CO的物质的量关系如图所示。
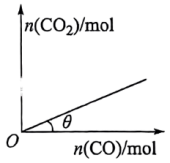
若压缩容器体积;θ值______ (填“增大”“减小”或“不变”),理由是______ 。
已知:(I)2I2(s)+5O2(g)=2I2O5(s)
(Π)I2O5(s)+5CO(g)
 5CO2(g)+I2(s)
5CO2(g)+I2(s)(1)结合反应I和反应II分析,I2在CO转化为CO2的反应中所起的作用是
(2)若在恒温恒容的密闭体系中进行上述反应II,下列不能说明反应II达到平衡状态的是
| A.混合气体的密度保持不变 | B.CO和CO2的物质的量相等 |
| C.v(CO)=v(CO2) | D.混合气体的平均分子量不变 |
(3)10℃时,某恒容密闭容器中充有足量的I2O5,向该容器中充入CO,发生反应II,平衡时CO2与充入CO的物质的量关系如图所示。

若压缩容器体积;θ值
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】Ⅰ.传统的“哈伯法”合成氨原理为: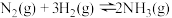
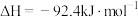
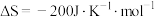
(1)上述反应在常温下___________ (填“能”或“不能”)自发进行。
(2)工业合成氨选择的催化剂是___________ 。
(3)恒温、恒容密闭容器中进行上述反应,一定能说明该反应达到平衡状态的是___________ 。
a. 、
、 、
、 的浓度之比为
的浓度之比为 b.容器内气体压强保持不变
b.容器内气体压强保持不变
c.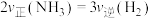 d.混合气体的密度保持不变
d.混合气体的密度保持不变
(4)改变下列条件能加快反应速率,且单位体积内反应物活化分子百分数不变的是___________ 。
a.增大浓度 b.增大压强 c.升高温度 d.使用催化剂
(5)工业合成氨中,下列措施不符合绿色化学理念的是___________ 。
a.将氨气及时液化,分离出反应体系
b.将从反应体系中分离出的 和
和 重新输送到反应器中予以循环利用
重新输送到反应器中予以循环利用
c.氨合成塔中内置热交换器用来预热后续通入的冷的氮气和氢气
d.可采用1000℃的高温使得反应速率更快
Ⅱ.科研小组模拟不同条件下的合成氨反应,向体积可变的密闭容器中充入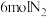 和
和 ,不同温度下平衡时氨气的体积分数与总压强(p)的关系如图所示。
,不同温度下平衡时氨气的体积分数与总压强(p)的关系如图所示。

(6) 、
、 、
、 由小到大的顺序为
由小到大的顺序为___________ 。
(7)在 、
、 条件下,若此时容器体积为
条件下,若此时容器体积为 ,
, 后反应达到平衡,则
后反应达到平衡,则 内
内 的平均反应速率为
的平均反应速率为___________ ,平衡常数
___________ (保留两位有效数字)。
Ⅲ.东南大学王金兰课题组提出合成氨的“表面氢化机理”,在较低的电压下实现氮气的还原合成氨。
已知:第一步: (快)(吸附在催化剂表面的物种用*表示)
(快)(吸附在催化剂表面的物种用*表示)
第二步: (慢)(吸附在催化剂表面)
(慢)(吸附在催化剂表面)
第三步: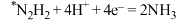 (快)
(快)
(8)较传统工业合成氨法,该方法具有的优点___________ 。
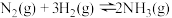
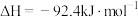
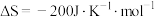
(1)上述反应在常温下
(2)工业合成氨选择的催化剂是
(3)恒温、恒容密闭容器中进行上述反应,一定能说明该反应达到平衡状态的是
a.
 、
、 、
、 的浓度之比为
的浓度之比为 b.容器内气体压强保持不变
b.容器内气体压强保持不变c.
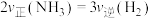 d.混合气体的密度保持不变
d.混合气体的密度保持不变(4)改变下列条件能加快反应速率,且单位体积内反应物活化分子百分数不变的是
a.增大浓度 b.增大压强 c.升高温度 d.使用催化剂
(5)工业合成氨中,下列措施不符合绿色化学理念的是
a.将氨气及时液化,分离出反应体系
b.将从反应体系中分离出的
 和
和 重新输送到反应器中予以循环利用
重新输送到反应器中予以循环利用c.氨合成塔中内置热交换器用来预热后续通入的冷的氮气和氢气
d.可采用1000℃的高温使得反应速率更快
Ⅱ.科研小组模拟不同条件下的合成氨反应,向体积可变的密闭容器中充入
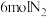 和
和 ,不同温度下平衡时氨气的体积分数与总压强(p)的关系如图所示。
,不同温度下平衡时氨气的体积分数与总压强(p)的关系如图所示。
(6)
 、
、 、
、 由小到大的顺序为
由小到大的顺序为(7)在
 、
、 条件下,若此时容器体积为
条件下,若此时容器体积为 ,
, 后反应达到平衡,则
后反应达到平衡,则 内
内 的平均反应速率为
的平均反应速率为
Ⅲ.东南大学王金兰课题组提出合成氨的“表面氢化机理”,在较低的电压下实现氮气的还原合成氨。
已知:第一步:
 (快)(吸附在催化剂表面的物种用*表示)
(快)(吸附在催化剂表面的物种用*表示)第二步:
 (慢)(吸附在催化剂表面)
(慢)(吸附在催化剂表面)第三步:
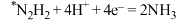 (快)
(快)(8)较传统工业合成氨法,该方法具有的优点
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ、水在 和
和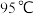 时电离平衡曲线如图。
时电离平衡曲线如图。
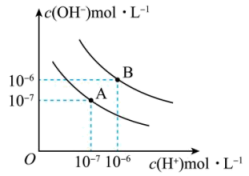
(1)已知在 时,将
时,将 的
的 溶液与
溶液与 的
的 溶液均升温至
溶液均升温至 ,两溶液
,两溶液 变化分别为_______(填字母)。
变化分别为_______(填字母)。
(2)在曲线B所对应的温度下,将 的
的 溶液与
溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则
,则 溶液与
溶液与 溶液的体积比为
溶液的体积比为_______ 。
Ⅱ.通过下列反应制备甲醇: 。在一容积可变的密闭容器中充入
。在一容积可变的密闭容器中充入 和
和 ,
, 的平衡转化率随温度(T)、压强(P)的变化如下图所示。
的平衡转化率随温度(T)、压强(P)的变化如下图所示。
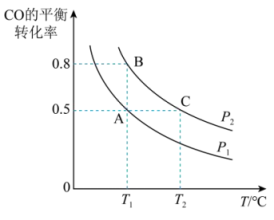
(3)比较A、B两点压强大小: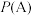
_______ 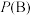 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(4)若达到化学平衡状态A时,容器的体积为 。如果反应开始时仍充入
。如果反应开始时仍充入 和
和 ,则在平衡状态B时容器的体积为
,则在平衡状态B时容器的体积为_______ L。
 和
和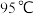 时电离平衡曲线如图。
时电离平衡曲线如图。
(1)已知在
 时,将
时,将 的
的 溶液与
溶液与 的
的 溶液均升温至
溶液均升温至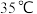 ,两溶液
,两溶液 变化分别为_______(填字母)。
变化分别为_______(填字母)。| A.增加、减小 | B.增加、增加 | C.减小、不变 | D.不变、减小 |
 的
的 溶液与
溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则
,则 溶液与
溶液与 溶液的体积比为
溶液的体积比为Ⅱ.通过下列反应制备甲醇:
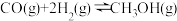 。在一容积可变的密闭容器中充入
。在一容积可变的密闭容器中充入 和
和 ,
, 的平衡转化率随温度(T)、压强(P)的变化如下图所示。
的平衡转化率随温度(T)、压强(P)的变化如下图所示。
(3)比较A、B两点压强大小:
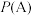
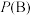 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(4)若达到化学平衡状态A时,容器的体积为
 。如果反应开始时仍充入
。如果反应开始时仍充入 和
和 ,则在平衡状态B时容器的体积为
,则在平衡状态B时容器的体积为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】
(1)常温下,已知0.1 mol·L-1一元酸HA溶液中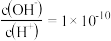 ,则溶液的pH=
,则溶液的pH=_____________ 。
①pH=2的HA与pH=11的NaOH溶液等体积混合;反应的离子方程式为______________ ;混合溶液中,各离子的物质的量浓度大小关系是____________ ;
②0.2 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合后所得溶液中(溶液体积变化忽略不计):c(H+)+c(HA)-c(OH-)=____________ mol·L-1。
(2)t℃时,有pH=1的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=___________ 。
①该温度下(t℃),将100mL0.1 mol·L-1的稀H2SO4与100mL0.4 mol·L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=___________ ;
②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是_______________ 。
③该温度下(t℃),设pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为c2,则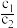 =
=__________
(1)常温下,已知0.1 mol·L-1一元酸HA溶液中
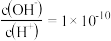 ,则溶液的pH=
,则溶液的pH=①pH=2的HA与pH=11的NaOH溶液等体积混合;反应的离子方程式为
②0.2 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合后所得溶液中(溶液体积变化忽略不计):c(H+)+c(HA)-c(OH-)=
(2)t℃时,有pH=1的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=
①该温度下(t℃),将100mL0.1 mol·L-1的稀H2SO4与100mL0.4 mol·L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=
②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是
③该温度下(t℃),设pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为c2,则
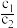 =
=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】(1)已知水在25℃和100℃时,其电离平衡曲线如图所示:
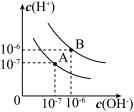
①则25℃时水的电离平衡曲线应为_____ 。(填“A”或“B”)
②25℃下,下列三种溶液中,由水电离出的氢离子的物质的量浓度之比a:b:c=_____ 。
a.pH=1的盐酸b.pH=2的盐酸c.pH=12的NaOH溶液
③25℃下,若VaLpH=a的盐酸与VbLpH=b的NaOH溶液恰好中和,a+b=13,则Va:Vb=_____ 。
(2)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=13。
①该温度下水的Kw=_____ 。
②此温度下,将pH=1的盐酸溶液VaL与pH=14的NaOH溶液VbL混合(忽略体积变化),混合后溶液的pH为2,则Va:Vb=_____ 。
(3)下列说法中正确的是_____ 。
a.25℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液pH>7
b.100℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液恰好中和,所得溶液pH=7
c.25℃时,由水电离出的氢离子浓度为1×10-10mol/L的溶液中可能大量存在NH4+和Cl-

①则25℃时水的电离平衡曲线应为
②25℃下,下列三种溶液中,由水电离出的氢离子的物质的量浓度之比a:b:c=
a.pH=1的盐酸b.pH=2的盐酸c.pH=12的NaOH溶液
③25℃下,若VaLpH=a的盐酸与VbLpH=b的NaOH溶液恰好中和,a+b=13,则Va:Vb=
(2)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=13。
①该温度下水的Kw=
②此温度下,将pH=1的盐酸溶液VaL与pH=14的NaOH溶液VbL混合(忽略体积变化),混合后溶液的pH为2,则Va:Vb=
(3)下列说法中正确的是
a.25℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液pH>7
b.100℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液恰好中和,所得溶液pH=7
c.25℃时,由水电离出的氢离子浓度为1×10-10mol/L的溶液中可能大量存在NH4+和Cl-
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为____________ 。
(2)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

①写出H2N2O2在水溶液中的电离方程式:______________ 。
②常温下H2N2O2的Ka1约为______________
③b点时溶液中c(H2N2O2)_____ (填“>”、“<”或“=”,下同)c(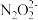 )。
)。
④a点时溶液中c(Na+)________ c(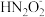 )+c(
)+c(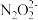 )。
)。
⑤a、b、c三点,水的电离程度最大的是__________ 。
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中 =
=______ 。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
(1)连二次硝酸中氮元素的化合价为
(2)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

①写出H2N2O2在水溶液中的电离方程式:
②常温下H2N2O2的Ka1约为
③b点时溶液中c(H2N2O2)
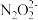 )。
)。④a点时溶液中c(Na+)
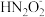 )+c(
)+c(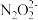 )。
)。⑤a、b、c三点,水的电离程度最大的是
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中
 =
=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】醋酸是日常生活中的常见的有机物。
(1)国家规定酿造的食醋中每100mL食醋中醋酸的含量不得低于3.5g,某实验小组用酸碱滴定法测定某白醋中醋酸的含量(g/100mL),设计如下实验:
I.用酸式滴定管量取25.00mL白醋,配制成250mL待测白醋溶液。
II.用酸式滴定管量取待测白醋溶液25.00mL于锥形瓶中,加入1~2滴指示剂。
III.用碱式滴定管盛装0.1000mol/LNaOH标准溶液进行滴定。
IV.重复滴定几次,数排记录如下表。
①可以说明醋酸是弱酸的事实是_______ 。
A.醋酸易溶于水 B.醋酸能与 溶液反应生成
溶液反应生成
C.醋酸的水溶液能使酸碱指示剂变色 D.室温下0.1mol/L的醋酸溶液
②若滴定管中液面如图所示,则该读数为_______ 。

③已知醋酸钠溶液因水解显弱碱性。滴定实验中应选用的最佳指示剂为_______
A.甲基橙 B.淀粉 C.石蕊 D.酚酞
④由表中数据,计算市售的白醋中醋酸的含量为_______ g/100mL。
⑤滴定过程中出现以下情况,会使测定结果偏高的是_______ 。
A.滴定前,锥形瓶和碱式滴定管均用待装溶液润洗
B.滴定过程中,锥形瓶中溶液变色后立即停止滴定
C.初始读数正确,滴定终点时,读取标准溶液体积时俯视滴定管液面
D.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡
(2)若用0.1mol/LNaOH溶液分别测定体积均为20mL,浓度均为0.1mol/L的盐酸和醋酸溶液,滴定过程中的两条滴定曲线如图所示。(醋酸钠溶液因水解显弱碱性)
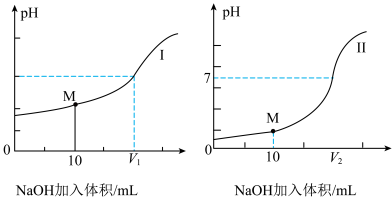
①表示盐酸与NaOH溶液的滴定图像的是曲线_______ (填“I”、“II”)。
②25℃,滴定醋酸溶液达 时,根据加入NaOH的体积,计算醋酸的电离常数为
时,根据加入NaOH的体积,计算醋酸的电离常数为
_______ (用含 或
或 的代数式表示)。
的代数式表示)。
(1)国家规定酿造的食醋中每100mL食醋中醋酸的含量不得低于3.5g,某实验小组用酸碱滴定法测定某白醋中醋酸的含量(g/100mL),设计如下实验:
I.用酸式滴定管量取25.00mL白醋,配制成250mL待测白醋溶液。
II.用酸式滴定管量取待测白醋溶液25.00mL于锥形瓶中,加入1~2滴指示剂。
III.用碱式滴定管盛装0.1000mol/LNaOH标准溶液进行滴定。
IV.重复滴定几次,数排记录如下表。
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.05 | 21.06 |
| 2 | 25.00 | 1.98 | 21.97 |
| 3 | 25.00 | 0.20 | 21.20 |
| 4 | 25.00 | 0.45 | 20.45 |
A.醋酸易溶于水 B.醋酸能与
 溶液反应生成
溶液反应生成
C.醋酸的水溶液能使酸碱指示剂变色 D.室温下0.1mol/L的醋酸溶液

②若滴定管中液面如图所示,则该读数为

③已知醋酸钠溶液因水解显弱碱性。滴定实验中应选用的最佳指示剂为
A.甲基橙 B.淀粉 C.石蕊 D.酚酞
④由表中数据,计算市售的白醋中醋酸的含量为
⑤滴定过程中出现以下情况,会使测定结果偏高的是
A.滴定前,锥形瓶和碱式滴定管均用待装溶液润洗
B.滴定过程中,锥形瓶中溶液变色后立即停止滴定
C.初始读数正确,滴定终点时,读取标准溶液体积时俯视滴定管液面
D.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡
(2)若用0.1mol/LNaOH溶液分别测定体积均为20mL,浓度均为0.1mol/L的盐酸和醋酸溶液,滴定过程中的两条滴定曲线如图所示。(醋酸钠溶液因水解显弱碱性)

①表示盐酸与NaOH溶液的滴定图像的是曲线
②25℃,滴定醋酸溶液达
 时,根据加入NaOH的体积,计算醋酸的电离常数为
时,根据加入NaOH的体积,计算醋酸的电离常数为
 或
或 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】I.已知25℃时,乙酸和碳酸的电离平衡常数如下表:
(1)用饱和氨水吸收CO2可得到NH4HCO3溶液,若已知CH3COONH4溶液pH=7,则NH4HCO3溶液显___ (填“酸性”、“碱性”或“中性”)。
(2)25℃时,在0.lmol/L乙酸溶液中加入一定量的NaHCO3,保持温度不变,所得混合液的pH=6,那么混合液中 =
=_______ ,该混合溶液中的离子浓度由大到小的顺序为:_______ 。
Ⅱ.某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。请回答:
(1)以上步骤有错误的是(填编号)_____________________ ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)______________________ 。
(2)判断滴定终点的现象是:_______________________ 。
(3)如下图是某次滴定时的滴定管中的液面,其读数为______________ mL。

(4)根据下列数据:请计算待测盐酸溶液的浓度:_____________________ mol/L。
| 物质的化学式 | CH3COOH | H2CO3 | |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
(2)25℃时,在0.lmol/L乙酸溶液中加入一定量的NaHCO3,保持温度不变,所得混合液的pH=6,那么混合液中
 =
=Ⅱ.某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。请回答:
(1)以上步骤有错误的是(填编号)
(2)判断滴定终点的现象是:
(3)如下图是某次滴定时的滴定管中的液面,其读数为

(4)根据下列数据:请计算待测盐酸溶液的浓度:
| 滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
您最近一年使用:0次



