解题方法
1 . 某班同学用如下实验探究 、
、 的性质,回答下列问题:
的性质,回答下列问题:
(1)分别取一定量 、
、 固体,均配制成0.1 mol⋅L-1的溶液。在
固体,均配制成0.1 mol⋅L-1的溶液。在 溶液中需加入少量铁屑,其目的是
溶液中需加入少量铁屑,其目的是___________ (用化学方程式表示)。
(2)甲组同学取2 mL 0.1 mol⋅L-1 溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红。或滴1滴KSCN溶液,无明显现象,再滴加几滴3%H2O2溶液(用
溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红。或滴1滴KSCN溶液,无明显现象,再滴加几滴3%H2O2溶液(用 酸化至
酸化至 ),溶液颜色变红。甲组同学通过上述实验分析
),溶液颜色变红。甲组同学通过上述实验分析 具有
具有___________ (填“氧化”或“还原”)性。 与KSCN溶液反应的离子方程式为
与KSCN溶液反应的离子方程式为___________ 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL 溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是
溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是___________ 。同时乙组同学查阅资料发现 与
与 可发生反应,生成无色的配合物。为证实该性质,用过量
可发生反应,生成无色的配合物。为证实该性质,用过量 溶液与
溶液与 溶液反应得到
溶液反应得到 ,用于验证
,用于验证 与
与 发生反应,进行a和b两组实验:
发生反应,进行a和b两组实验:

 的制备离子方程式为
的制备离子方程式为___________ ,实验b的目的是___________ ,从沉淀溶解平衡角度解释实验a和b最终溶液颜色不同的原因是___________ 。
(4)丙同学设计实验进一步证明 可与
可与 反应,进行d和c的对照实验。
反应,进行d和c的对照实验。
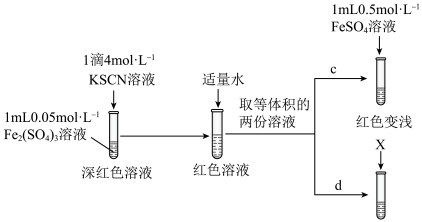
①X为___________ 。
②实验能够证实 可与
可与 反应,则应观察到的现象是
反应,则应观察到的现象是___________ 。
③实验中若未加适量水稀释,则无法通过现象得出结论。推测加水稀释的目的可能有:使后续实验颜色变化易于观察;降低 ,
,___________ 。
 、
、 的性质,回答下列问题:
的性质,回答下列问题:(1)分别取一定量
 、
、 固体,均配制成0.1 mol⋅L-1的溶液。在
固体,均配制成0.1 mol⋅L-1的溶液。在 溶液中需加入少量铁屑,其目的是
溶液中需加入少量铁屑,其目的是(2)甲组同学取2 mL 0.1 mol⋅L-1
 溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红。或滴1滴KSCN溶液,无明显现象,再滴加几滴3%H2O2溶液(用
溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红。或滴1滴KSCN溶液,无明显现象,再滴加几滴3%H2O2溶液(用 酸化至
酸化至 ),溶液颜色变红。甲组同学通过上述实验分析
),溶液颜色变红。甲组同学通过上述实验分析 具有
具有 与KSCN溶液反应的离子方程式为
与KSCN溶液反应的离子方程式为(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL
 溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是
溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是 与
与 可发生反应,生成无色的配合物。为证实该性质,用过量
可发生反应,生成无色的配合物。为证实该性质,用过量 溶液与
溶液与 溶液反应得到
溶液反应得到 ,用于验证
,用于验证 与
与 发生反应,进行a和b两组实验:
发生反应,进行a和b两组实验:
 的制备离子方程式为
的制备离子方程式为(4)丙同学设计实验进一步证明
 可与
可与 反应,进行d和c的对照实验。
反应,进行d和c的对照实验。
①X为
②实验能够证实
 可与
可与 反应,则应观察到的现象是
反应,则应观察到的现象是③实验中若未加适量水稀释,则无法通过现象得出结论。推测加水稀释的目的可能有:使后续实验颜色变化易于观察;降低
 ,
,
您最近一年使用:0次
2 . 某小组探究 Br2、I2能否将Fe2+氧化,实验如下。
(1)实验i中产生 Fe3+的离子方程式是___________ 。
(2)以上实验体现出氧化性关系:Br2___________ I2(填“>”或“<”)。
(3)针对实验中未检测到Fe3+,小组同学分析:I2+2Fe2+ 2Fe3++2I-(反应a),限度小,产生的c(Fe3+)低;若向ii的黄色溶液中加入AgNO3溶液,可产生黄色沉淀,平衡
2Fe3++2I-(反应a),限度小,产生的c(Fe3+)低;若向ii的黄色溶液中加入AgNO3溶液,可产生黄色沉淀,平衡___________ (填“正向”“逆向”或“不移动”)移动,c(Fe3+)增大。
(4)针对小组同学的分析,进行实验i:向的黄色溶液中滴加足量AgNO3溶液。现象及操作如下:
Ⅰ.立即产生黄色沉淀,一段时间后,又有黑色固体从溶液中析出;取出少量黑色固体,洗涤后,加入浓硝酸,黑色固体消失,生成红棕色气体。再向溶液中加入NaCl溶液,出现白色沉淀,证明黑色固体含有Ag。
Ⅱ.静置,取上层溶液,用KSCN溶液检验,变红;用CCl4萃取,无明显现象。
针对上述现象,小组同学提出不同观点并对之进行研究。
①观点1:由产生黄色沉淀不能判断反应a的平衡正向移动,说明理由:___________ 。经证实观点1合理。
②观点2:Fe3+可能由 Ag+氧化产生。
实验iv:向 FeSO4溶液滴加 AgNO3溶液,___________ (填操作、现象),观点2合理。
(5)观点1、2 虽然合理,但加入 AgNO3溶液能否使反应a的平衡移动,还需要进一步确认。
设计实验:取ii的黄色溶液,___________ (填操作、现象)。由此得出结论:不能充分说明(4)中产生 Fe3+的原因是由反应a的平衡移动造成的。
| 实验 | 试剂x | 现象及操作 |
 | 溴水 | i.溶液呈黄色,取出少量滴加KSCN溶液,变红 |
| 碘水 | ii.溶液呈黄色,取出少量滴加KSCN溶液,未变红 |
(2)以上实验体现出氧化性关系:Br2
(3)针对实验中未检测到Fe3+,小组同学分析:I2+2Fe2+
 2Fe3++2I-(反应a),限度小,产生的c(Fe3+)低;若向ii的黄色溶液中加入AgNO3溶液,可产生黄色沉淀,平衡
2Fe3++2I-(反应a),限度小,产生的c(Fe3+)低;若向ii的黄色溶液中加入AgNO3溶液,可产生黄色沉淀,平衡(4)针对小组同学的分析,进行实验i:向的黄色溶液中滴加足量AgNO3溶液。现象及操作如下:
Ⅰ.立即产生黄色沉淀,一段时间后,又有黑色固体从溶液中析出;取出少量黑色固体,洗涤后,加入浓硝酸,黑色固体消失,生成红棕色气体。再向溶液中加入NaCl溶液,出现白色沉淀,证明黑色固体含有Ag。
Ⅱ.静置,取上层溶液,用KSCN溶液检验,变红;用CCl4萃取,无明显现象。
针对上述现象,小组同学提出不同观点并对之进行研究。
①观点1:由产生黄色沉淀不能判断反应a的平衡正向移动,说明理由:
②观点2:Fe3+可能由 Ag+氧化产生。
实验iv:向 FeSO4溶液滴加 AgNO3溶液,
(5)观点1、2 虽然合理,但加入 AgNO3溶液能否使反应a的平衡移动,还需要进一步确认。
设计实验:取ii的黄色溶液,
您最近一年使用:0次
名校
3 . Ⅰ.化学平衡常数是表明化学反应限度的一个特征值。
(1)Fe3+可与H2O、SCN-、F-、等配体形成配位数为6的配离子,如[Fe(H2O)6]3+、[Fe(SCN)6]3-、[FeF6]3-。某同学按如下步骤完成实验:
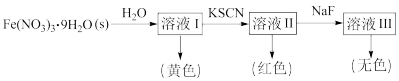
①[Fe(H2O)6]3+为浅紫色,但溶液Ⅰ却呈黄色,其原因是___________ ,为了能观察到溶[Fe(H2O)6]3+的浅紫色,可采取的方法是___________ 。
②已知Fe3+与SCN-、F-的反应在溶液中存在以下平衡:
 ;
;
 ,
,
向溶液Ⅱ中加入NaF后,溶液颜色由红色转变为无色。若该反应是可逆反应,其离子方程式为___________ ,平衡常数为___________ (用K1和K2表示)。
Ⅱ.某实验小组通过实验测定可逆反应:Fe2++Ag+ Ag+Fe3+的平衡常数K。
Ag+Fe3+的平衡常数K。
实验步骤:
①将0.01mol⋅L-1 Ag2SO4溶液与0.04mol⋅L-1 FeSO4溶液(pH=1)等体积混合,得到灰黑色的沉淀和黄色的溶液。
②向实验Ⅰ所得溶液中加入浓硝酸,证实灰黑色固体是Ag。
③取实验Ⅰ中所得上清液V mL。用c1 mol⋅L-1的KSCN溶液滴定,至溶液变为稳定浅红色时,消耗V1mL。
已知:Ag++SCN- AgSCN,K=1012
AgSCN,K=1012
Fe3++SCN- FeSCN2+,K=102.3
FeSCN2+,K=102.3
(2)①溶液中,Fe3+的作用是___________ 。
②反应的平衡常数K=___________ 。
(3)若取实验Ⅰ所得浊液测定Ag+浓度,所得到的K___________ (填“偏大”、“无影响”、“偏小”)。
(1)Fe3+可与H2O、SCN-、F-、等配体形成配位数为6的配离子,如[Fe(H2O)6]3+、[Fe(SCN)6]3-、[FeF6]3-。某同学按如下步骤完成实验:

①[Fe(H2O)6]3+为浅紫色,但溶液Ⅰ却呈黄色,其原因是
②已知Fe3+与SCN-、F-的反应在溶液中存在以下平衡:
 ;
; ,
,向溶液Ⅱ中加入NaF后,溶液颜色由红色转变为无色。若该反应是可逆反应,其离子方程式为
Ⅱ.某实验小组通过实验测定可逆反应:Fe2++Ag+
 Ag+Fe3+的平衡常数K。
Ag+Fe3+的平衡常数K。实验步骤:
①将0.01mol⋅L-1 Ag2SO4溶液与0.04mol⋅L-1 FeSO4溶液(pH=1)等体积混合,得到灰黑色的沉淀和黄色的溶液。
②向实验Ⅰ所得溶液中加入浓硝酸,证实灰黑色固体是Ag。
③取实验Ⅰ中所得上清液V mL。用c1 mol⋅L-1的KSCN溶液滴定,至溶液变为稳定浅红色时,消耗V1mL。
已知:Ag++SCN-
 AgSCN,K=1012
AgSCN,K=1012Fe3++SCN-
 FeSCN2+,K=102.3
FeSCN2+,K=102.3(2)①溶液中,Fe3+的作用是
②反应的平衡常数K=
(3)若取实验Ⅰ所得浊液测定Ag+浓度,所得到的K
您最近一年使用:0次
解题方法
4 . 研究人员从处理废旧线路板后的固体残渣(含SnO2、PbO2等)中进一步回收金属锡(Sn),一种回收流程如下。

已知:i.50Sn、82Pb为ⅣA族元素;
ii.SnO2、PbO2与强碱反应生成盐和水。
iii.+2价Sn不稳定,与空气接触容易氧化为+4价锡
(1)SnO2与稀NaOH反应的离子方程式为_______ 。
(2)滤液1中加入Na2S的目的是除铅,将相关方程式补充完整:____
Na2PbO3+□Na2S+□ =PbS↓+S↓+□
(3)不同溶剂中Na2SnO3的溶解度随温度变化如图。

①相同温度下,Na2SnO3的溶解度随NaOH浓度增大而减小,结合平衡移动原理解释原因:_______ 。
②操作Ⅲ的具体方法为_______ 。
(4)测定粗锡中Sn的纯度:在强酸性环境中将a g粗锡样品溶解(此时Sn全部转化成Sn2+),迅速加入过量NH4Fe(SO4)2溶液,以二苯胺磺酸钠为指示剂,用0.1000mol/L K2Cr2O7标准溶液滴定至终点。消耗K2Cr2O7溶液的体积如图所示,计算Sn的纯度。
已知: Sn2++2Fe3+=Sn4++2Fe2+;Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O

①溶解粗锡时不宜选用浓盐酸,理由是_______ 。
②二苯胺磺酸钠是一种氧化还原指示剂,滴定终点时因发生_______ 反应而变色。(填写“氧化”或“还原”)
③滴定终点时消耗K2Cr2O7标准溶液体积_______ mL,粗锡样品中Sn的纯度为_______ (用质量分数表示)。
④下列操作会导致样品中Sn的测定结果偏高的是_______ (填选项字母)。
a.上述实验中若缓慢加入NH4Fe(SO4)2溶液
b.盛标准K2Cr2O7标准溶液的滴定管尖嘴部分有气泡未排除就开始滴定
c.实验用的酸式滴定管、锥形瓶水洗后均未润洗

已知:i.50Sn、82Pb为ⅣA族元素;
ii.SnO2、PbO2与强碱反应生成盐和水。
iii.+2价Sn不稳定,与空气接触容易氧化为+4价锡
(1)SnO2与稀NaOH反应的离子方程式为
(2)滤液1中加入Na2S的目的是除铅,将相关方程式补充完整:
Na2PbO3+□Na2S+□ =PbS↓+S↓+□
(3)不同溶剂中Na2SnO3的溶解度随温度变化如图。

①相同温度下,Na2SnO3的溶解度随NaOH浓度增大而减小,结合平衡移动原理解释原因:
②操作Ⅲ的具体方法为
(4)测定粗锡中Sn的纯度:在强酸性环境中将a g粗锡样品溶解(此时Sn全部转化成Sn2+),迅速加入过量NH4Fe(SO4)2溶液,以二苯胺磺酸钠为指示剂,用0.1000mol/L K2Cr2O7标准溶液滴定至终点。消耗K2Cr2O7溶液的体积如图所示,计算Sn的纯度。
已知: Sn2++2Fe3+=Sn4++2Fe2+;Cr2O
 +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O
①溶解粗锡时不宜选用浓盐酸,理由是
②二苯胺磺酸钠是一种氧化还原指示剂,滴定终点时因发生
③滴定终点时消耗K2Cr2O7标准溶液体积
④下列操作会导致样品中Sn的测定结果偏高的是
a.上述实验中若缓慢加入NH4Fe(SO4)2溶液
b.盛标准K2Cr2O7标准溶液的滴定管尖嘴部分有气泡未排除就开始滴定
c.实验用的酸式滴定管、锥形瓶水洗后均未润洗
您最近一年使用:0次
5 . 利用甲醇(CH3OH)制备一些高附加值产品,是目前研究的热点。
(1)甲醇和水蒸气经催化重整可制得氢气,反应主要过程如下:
反应Ⅰ CH3OH(g)+H2O(g) 3H2(g)+CO2(g) △H1
3H2(g)+CO2(g) △H1
反应Ⅱ H2(g)+CO2(g) H2O(g)+CO(g) △H2= a kJ·mol-1
H2O(g)+CO(g) △H2= a kJ·mol-1
反应Ⅲ CH3OH(g) 2H2(g)+CO(g) △H3= b kJ·mol-1
2H2(g)+CO(g) △H3= b kJ·mol-1
①△H1=_______ kJ·mol-1 。
②工业上采用CaO吸附增强制氢的方法,可以有效提高反应Ⅰ氢气的产率,如图,请分析加入CaO提高氢气产率的原因:_______ 。

(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。
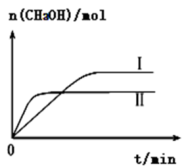
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ_______ KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积为1L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
若甲中平衡后气体的压强为开始的0.8倍,则乙容器起始时反应速率v正____ v逆。(填“>”“<”或“=”)。
③一定温度下,此反应在恒压 容器中进行,能判断该反应达到化学平衡状态的依据是_____ 。
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有3个H-H断裂
(1)甲醇和水蒸气经催化重整可制得氢气,反应主要过程如下:
反应Ⅰ CH3OH(g)+H2O(g)
 3H2(g)+CO2(g) △H1
3H2(g)+CO2(g) △H1反应Ⅱ H2(g)+CO2(g)
 H2O(g)+CO(g) △H2= a kJ·mol-1
H2O(g)+CO(g) △H2= a kJ·mol-1反应Ⅲ CH3OH(g)
 2H2(g)+CO(g) △H3= b kJ·mol-1
2H2(g)+CO(g) △H3= b kJ·mol-1①△H1=
②工业上采用CaO吸附增强制氢的方法,可以有效提高反应Ⅰ氢气的产率,如图,请分析加入CaO提高氢气产率的原因:

(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ
②一定温度下,在容积为1L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | 1molCO2、1mol H2、 1mol CH3OH(g)、1mol H2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,则乙容器起始时反应速率v正
③一定温度下,此反应在
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有3个H-H断裂
您最近一年使用:0次
6 . 某兴趣小组用铬铁矿[Fe(CrO2)2]制备K2Cr2O7晶体,流程如下:
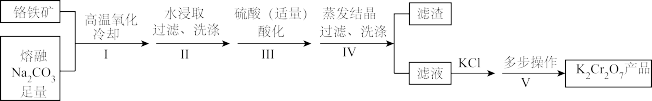
已知:4Fe (CrO2)2 + 10Na2CO3+7O2 8Na2CrO4 +4NaFeO2+10CO2
8Na2CrO4 +4NaFeO2+10CO2
2H++2CrO
 Cr2O
Cr2O +H2O
+H2O
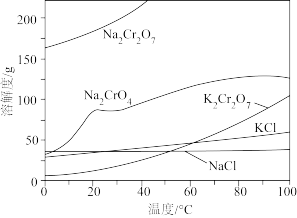
相关物质的溶解度随温度变化如下图。
请回答:
(1)步骤I,将铬铁矿粉碎有利于加快高温氧化的速率,其理由是______ 。
(2)下列说法正确的是______ 。
A.步骤II,低温可提高浸取率
B.步骤II,过滤可除去NaFeO2水解产生的Fe(OH)3
C.步骤III,酸化的目的主要是使Na2CrO4转变为Na2Cr2O7
D.步骤IV,所得滤渣的主要成分是Na2SO4和Na2CO3
(3)步骤V,重结晶前,为了得到杂质较少的K2Cr2O7粗产品,从下列选项中选出合理的操作(操作不能重复使用)并排序:溶解KCl →______ →______ →______ →______ →重结晶。
a.50℃蒸发溶剂;
b.100℃ 蒸发溶剂;
c.抽滤;
d.冷却至室温;
e.蒸发至溶液出现晶膜,停止加热;
f.蒸发至溶液中出现大量晶体,停止加热。
(4)为了测定K2Cr2O7产品的纯度,可采用氧化还原滴定法。
①下列关于滴定分析的操作,不正确的是______ 。
A.用量筒量取25.00mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
②在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,______ 继续摇动锥形瓶,观察颜色变化。(请在横线上补全操作)
(5)该小组用滴定法准确测得产品中K2Cr2O7的质量分数为98.50%。某同学还用分光光度法测定产品纯度(K2Cr2O7溶液的吸光度与其浓度成正比例),但测得的质量分数明显偏低。分析其原因,发现配制K2Cr2O7待测水溶液时少加了一种试剂。该试剂是______ ,添加该试剂的理由是______ 。
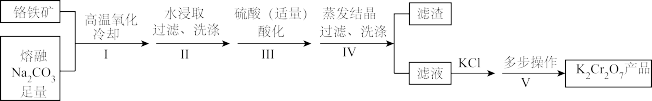
已知:4Fe (CrO2)2 + 10Na2CO3+7O2
 8Na2CrO4 +4NaFeO2+10CO2
8Na2CrO4 +4NaFeO2+10CO22H++2CrO

 Cr2O
Cr2O +H2O
+H2O相关物质的溶解度随温度变化如下图。

请回答:
(1)步骤I,将铬铁矿粉碎有利于加快高温氧化的速率,其理由是
(2)下列说法正确的是
A.步骤II,低温可提高浸取率
B.步骤II,过滤可除去NaFeO2水解产生的Fe(OH)3
C.步骤III,酸化的目的主要是使Na2CrO4转变为Na2Cr2O7
D.步骤IV,所得滤渣的主要成分是Na2SO4和Na2CO3
(3)步骤V,重结晶前,为了得到杂质较少的K2Cr2O7粗产品,从下列选项中选出合理的操作(操作不能重复使用)并排序:溶解KCl →
a.50℃蒸发溶剂;
b.100℃ 蒸发溶剂;
c.抽滤;
d.冷却至室温;
e.蒸发至溶液出现晶膜,停止加热;
f.蒸发至溶液中出现大量晶体,停止加热。
(4)为了测定K2Cr2O7产品的纯度,可采用氧化还原滴定法。
①下列关于滴定分析的操作,不正确的是
A.用量筒量取25.00mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
②在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,
(5)该小组用滴定法准确测得产品中K2Cr2O7的质量分数为98.50%。某同学还用分光光度法测定产品纯度(K2Cr2O7溶液的吸光度与其浓度成正比例),但测得的质量分数明显偏低。分析其原因,发现配制K2Cr2O7待测水溶液时少加了一种试剂。该试剂是
您最近一年使用:0次
2021-01-09更新
|
8539次组卷
|
16卷引用:天津市天津一中2020-2021学年高三第二学期五月月考化学试题
天津市天津一中2020-2021学年高三第二学期五月月考化学试题天津市咸水沽第一中学2023届高三上学期第一次模拟考试化学试题2021年1月新高考浙江化学高考真题(已下线)大题02 化学工艺流程题(二)-【考前抓大题】备战2021年高考化学(全国通用)(已下线)解密12 实验化学(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点31 化学实验与工艺流程-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考向09 工艺流程初探-备战2022年高考化学一轮复习考点微专题(已下线)专题21.化学工艺流程分析-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)2021年1月浙江高考化学试题变式题26-31(已下线)解密13 实验化学(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)微专题27 化学工艺流程题-----物质的分离与提纯-备战2023年高考化学一轮复习考点微专题浙江省金华市曙光学校2021-2022学年高三下学期5月模拟考试化学试题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
7 . 天然气净化过程中产生有毒的 ,直接排放会污染空气,通过下列方法可以进行处理。
,直接排放会污染空气,通过下列方法可以进行处理。
(1)工业上用克劳斯工艺处理含 的尾气获得硫黄,流程如图:
的尾气获得硫黄,流程如图:
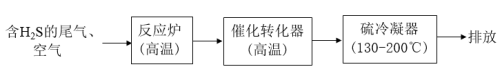
反应炉中的反应: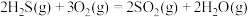 △H=-1035.6kJ∙mol-1
△H=-1035.6kJ∙mol-1
催化转化器中的反应: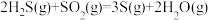 △H=-92.8kJ∙mol-1
△H=-92.8kJ∙mol-1
克劳斯工艺中获得气态硫黄的总反应的热化学方程式:______ 。
(2)T∙F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示,下列说法正确的是______ 。
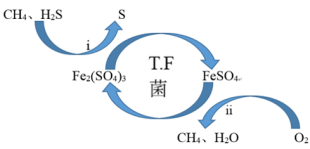
A.脱硫过程需要不断添加Fe2(SO4)3溶液
B.i过程可导致环境pH减小
C.该脱硫过程的总反应为:2H2S+O2=2S↓+2H2O
D.该过程可以在高温下进行
(3) 分解反应
分解反应 △H>0。在无催化剂及
△H>0。在无催化剂及 催化下,
催化下, 在反应器中不同温度时反应,间隔相同时间测定一次
在反应器中不同温度时反应,间隔相同时间测定一次 的转化率,其转化率与温度的关系如图所示:
的转化率,其转化率与温度的关系如图所示:
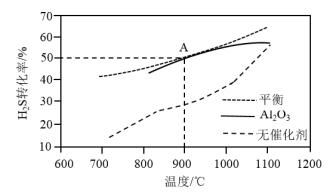
①在约1100℃时,有无 催化,其转化率几乎相等,是因为
催化,其转化率几乎相等,是因为______ 。
②在压强p、温度T, 催化条件下,将
催化条件下,将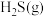 、
、 按照物质的量比为1∶n混合,发生热分解反应
按照物质的量比为1∶n混合,发生热分解反应 ,
, 平衡产率为α。掺入
平衡产率为α。掺入 能提高
能提高 的平衡产率,解释说明该事实
的平衡产率,解释说明该事实______ ,平衡常数Kp=______ (以分压表示,分压=总压×物质的量分数)
(4)当废气中硫化氢浓度较低时常用纯碱溶液进行吸收,已知 、
、 的电离平衡常数如下表所示:
的电离平衡常数如下表所示:
纯碱溶液吸收少量  的离子方程式为
的离子方程式为______ 。
 ,直接排放会污染空气,通过下列方法可以进行处理。
,直接排放会污染空气,通过下列方法可以进行处理。(1)工业上用克劳斯工艺处理含
 的尾气获得硫黄,流程如图:
的尾气获得硫黄,流程如图:
反应炉中的反应:
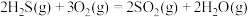 △H=-1035.6kJ∙mol-1
△H=-1035.6kJ∙mol-1催化转化器中的反应:
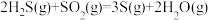 △H=-92.8kJ∙mol-1
△H=-92.8kJ∙mol-1克劳斯工艺中获得气态硫黄的总反应的热化学方程式:
(2)T∙F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示,下列说法正确的是

A.脱硫过程需要不断添加Fe2(SO4)3溶液
B.i过程可导致环境pH减小
C.该脱硫过程的总反应为:2H2S+O2=2S↓+2H2O
D.该过程可以在高温下进行
(3)
 分解反应
分解反应 △H>0。在无催化剂及
△H>0。在无催化剂及 催化下,
催化下, 在反应器中不同温度时反应,间隔相同时间测定一次
在反应器中不同温度时反应,间隔相同时间测定一次 的转化率,其转化率与温度的关系如图所示:
的转化率,其转化率与温度的关系如图所示:
①在约1100℃时,有无
 催化,其转化率几乎相等,是因为
催化,其转化率几乎相等,是因为②在压强p、温度T,
 催化条件下,将
催化条件下,将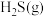 、
、 按照物质的量比为1∶n混合,发生热分解反应
按照物质的量比为1∶n混合,发生热分解反应 ,
, 平衡产率为α。掺入
平衡产率为α。掺入 能提高
能提高 的平衡产率,解释说明该事实
的平衡产率,解释说明该事实(4)当废气中硫化氢浓度较低时常用纯碱溶液进行吸收,已知
 、
、 的电离平衡常数如下表所示:
的电离平衡常数如下表所示:| 电离平衡常数 |  |  |
 |  | 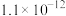 |
 | 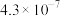 | 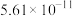 |
 的离子方程式为
的离子方程式为
您最近一年使用:0次
2021-01-03更新
|
1246次组卷
|
9卷引用:2022年天津市普通高中学业水平等级性考试化学试题变式题(原理综合题)
(已下线)2022年天津市普通高中学业水平等级性考试化学试题变式题(原理综合题)八省八校(T8联考)2020-2021学年高三上学期第一次联考化学试题(华中师大一附中)(已下线)大题06 化学反应原理综合题(一)-【考前抓大题】备战2021年高考化学(全国通用)(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)2022年浙江省6月高考真题变式题26-31(已下线)03 化学反应原理综合题型集训之Kp计算(解析)-备战2023年高考化学大题逐空突破系列(全国通用)福建省福州第三中学2023届高三下学期第一次质量检测化学试题辽宁省沈阳市五校协作体2023-2024学年高三上学期期中考试化学试题
解题方法
8 . t℃时,将3mol A和2mol B气体通入体积为2L的密闭容器中(容积不变),发生反应:3A(g)+ xB(g) ⇌C(g),4min时反应达到平衡状态(温度不变),剩余0.4mol B,并测得C的浓度为0.4mol/L。请填写下列空白:
(1)x_________ 。
(2)用A表示该反应的速率为_________ mol/(L·min)。
(3)若继续向平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是_________ (填写选项字母符号)
A.化学平衡向正反应方向移动
B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动
D.正、逆反应的化学反应速率将发生同等程度的改变
(4)现有反应:mA(g)+nB(g)⇌ pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质分数减小,则:
①该反应的逆反应为_________ 反应(填“吸热”或“放热“),且m+n_________ p(填“>” “=”或“<”)。
②减压使容器体积增大时,A的质量分数_________ 。(填“增大少”“减小”或“不变”,下同)
③若加入B(维持体积不变),则A的转化率_________ 。
④若升高温度,则平衡时B、C的浓度之比将_________ 。
⑤若加入催化剂,平衡时气体混合物的总物质的量_________ 。
(1)x
(2)用A表示该反应的速率为
(3)若继续向平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是
A.化学平衡向正反应方向移动
B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动
D.正、逆反应的化学反应速率将发生同等程度的改变
(4)现有反应:mA(g)+nB(g)⇌ pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质分数减小,则:
①该反应的逆反应为
②减压使容器体积增大时,A的质量分数
③若加入B(维持体积不变),则A的转化率
④若升高温度,则平衡时B、C的浓度之比将
⑤若加入催化剂,平衡时气体混合物的总物质的量
您最近一年使用:0次
真题
名校
9 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
(1)“滤渣1”含有S和__________________________ ;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________ 。
(2)“氧化”中添加适量的MnO2的作用是将________________________ 。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______ ~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________ 。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________ 。
(6)写出“沉锰”的离子方程式___________________________________________________ 。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y= 时,z=
时,z=___________ 。
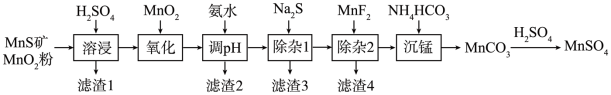
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和
(2)“氧化”中添加适量的MnO2的作用是将
(3)“调pH”除铁和铝,溶液的pH范围应调节为
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(6)写出“沉锰”的离子方程式
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=
 时,z=
时,z=
您最近一年使用:0次
2019-06-09更新
|
19620次组卷
|
29卷引用:天津市第二十五中学2021-2022学年高三上学期第一次月考化学试题
天津市第二十五中学2021-2022学年高三上学期第一次月考化学试题2019年全国统一高考化学试题(新课标Ⅲ)河北省张家口市第四中学2018-2019学年高二下学期6月月考理科综合化学试题 河北省辛集中学2020届高三上学期入学考试化学试题安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题甘肃省高台县第一中学2020届高三上学期期中考试化学试题山东省滕州市第一中学2020届高三3月线上模拟考试化学试题(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训河北省承德市围场卉原中学2020届高三模拟自测联考试卷理综化学试卷2020届四川省成都市第七中学高三三月份网络教学质量监测卷化学试题(已下线)专题6.1 无机化工流程题(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升四川省宜宾市叙州区第一中学校2020届高三下学期第四学月考试理综化学试题黑龙江省大庆市第四中学2020届高三下学期4月月考理综化学试题四川省宜宾市叙州区第二中学校2020届高三第一次高考适应性考试理综化学试题河南省信阳市罗山县2021届高三第一次调研(8月联考)化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三章素养检测(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)江西省宜春市第九中学2021-2022学年高三上学期10月月考化学试题(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)四川省泸州市泸县第五中学2022届高三高考适应性考试理综化学试题(已下线)专题18 工艺流程题(已下线)T26-工业流程题黑龙江省七台河市勃利县高级中学2022-2023学年高三上学期11月期中考试化学试题陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题河南省济源市高级中学2023-2024学年高三上学期高考模拟检测(10月)理科综合试题-高中化学
解题方法
10 . 完成下列问题。
(1)重铬酸钾(K2Cr2O7为橙色,K2CrO4为黄色)溶液存在着如下平衡:Cr2O +H2O⇌2CrO
+H2O⇌2CrO +2H+。
+2H+。
①若平衡体系的pH=2,则溶液显___________ 色。
②能说明该反应达平衡状态的是___________ 。
a.溶液呈酸性 b.溶液的颜色不变
c.2v(Cr2O )=v(CrO
)=v(CrO ) d.Cr2O
) d.Cr2O 和CrO
和CrO 的浓度相同
的浓度相同
(2)25℃时,2NO2(g)⇌N2O4(g)△H=-56.9kJ/mol。
①该反应的化学平衡常数表达式___________________ 。
②其它条件不变,缩小容器体积,达到新平衡,此过程的现象:
_________________________ 。
③其它条件不变,将该体系升温至100oC,此过程的现象:
________________________________ 。
(3)明矾[KAl(SO4)2·12H2O]是一种常用的净水剂。
①用离子方程式表示净水的原因:_________________________ 。
②明矾溶液中滴加Ba(OH)2溶液至SO 刚好沉淀完全时,溶液的pH
刚好沉淀完全时,溶液的pH______ 7(填“>”“=”或“<”,下同)。
③明矾溶液中滴加Ba(OH)2溶液至Al3+刚好沉淀完全时,溶液的pH______ 7。
④明矾溶液中离子浓度由大到小的顺序:______________________________ 。
(1)重铬酸钾(K2Cr2O7为橙色,K2CrO4为黄色)溶液存在着如下平衡:Cr2O
 +H2O⇌2CrO
+H2O⇌2CrO +2H+。
+2H+。①若平衡体系的pH=2,则溶液显
②能说明该反应达平衡状态的是
a.溶液呈酸性 b.溶液的颜色不变
c.2v(Cr2O
 )=v(CrO
)=v(CrO ) d.Cr2O
) d.Cr2O 和CrO
和CrO 的浓度相同
的浓度相同(2)25℃时,2NO2(g)⇌N2O4(g)△H=-56.9kJ/mol。
①该反应的化学平衡常数表达式
②其它条件不变,缩小容器体积,达到新平衡,此过程的现象:
③其它条件不变,将该体系升温至100oC,此过程的现象:
(3)明矾[KAl(SO4)2·12H2O]是一种常用的净水剂。
①用离子方程式表示净水的原因:
②明矾溶液中滴加Ba(OH)2溶液至SO
 刚好沉淀完全时,溶液的pH
刚好沉淀完全时,溶液的pH③明矾溶液中滴加Ba(OH)2溶液至Al3+刚好沉淀完全时,溶液的pH
④明矾溶液中离子浓度由大到小的顺序:
您最近一年使用:0次



