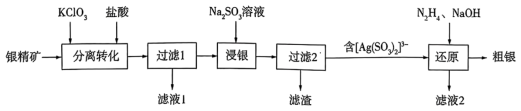
1 . 以银精矿(主要成分为Ag2S、FeS2、ZnS)为原料采用“预氧化湿法提银”工艺流程如下: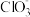 有较强的氧化性,被还原为Cl-。
有较强的氧化性,被还原为Cl-。
(1)“分离转化”时,为提高 的转化率可采取的措施是
的转化率可采取的措施是___________ ; 转化为AgCl和S的化学方程式为
转化为AgCl和S的化学方程式为___________ 。
(2)已知: ,
,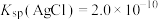 ,若不加KClO3,直接加氯化物,依据反应
,若不加KClO3,直接加氯化物,依据反应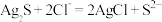 ,能否实现此反应较完全转化?并说明理由:
,能否实现此反应较完全转化?并说明理由:___________ 。
(3)滤液1中的金属阳离子有___________ 。在整个工艺中可循环利用的物质是___________ 。
(4)“浸银”时,发生反应的离子方程式为___________ 。
(5)“分离转化”时,除上述方法外也可以使用过量FeCl3、HCl和 的混合液作为浸出剂,将Ag2S中的银以
的混合液作为浸出剂,将Ag2S中的银以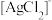 形式浸出,建立化学平衡状态。请解释浸出剂中
形式浸出,建立化学平衡状态。请解释浸出剂中 、H⁺的作用
、H⁺的作用___________ 。
(6)还原过程中所用的N2H4,分子可能有两种不同的构象——顺式和反式,沿N—N键轴方向的投影如下图所示,其中(a)为反式,(b)为顺式。测得 分子极性很大,说明它具有
分子极性很大,说明它具有___________ 构象(填“反式”或“顺式”)。
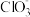 有较强的氧化性,被还原为Cl-。
有较强的氧化性,被还原为Cl-。(1)“分离转化”时,为提高
 的转化率可采取的措施是
的转化率可采取的措施是 转化为AgCl和S的化学方程式为
转化为AgCl和S的化学方程式为(2)已知:
 ,
,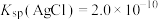 ,若不加KClO3,直接加氯化物,依据反应
,若不加KClO3,直接加氯化物,依据反应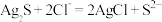 ,能否实现此反应较完全转化?并说明理由:
,能否实现此反应较完全转化?并说明理由:(3)滤液1中的金属阳离子有
(4)“浸银”时,发生反应的离子方程式为
(5)“分离转化”时,除上述方法外也可以使用过量FeCl3、HCl和
 的混合液作为浸出剂,将Ag2S中的银以
的混合液作为浸出剂,将Ag2S中的银以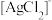 形式浸出,建立化学平衡状态。请解释浸出剂中
形式浸出,建立化学平衡状态。请解释浸出剂中 、H⁺的作用
、H⁺的作用(6)还原过程中所用的N2H4,分子可能有两种不同的构象——顺式和反式,沿N—N键轴方向的投影如下图所示,其中(a)为反式,(b)为顺式。测得
 分子极性很大,说明它具有
分子极性很大,说明它具有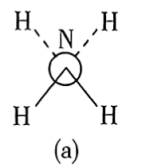
您最近一年使用:0次
2024-05-13更新
|
123次组卷
|
2卷引用:2024届东北三省四市教研联合体高三下学期高考模拟(二)化学试卷
2023·浙江·模拟预测
解题方法
2 . 将二氧化碳转化为高附加值化学品是目前研究的热点之一,甲醇是重要的化工原料和优良的替代燃料,因此加氢制甲醇被广泛关注。在催化剂作用下主要发生以下反应。
Ⅰ.

Ⅱ.
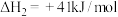
Ⅲ.

(1)反应Ⅲ自发进行的条件是______ 。
(2)恒温恒容条件下,原料气 、
、 以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为
以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为 。已知初始压强为
。已知初始压强为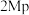 ,
, ,
, 平衡转化率为
平衡转化率为 ,则该条件下反应Ⅱ
,则该条件下反应Ⅱ
______ 。(对于气相反应,用组分B的平衡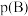 代替
代替 ,记作
,记作 。
。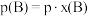 ,p为平衡压强,
,p为平衡压强,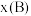 为平衡系统中
为平衡系统中 的物质的量分数。)
的物质的量分数。)
在 ,
,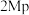 ,
, 、
、 以物质的量浓度1:3投料,以一定流速通过不同
以物质的量浓度1:3投料,以一定流速通过不同 与
与 催化剂,图a和b为催化反应
催化剂,图a和b为催化反应 转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、
转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、 和
和 。
。
(3)分析在该压强下的最适合反应条件为______ 。
(4)推测在一定温度范围内,随着反应温度的升高, 转化率增大,但甲醇选择性降低的原因是
转化率增大,但甲醇选择性降低的原因是______ 。
(5)催化加氢的反应机理如下图所示。

下列说法正确的是_______
(6)在 催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线
催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线__________ 。
Ⅰ.


Ⅱ.

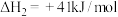
Ⅲ.


(1)反应Ⅲ自发进行的条件是
(2)恒温恒容条件下,原料气
 、
、 以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为
以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为 。已知初始压强为
。已知初始压强为 ,
, ,
, 平衡转化率为
平衡转化率为 ,则该条件下反应Ⅱ
,则该条件下反应Ⅱ
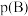 代替
代替 ,记作
,记作 。
。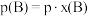 ,p为平衡压强,
,p为平衡压强,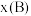 为平衡系统中
为平衡系统中 的物质的量分数。)
的物质的量分数。) 在
 ,
,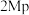 ,
, 、
、 以物质的量浓度1:3投料,以一定流速通过不同
以物质的量浓度1:3投料,以一定流速通过不同 与
与 催化剂,图a和b为催化反应
催化剂,图a和b为催化反应 转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、
转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、 和
和 。
。
(3)分析在该压强下的最适合反应条件为
(4)推测在一定温度范围内,随着反应温度的升高,
 转化率增大,但甲醇选择性降低的原因是
转化率增大,但甲醇选择性降低的原因是(5)催化加氢的反应机理如下图所示。

下列说法正确的是_______
A. 催化剂中 催化剂中 抑制了 抑制了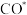 的解吸附,从而抑制 的解吸附,从而抑制 的生成。 的生成。 |
B. 催化剂上主要通过甲酸盐路径加氢生成甲醇。 催化剂上主要通过甲酸盐路径加氢生成甲醇。 |
| C.增大流速,原料气与催化剂碰撞机会多,甲醇产率一定增加。 |
D.随着温度升高,有利于 在催化剂表面反应,平衡转化率增大。 在催化剂表面反应,平衡转化率增大。 |
(6)在
 催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线
催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线
您最近一年使用:0次
名校
解题方法
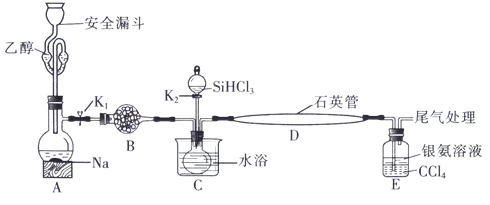
3 . 高纯硅被誉为“信息革命的催化剂”。某小组模拟工业上用 与
与 在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
已知:① 的沸点为33.0℃,密度为
的沸点为33.0℃,密度为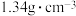 ;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
② ;
;
③银氨溶液中存在: 。
。
回答下列问题:
(1)装置B中试剂宜选择___________ (填字母,单选)。
a.碱石灰 b.无水氯化钙 C.五氧化二磷 d.硅胶
(2)实验操作步骤有:
①加热装置D至1357K;
②关闭K1;
③加热装置C,打开K2,滴加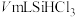 ;
;
④关闭K2;
⑤打开K1,向安全漏斗中加入足量乙醇,装置A中反应一段时间。
正确的操作顺序为___________ (填序号)。
(3)E中CCl4的作用是防倒吸和___________ 。“防倒吸”原理是___________ 。用化学平衡原理解释银氨溶液中有白色沉淀生成:___________ 。
(4)石英管中发生反应的化学方程式为___________ 。
(5)本实验制得高纯硅ag,则SiHCl3的利用率为___________ (只列计算式)。实验结束后,有同学认为根据高纯硅与消耗钠或乙醇的量也可以计算SiHCl3的利用率,这种观点___________ (填“是”或“否”)正确。
 与
与 在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
已知:①
 的沸点为33.0℃,密度为
的沸点为33.0℃,密度为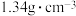 ;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;②
 ;
;③银氨溶液中存在:
 。
。回答下列问题:
(1)装置B中试剂宜选择
a.碱石灰 b.无水氯化钙 C.五氧化二磷 d.硅胶
(2)实验操作步骤有:
①加热装置D至1357K;
②关闭K1;
③加热装置C,打开K2,滴加
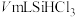 ;
;④关闭K2;
⑤打开K1,向安全漏斗中加入足量乙醇,装置A中反应一段时间。
正确的操作顺序为
(3)E中CCl4的作用是防倒吸和
(4)石英管中发生反应的化学方程式为
(5)本实验制得高纯硅ag,则SiHCl3的利用率为
您最近一年使用:0次
2021-07-04更新
|
522次组卷
|
2卷引用:吉林省长春外国语学校2022届高三上学期期初考试化学试题
4 . (1)K2Cr2O7的水溶液中存在如下平衡:Cr2O72-(aq)+ H2O(l) 2CrO42-(aq)+ 2H+(aq),平衡常数表达式
2CrO42-(aq)+ 2H+(aq),平衡常数表达式__________ 已知:在水溶液中K2Cr2O7为橙红色,K2CrO4为黄色)往上述溶液中加入氢氧化钠溶液呈___ 色;向已加入氢氧化钠的溶液中,再加入过量硫酸溶液呈___________ 色;此实验现象,符合勒夏特列原理:如果改变维持化学平衡的条件(浓度、压力和温度),平衡就会向着_________ 这种改变的方向移动,
(2)在KMnO4与H2C2O4反应中,可通过测定_________________ 来测定该反应的速率;写出酸性条件下KMnO4与H2C2O4(弱酸)反应,产生二氧化碳气体、水和Mn2+的离子反应方程式:__________________ ;此反应开始反应缓慢,随后反应迅速加快,其原因是______ (填字母)
A. KMnO4溶液中的H+起催化作用
B. 生成的CO2逸出,使生成物浓度降低
C.反应中,生成的Mn2+起催化作用
D. 在酸性条件下KMnO4的氧化性增强
(3)为探讨化学反应速率的影响因素,设计的实验方案如下表。(已知 I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)
①该实验进行的目的是_____________ 淀粉溶液的作用是____________ 。
②表中Vx=_______ mL,比较t1、t2、t3大小____________ ,试推测该实验结论: ____________
 2CrO42-(aq)+ 2H+(aq),平衡常数表达式
2CrO42-(aq)+ 2H+(aq),平衡常数表达式(2)在KMnO4与H2C2O4反应中,可通过测定
A. KMnO4溶液中的H+起催化作用
B. 生成的CO2逸出,使生成物浓度降低
C.反应中,生成的Mn2+起催化作用
D. 在酸性条件下KMnO4的氧化性增强
(3)为探讨化学反应速率的影响因素,设计的实验方案如下表。(已知 I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)
| 实验 序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
②表中Vx=
您最近一年使用:0次



