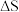1 . 硝酸盐型熔盐(含 )在太阳能光热发电领域被广泛应用.高纯
)在太阳能光热发电领域被广泛应用.高纯 的制备、性质与应用是目前研究的热点,部分生产方法及性质研究如下:
的制备、性质与应用是目前研究的热点,部分生产方法及性质研究如下: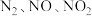 .
.
请回答:
(1)写出溶液A中的所有离子_________ ;方法Ⅱ中,“氧化吸收液”的目的是__________ .
(2)下列说法正确的是_________.
(3)方法Ⅰ中,用 代替
代替 ,得到副产品
,得到副产品 .工业上用
.工业上用 溶液浸取菱镁矿的煅烧粉(含
溶液浸取菱镁矿的煅烧粉(含 ),不断加热蒸出氨气,以获得较高浓度的
),不断加热蒸出氨气,以获得较高浓度的 溶液,其原理是
溶液,其原理是_________ .
(4)在某温度下, 分解得到的
分解得到的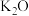 可用于制备新型高效多功能水处理剂
可用于制备新型高效多功能水处理剂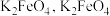 水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性.请依据上述信息,设计实验检验无色无味气体成分和沉淀中的金属元素
水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性.请依据上述信息,设计实验检验无色无味气体成分和沉淀中的金属元素_________ .写出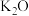 与
与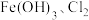 共热制取
共热制取 的化学方程式:
的化学方程式:_________ .
 )在太阳能光热发电领域被广泛应用.高纯
)在太阳能光热发电领域被广泛应用.高纯 的制备、性质与应用是目前研究的热点,部分生产方法及性质研究如下:
的制备、性质与应用是目前研究的热点,部分生产方法及性质研究如下: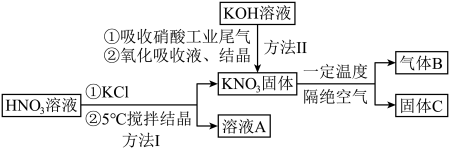
 .
.请回答:
(1)写出溶液A中的所有离子
(2)下列说法正确的是_________.
A.方法Ⅰ说明:该条件下,酸性 |
B.方法Ⅱ中,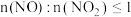 ,氮氧化物才能被足量的 ,氮氧化物才能被足量的 溶液充分吸收 溶液充分吸收 |
C. 固体与浓硫酸共热,可产生红棕色气体 固体与浓硫酸共热,可产生红棕色气体 |
| D.若气体B是一种单质,则所得固体C中不能含有三种元素 |
(3)方法Ⅰ中,用
 代替
代替 ,得到副产品
,得到副产品 .工业上用
.工业上用 溶液浸取菱镁矿的煅烧粉(含
溶液浸取菱镁矿的煅烧粉(含 ),不断加热蒸出氨气,以获得较高浓度的
),不断加热蒸出氨气,以获得较高浓度的 溶液,其原理是
溶液,其原理是(4)在某温度下,
 分解得到的
分解得到的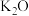 可用于制备新型高效多功能水处理剂
可用于制备新型高效多功能水处理剂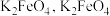 水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性.请依据上述信息,设计实验检验无色无味气体成分和沉淀中的金属元素
水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性.请依据上述信息,设计实验检验无色无味气体成分和沉淀中的金属元素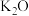 与
与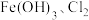 共热制取
共热制取 的化学方程式:
的化学方程式:
您最近一年使用:0次
2024-04-01更新
|
557次组卷
|
5卷引用:2024届浙江省温州市高三下学期第二次适应性考试(二模)化学试题
2024届浙江省温州市高三下学期第二次适应性考试(二模)化学试题浙江省温州市普通高中2024届高三下学期第二次适应性考试(二模)化学试题(已下线)化学(浙江卷01)-2024年高考押题预测卷(已下线)压轴题11 无机化工流程综合分析(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)(已下线)压轴题11?无机化工流程综合分析(6大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
解题方法
2 . 将二氧化碳转化为高附加值化学品是目前研究的热点之一,甲醇是重要的化工原料和优良的替代燃料,因此加氢制甲醇被广泛关注。在催化剂作用下主要发生以下反应。
Ⅰ.

Ⅱ.
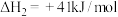
Ⅲ.

(1)反应Ⅲ自发进行的条件是______ 。
(2)恒温恒容条件下,原料气 、
、 以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为
以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为 。已知初始压强为
。已知初始压强为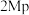 ,
, ,
, 平衡转化率为
平衡转化率为 ,则该条件下反应Ⅱ
,则该条件下反应Ⅱ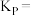
______ 。(对于气相反应,用组分B的平衡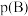 代替
代替 ,记作
,记作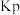 。
。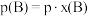 ,p为平衡压强,
,p为平衡压强,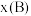 为平衡系统中
为平衡系统中 的物质的量分数。)
的物质的量分数。)
在 ,
,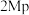 ,
, 、
、 以物质的量浓度1:3投料,以一定流速通过不同
以物质的量浓度1:3投料,以一定流速通过不同 与
与 催化剂,图a和b为催化反应
催化剂,图a和b为催化反应 转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、
转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、 和
和 。
。
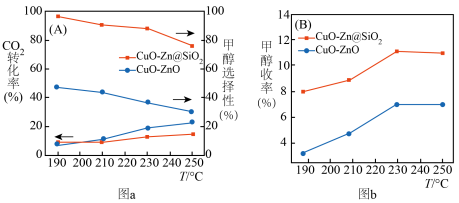
(3)分析在该压强下的最适合反应条件为______ 。
(4)推测在一定温度范围内,随着反应温度的升高, 转化率增大,但甲醇选择性降低的原因是
转化率增大,但甲醇选择性降低的原因是______ 。
(5)催化加氢的反应机理如下图所示。

下列说法正确的是_______
(6)在 催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线
催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线__________ 。
Ⅰ.


Ⅱ.

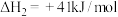
Ⅲ.


(1)反应Ⅲ自发进行的条件是
(2)恒温恒容条件下,原料气
 、
、 以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为
以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为 。已知初始压强为
。已知初始压强为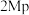 ,
, ,
, 平衡转化率为
平衡转化率为 ,则该条件下反应Ⅱ
,则该条件下反应Ⅱ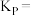
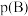 代替
代替 ,记作
,记作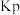 。
。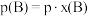 ,p为平衡压强,
,p为平衡压强,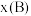 为平衡系统中
为平衡系统中 的物质的量分数。)
的物质的量分数。) 在
 ,
,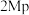 ,
, 、
、 以物质的量浓度1:3投料,以一定流速通过不同
以物质的量浓度1:3投料,以一定流速通过不同 与
与 催化剂,图a和b为催化反应
催化剂,图a和b为催化反应 转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、
转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、 和
和 。
。
(3)分析在该压强下的最适合反应条件为
(4)推测在一定温度范围内,随着反应温度的升高,
 转化率增大,但甲醇选择性降低的原因是
转化率增大,但甲醇选择性降低的原因是(5)催化加氢的反应机理如下图所示。

下列说法正确的是_______
A. 催化剂中 催化剂中 抑制了 抑制了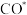 的解吸附,从而抑制 的解吸附,从而抑制 的生成。 的生成。 |
B. 催化剂上主要通过甲酸盐路径加氢生成甲醇。 催化剂上主要通过甲酸盐路径加氢生成甲醇。 |
| C.增大流速,原料气与催化剂碰撞机会多,甲醇产率一定增加。 |
D.随着温度升高,有利于 在催化剂表面反应,平衡转化率增大。 在催化剂表面反应,平衡转化率增大。 |
(6)在
 催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线
催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线
您最近一年使用:0次
名校
3 . 现在生活对水质要求越来越高,水质检测指标项目也进行了相应的增加,水质检测方法也得到了发展。
Ⅰ.水质化学需氧量(COD)是指在一定条件下,采用一定的强氧化剂处理水样时,所消耗的氧化剂量。常用强氧化剂重铬酸钾工业上由铬铁矿(主要成分为 、
、 等)制备,制备流程如图所示:
等)制备,制备流程如图所示:

已知步骤①的主要反应为:

(1)下列说法不正确 的是__________。
(2)步骤④调 有利于
有利于 生成,请结合离子方程式用平衡移动原理解释
生成,请结合离子方程式用平衡移动原理解释____________________ 。
Ⅱ.水的硬度最初是指钙、镁离子沉淀肥皂的能力,水的总硬度指水中钙、镁离子的总浓度。测定水的总硬度一般采用配位滴定法,即在 的氨缓冲溶液中,以铬黑
的氨缓冲溶液中,以铬黑 作为指示剂,用EDTA(乙二胺四乙酸二钠,
作为指示剂,用EDTA(乙二胺四乙酸二钠, )标准溶液直接滴定水中的
)标准溶液直接滴定水中的 、
、 ,测定中涉及的反应有:
,测定中涉及的反应有:
① (蓝色)
(蓝色) (酒红色)
(酒红色)
② (金属离子
(金属离子 、
、 )
) (无色)
(无色)
③
(3)下列说法正确的是__________ 。
A.配合物 的稳定性大于
的稳定性大于
B.在滴定过程中眼睛要随时观察滴定管中液面的变化
C.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
D.实验时盛EDTA标准液的滴定管用蒸馏水洗涤后未用标准液润洗,测定结果将偏小
E.滴定前尖嘴内有气泡,滴定后无气泡,测定结果将偏大
(4)滴定终点的判断_________________________ 。
(5)取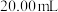 水样,用
水样,用 标准溶液滴定至终点,消耗EDTA溶液
标准溶液滴定至终点,消耗EDTA溶液 。则水的总硬度为
。则水的总硬度为_________  。
。
Ⅰ.水质化学需氧量(COD)是指在一定条件下,采用一定的强氧化剂处理水样时,所消耗的氧化剂量。常用强氧化剂重铬酸钾工业上由铬铁矿(主要成分为
 、
、 等)制备,制备流程如图所示:
等)制备,制备流程如图所示:
已知步骤①的主要反应为:

(1)下列说法
A.步骤①反应中 和 和 为氧化产物 为氧化产物 |
| B.步骤①熔融、氧化可以在石英坩埚中进行 |
C.滤渣2中含有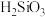 和 和 |
D.步骤⑤利用了相同温度下 溶解度小的原理 溶解度小的原理 |
 有利于
有利于 生成,请结合离子方程式用平衡移动原理解释
生成,请结合离子方程式用平衡移动原理解释Ⅱ.水的硬度最初是指钙、镁离子沉淀肥皂的能力,水的总硬度指水中钙、镁离子的总浓度。测定水的总硬度一般采用配位滴定法,即在
 的氨缓冲溶液中,以铬黑
的氨缓冲溶液中,以铬黑 作为指示剂,用EDTA(乙二胺四乙酸二钠,
作为指示剂,用EDTA(乙二胺四乙酸二钠, )标准溶液直接滴定水中的
)标准溶液直接滴定水中的 、
、 ,测定中涉及的反应有:
,测定中涉及的反应有:①
 (蓝色)
(蓝色) (酒红色)
(酒红色)②
 (金属离子
(金属离子 、
、 )
) (无色)
(无色)③

(3)下列说法正确的是
A.配合物
 的稳定性大于
的稳定性大于
B.在滴定过程中眼睛要随时观察滴定管中液面的变化
C.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
D.实验时盛EDTA标准液的滴定管用蒸馏水洗涤后未用标准液润洗,测定结果将偏小
E.滴定前尖嘴内有气泡,滴定后无气泡,测定结果将偏大
(4)滴定终点的判断
(5)取
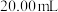 水样,用
水样,用 标准溶液滴定至终点,消耗EDTA溶液
标准溶液滴定至终点,消耗EDTA溶液 。则水的总硬度为
。则水的总硬度为 。
。
您最近一年使用:0次
解题方法
4 . 甲烷水蒸气重整反应是工业制备氢气的重要方式,在催化剂(如镍)表面发生的主要反应有:
①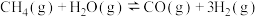
 kJ⋅mol-1
kJ⋅mol-1
②

副反应: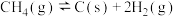 ,
,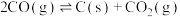 ,
,
Ⅰ.已知: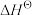 为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其
为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其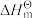 为零。
为零。
例如C(石墨)
 kJ·mol-1,则
kJ·mol-1,则 的标准生成焓为-393.5 kJ⋅mol-1。
的标准生成焓为-393.5 kJ⋅mol-1。
(1)
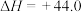 kJ⋅mol-1,结合表中数据计算反应
kJ⋅mol-1,结合表中数据计算反应
___________ 。
(2)在镍催化剂表面甲烷和水蒸气发生反应,最后生成CO、 和
和 ,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。
,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。
a. ;
;
b.___________ ;
c. ;
;
d.___________ ;
e.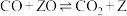
Ⅱ.在一体积可变的密闭容器中,投入一定量的 和
和 发生甲烷水蒸气重整反应。
发生甲烷水蒸气重整反应。
(3)下列有关说法正确的是___________。
(4)维持压强100 kPa,平衡时 、
、 、CO、
、CO、 的体积分数分别为a、b、c、d,反应①的平衡常数
的体积分数分别为a、b、c、d,反应①的平衡常数
___________ 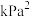 (用含字母的式子表示。
(用含字母的式子表示。 是以分压表示的平衡常数,分压=总压×体积分数)。
是以分压表示的平衡常数,分压=总压×体积分数)。
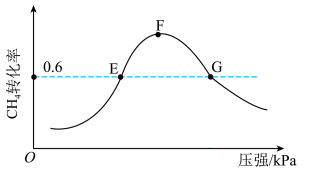
(5)500℃时,反应相同时间后测得 的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)
的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)___________ c(G)(填“>”“<”或“=”)。
(6)通过甲烷水蒸气重整反应的平衡含量计算,以及析碳条件的判断,该转化需适当增大水碳比[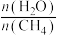 ],请分析可能的原因:
],请分析可能的原因:___________ 。
①
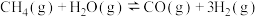
 kJ⋅mol-1
kJ⋅mol-1②


副反应:
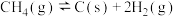 ,
,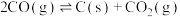 ,
,
Ⅰ.已知:
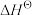 为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其
为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1 mol该物质的焓变。对于稳定相态单质,其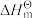 为零。
为零。例如C(石墨)

 kJ·mol-1,则
kJ·mol-1,则 的标准生成焓为-393.5 kJ⋅mol-1。
的标准生成焓为-393.5 kJ⋅mol-1。| 物质 | 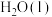 |  | CO |
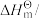 /kJ⋅mol-1 /kJ⋅mol-1 | -285.8 | -393.5 | -110.5 |

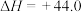 kJ⋅mol-1,结合表中数据计算反应
kJ⋅mol-1,结合表中数据计算反应
(2)在镍催化剂表面甲烷和水蒸气发生反应,最后生成CO、
 和
和 ,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。
,反应机理如下,请补充其中的两个反应方程式(Z表示催化剂的活性中心)。a.
 ;
; b.
c.
 ;
;d.
e.
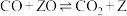
Ⅱ.在一体积可变的密闭容器中,投入一定量的
 和
和 发生甲烷水蒸气重整反应。
发生甲烷水蒸气重整反应。(3)下列有关说法正确的是___________。
A. 浓度不变,说明体系已达平衡状态 浓度不变,说明体系已达平衡状态 |
| B.反应②前后气体物质的量不变,所以此反应熵变为0 |
C.在催化剂表面, 、 、 分子中的化学键被削弱 分子中的化学键被削弱 |
D.在体系中通入适量的 ,有利于减少积碳,从而有利于反应进行 ,有利于减少积碳,从而有利于反应进行 |
 、
、 、CO、
、CO、 的体积分数分别为a、b、c、d,反应①的平衡常数
的体积分数分别为a、b、c、d,反应①的平衡常数
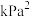 (用含字母的式子表示。
(用含字母的式子表示。 是以分压表示的平衡常数,分压=总压×体积分数)。
是以分压表示的平衡常数,分压=总压×体积分数)。(5)500℃时,反应相同时间后测得
 的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)
的转化率随压强的变化如图所示。则图中E点和G点CH4的浓度大小关系为c(E)
(6)通过甲烷水蒸气重整反应的平衡含量计算,以及析碳条件的判断,该转化需适当增大水碳比[
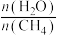 ],请分析可能的原因:
],请分析可能的原因:
您最近一年使用:0次
解题方法
5 . 化合物X由四种元素组成,按如下流程进行实验。混合气体A由气体E和元素种类相同的另两种气体组成,且气体C的平均相对分子质量为8.5。混合物B中有两种固体。
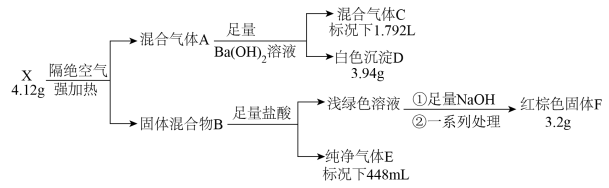
请回答:
(1)组成X的四种元素为_______ ;X的化学式为_______ 。
(2)写出由X到A的化学方程式_______ 。
(3)用盐酸溶解固体F,滴加一定量KSCN溶液,得到血红色溶液Y。往溶液Y中加入一定量KCl固体,溶液Y颜色变淡,请结合离子方程式说明原因_______ 。
(4)设计实验检验混合气体A中相对分子量较小的两种气体_______ 。

请回答:
(1)组成X的四种元素为
(2)写出由X到A的化学方程式
(3)用盐酸溶解固体F,滴加一定量KSCN溶液,得到血红色溶液Y。往溶液Y中加入一定量KCl固体,溶液Y颜色变淡,请结合离子方程式说明原因
(4)设计实验检验混合气体A中相对分子量较小的两种气体
您最近一年使用:0次
名校
解题方法
6 . Pd/Al2O3是常见的汽车尾气催化剂。一种废Pd/Al2O3纳米催化剂主要成分及含量:Pd 0.3%,Al2O3 92.8%,SiO2 5.0%,Co、Pt和炭共约1.0%。采用如下工艺从中提取金属Co和Pd。

请回答下列问题:
(1)方法2比方法1后续回收流程相对简单,但工业上不常用方法2,从绿色化学角度分析原因是_______ 。
(2)“酸浸②”时,Pt和Pd分别转化为PtCl 和PdCl
和PdCl ,请写出Pd转化为PdCl
,请写出Pd转化为PdCl 的离子方程式为
的离子方程式为_______ 。
(3)为了精准投料,需要测定“络合”过程加入的氨水溶液的浓度。待测液用碱式滴定管量取,选出正确操作完成“量取”操作:蒸馏水洗涤→加入待装液3~5mL→_______→_______→_______→_______→ d。_______

a.加液至“0”刻度以上2~3cm
b.倾斜转动滴定管,使液体润湿滴定管内壁,挤压玻璃球,放液
c.调整至“0”或“0”刻度以下,静止1min,读数
d.将滴定管尖端插入锥形瓶内约1cm,放一定体积液,读数
e.右手拿住滴定管使它倾斜30°,左手迅速打开活塞
f.橡皮管向上弯曲,挤压玻璃球a处,放液
g.橡皮管向上弯曲,挤压玻璃球b处,放液
h.橡皮管向上弯曲,挤压玻璃球c处,放液
(4)“络合”过程后得到Pd(NH3)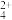 和Pt(NH3)
和Pt(NH3)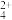 ,“沉淀”时,搅拌滴加盐酸调节pH将[Pd(NH3)4]Cl2转化为[Pd(NH3)2]Cl2沉淀,结合平衡移动原理解释实现该转化的原因
,“沉淀”时,搅拌滴加盐酸调节pH将[Pd(NH3)4]Cl2转化为[Pd(NH3)2]Cl2沉淀,结合平衡移动原理解释实现该转化的原因_______ 。
(5)已知:常温下,Ksp[Co(OH)2]=10−15,Ksp[Al(OH)3]=10−32。若滤液①中c(Co2+) = 0.01 mol·L−1,则分离出Al(OH)3沉淀需调节pH的范围是_______ (当离子浓度小于1.0×10−5 mol·L−1时认为已沉淀完全),调节pH可以选择的最佳物质是_______ (填序号)
A.Al2O3 B.NaOH C.CoO D.NaHCO3

请回答下列问题:
(1)方法2比方法1后续回收流程相对简单,但工业上不常用方法2,从绿色化学角度分析原因是
(2)“酸浸②”时,Pt和Pd分别转化为PtCl
 和PdCl
和PdCl ,请写出Pd转化为PdCl
,请写出Pd转化为PdCl 的离子方程式为
的离子方程式为(3)为了精准投料,需要测定“络合”过程加入的氨水溶液的浓度。待测液用碱式滴定管量取,选出正确操作完成“量取”操作:蒸馏水洗涤→加入待装液3~5mL→_______→_______→_______→_______→ d。

a.加液至“0”刻度以上2~3cm
b.倾斜转动滴定管,使液体润湿滴定管内壁,挤压玻璃球,放液
c.调整至“0”或“0”刻度以下,静止1min,读数
d.将滴定管尖端插入锥形瓶内约1cm,放一定体积液,读数
e.右手拿住滴定管使它倾斜30°,左手迅速打开活塞
f.橡皮管向上弯曲,挤压玻璃球a处,放液
g.橡皮管向上弯曲,挤压玻璃球b处,放液
h.橡皮管向上弯曲,挤压玻璃球c处,放液
(4)“络合”过程后得到Pd(NH3)
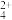 和Pt(NH3)
和Pt(NH3)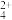 ,“沉淀”时,搅拌滴加盐酸调节pH将[Pd(NH3)4]Cl2转化为[Pd(NH3)2]Cl2沉淀,结合平衡移动原理解释实现该转化的原因
,“沉淀”时,搅拌滴加盐酸调节pH将[Pd(NH3)4]Cl2转化为[Pd(NH3)2]Cl2沉淀,结合平衡移动原理解释实现该转化的原因(5)已知:常温下,Ksp[Co(OH)2]=10−15,Ksp[Al(OH)3]=10−32。若滤液①中c(Co2+) = 0.01 mol·L−1,则分离出Al(OH)3沉淀需调节pH的范围是
A.Al2O3 B.NaOH C.CoO D.NaHCO3
您最近一年使用:0次
7 . 某物质A由三种常见的元素组成,某兴趣小组进行了如下实验:
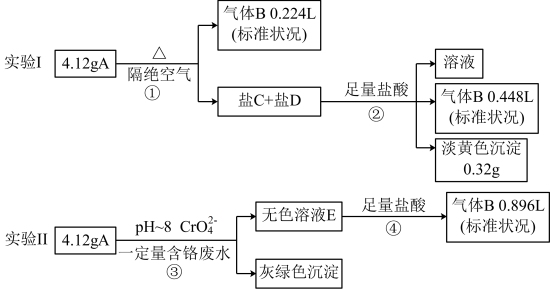
已知:A的摩尔质量在200~300g/mol之间,焰色为紫色;盐C和盐D的组成元素和A相同,①②④处气体体积均在充分加热挥发后经干燥测定。
(1)组成A的元素有_______ ;A的化学式_______ ;
(2)无色溶液E中所有阴离子结合H+的能力由强到弱的顺序_______ ;
(3)一种生产A的方法:在35~45℃下气体B与锌粉—水悬浮液反应生成中间产物;然后加入相应的碱溶液,充分反应,压滤分离得A溶液。写出该过程的总反应方程式_______ ;
(4)A可除去废水(pH~8)中的Cr(VI),且处理后pH变化不大,则反应③的离子方程式_______ ;
(5)设计实验确定溶液E中所含溶质的阴离子_______ ;

已知:A的摩尔质量在200~300g/mol之间,焰色为紫色;盐C和盐D的组成元素和A相同,①②④处气体体积均在充分加热挥发后经干燥测定。
(1)组成A的元素有
(2)无色溶液E中所有阴离子结合H+的能力由强到弱的顺序
(3)一种生产A的方法:在35~45℃下气体B与锌粉—水悬浮液反应生成中间产物;然后加入相应的碱溶液,充分反应,压滤分离得A溶液。写出该过程的总反应方程式
(4)A可除去废水(pH~8)中的Cr(VI),且处理后pH变化不大,则反应③的离子方程式
(5)设计实验确定溶液E中所含溶质的阴离子
您最近一年使用:0次
2021高三·浙江·专题练习
解题方法
8 . 对于已达平衡的可逆反应,当其他条件不变时,改变反应物或生成物的浓度会对化学平衡有何影响?
[猜想与假设]
假设1:化学反应处于平衡状态时,其他条件不变,增加反应物浓度,使平衡向正反应方向移动。
假设2:化学反应处于平衡状态时,其他条件不变,增加反应物浓度,使平衡向逆反应方向移动。
假设3:化学反应处于平衡状态时,其他条件不变,增加生成物浓度,使平衡向逆反应方向移动。
假设4:化学反应处于平衡状态时,其他条件不变,增加生成物浓度,使平衡向正反应方向移动。
[设计和实施方案]
在已反应平衡的FeCl3和KSCN的混合液中,分别加入:①FeCl3溶液②KSCN溶液③KCl固体④NaF溶液
实验用品:
仪器:烧杯、玻璃棒、胶头滴管
试剂:FeCl3(aq)(0.01mol·L-11.0mol·L-1),KSCN(aq)(0.01mol·L-11.0mol·L-1),KCl(s),NaF(aq)(1.0mol·L-1)。
实验步骤:
Ⅰ.往250mL烧杯中加入100mL蒸馏水,然后加入10mL0.01mol·L-1FeCl3溶液,再加入10mL0.01mol·L-1KSCN溶液,溶液由黄色变成橙红色。
Ⅱ.取5支试管,编号分别为1,2,3,4,5,然后各取步骤(1)中FeCl3和KSCN的混合溶液4mL加到5支试管中。往1号试管滴加2~3滴1.0mol·L-1FeCl3溶液,振荡,观察现象;往2号试管滴加2~3滴1.0mol·L-1KSCN溶液,振荡,观察现象;往3号试管中加入少量KCl固体,振荡,观察现象;往4号试管中滴加2~3滴1.0mol·L-1NaF溶液,振荡,观察现象。
根据你所学的内容完成下列表格,并回答有关问题。
(1)FeCl3与KSCN溶液反应
(2)由①②现象说明假设___ 成立,假设___ 不成立。
(3)根据Fe3++3SCN- Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象却是变浅了,请你分析变浅的可能原因是
Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象却是变浅了,请你分析变浅的可能原因是__ 。
(4)根据“4”号试管中的现象,分析在4号试管中发生的变化是___ ,说明了___ (从改变浓度影响平衡移动角度回答)。
[猜想与假设]
假设1:化学反应处于平衡状态时,其他条件不变,增加反应物浓度,使平衡向正反应方向移动。
假设2:化学反应处于平衡状态时,其他条件不变,增加反应物浓度,使平衡向逆反应方向移动。
假设3:化学反应处于平衡状态时,其他条件不变,增加生成物浓度,使平衡向逆反应方向移动。
假设4:化学反应处于平衡状态时,其他条件不变,增加生成物浓度,使平衡向正反应方向移动。
[设计和实施方案]
在已反应平衡的FeCl3和KSCN的混合液中,分别加入:①FeCl3溶液②KSCN溶液③KCl固体④NaF溶液
实验用品:
仪器:烧杯、玻璃棒、胶头滴管
试剂:FeCl3(aq)(0.01mol·L-11.0mol·L-1),KSCN(aq)(0.01mol·L-11.0mol·L-1),KCl(s),NaF(aq)(1.0mol·L-1)。
实验步骤:
Ⅰ.往250mL烧杯中加入100mL蒸馏水,然后加入10mL0.01mol·L-1FeCl3溶液,再加入10mL0.01mol·L-1KSCN溶液,溶液由黄色变成橙红色。
Ⅱ.取5支试管,编号分别为1,2,3,4,5,然后各取步骤(1)中FeCl3和KSCN的混合溶液4mL加到5支试管中。往1号试管滴加2~3滴1.0mol·L-1FeCl3溶液,振荡,观察现象;往2号试管滴加2~3滴1.0mol·L-1KSCN溶液,振荡,观察现象;往3号试管中加入少量KCl固体,振荡,观察现象;往4号试管中滴加2~3滴1.0mol·L-1NaF溶液,振荡,观察现象。
根据你所学的内容完成下列表格,并回答有关问题。
(1)FeCl3与KSCN溶液反应
| 编号 | 混合溶液颜色 | 滴加的溶液 | 溶液颜色的变化 | 平衡移动的方向 |
| 1 | 橙红色 | FeCl3 | ①颜色 | ③向 |
| 2 | 橙红色 | KSCN | ②颜色 | ④向 |
| 3 | 橙红色 | KCl | 颜色变浅了,由橙红色变成了黄色 | ⑤向 |
| 4 | 橙红色 | NaF | 颜色变浅了,由橙红色变成了无色 | ⑥向 |
| 5 | 橙红色 | - | 橙红色 | 不移动 |
(3)根据Fe3++3SCN-
 Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象却是变浅了,请你分析变浅的可能原因是
Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象却是变浅了,请你分析变浅的可能原因是(4)根据“4”号试管中的现象,分析在4号试管中发生的变化是
您最近一年使用:0次
9 . NO的处理与减排是烟气污染物控制的重点和难点,相关研究引起了国内外的广泛关注。
(1)理论上可采用加热使NO分解的方法处理: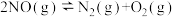 ,反应的部分数据如下表:
,反应的部分数据如下表:
通过计算得出高于7089℃时反应无法自发进行,试判断b____ 0(填“<”、“>”或“=”);反应的平衡常数表达式为____ ;实际反应时发现加热至600℃时NO仍没有明显分解,试解释原因___ 。
(2)科学家发现活性炭表面的有机结构可以被强氧化剂氧化成酚羟基、羧基(均可表示为C—OH,其电离平衡可表示为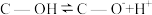 ),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):
),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):
预氧化: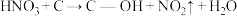
预氧化:
预氧化:
吸附: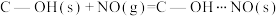
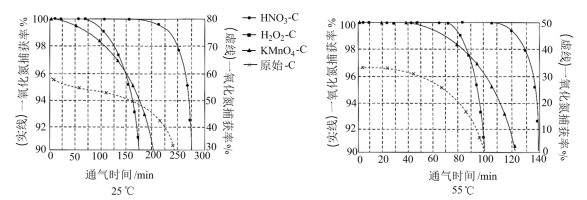
NO吸附实验分别在25℃和55℃下进行,将一定比例的 与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图:
与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图:
已知:NO捕获率=
请回答:
①下列描述正确的是_______
A.25℃下原始-C在通气约175分钟后吸附效果超过了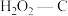
B.若其他条件不变,增大混合气体中 物质的量分数,吸附平衡会逆向移动
物质的量分数,吸附平衡会逆向移动
C.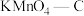 在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞
在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞
D.由图象可知升温有利于吸附平衡正向移动,故吸附过程的
②其他条件不变,55℃下增大烟气中水蒸气含量后,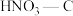 的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线
的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线____________ 。
③相比其他预氧化试剂处理的活性炭,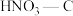 吸附效果更佳,有研究者认为可能是
吸附效果更佳,有研究者认为可能是 引入了
引入了 ,增强了活性炭的表面活性。试利用勒夏特列原理予以解释
,增强了活性炭的表面活性。试利用勒夏特列原理予以解释_______ 。
(1)理论上可采用加热使NO分解的方法处理:
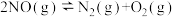 ,反应的部分数据如下表:
,反应的部分数据如下表:项目 |
|
| 正反应活化能 | 逆反应活化能 |
数据/ | a | b | 728 | 910 |
通过计算得出高于7089℃时反应无法自发进行,试判断b
(2)科学家发现活性炭表面的有机结构可以被强氧化剂氧化成酚羟基、羧基(均可表示为C—OH,其电离平衡可表示为
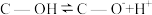 ),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):
),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):预氧化:
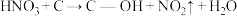
预氧化:

预氧化:

吸附:
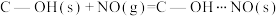
NO吸附实验分别在25℃和55℃下进行,将一定比例的
 与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图:
与NO混合气体在10 MPa恒压下,以相同速率持续通入到等量的、不同预氧化试剂处理的活性炭中(图象中“原始-C”表示未经处理的活性炭),获得两个温度下“NO捕获率-通气时间”的变化图:
已知:NO捕获率=

请回答:
①下列描述正确的是
A.25℃下原始-C在通气约175分钟后吸附效果超过了
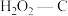
B.若其他条件不变,增大混合气体中
 物质的量分数,吸附平衡会逆向移动
物质的量分数,吸附平衡会逆向移动C.
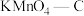 在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞
在实验中吸附效果不佳,可能是活性炭表面孔隙被堵塞D.由图象可知升温有利于吸附平衡正向移动,故吸附过程的

②其他条件不变,55℃下增大烟气中水蒸气含量后,
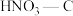 的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线
的NO捕获率会迅速降低,通气1小时后为40%,70 min后吸附到达平衡。请在对应图象中用虚线画出通气1小时后至吸附平衡为止NO捕获率的变化曲线③相比其他预氧化试剂处理的活性炭,
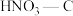 吸附效果更佳,有研究者认为可能是
吸附效果更佳,有研究者认为可能是 引入了
引入了 ,增强了活性炭的表面活性。试利用勒夏特列原理予以解释
,增强了活性炭的表面活性。试利用勒夏特列原理予以解释
您最近一年使用:0次
10 . 天然气净化过程中产生有毒的 ,直接排放会污染空气,通过下列方法可以进行处理。
,直接排放会污染空气,通过下列方法可以进行处理。
(1)工业上用克劳斯工艺处理含 的尾气获得硫黄,流程如图:
的尾气获得硫黄,流程如图:
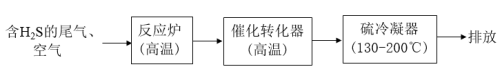
反应炉中的反应: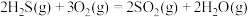 △H=-1035.6kJ∙mol-1
△H=-1035.6kJ∙mol-1
催化转化器中的反应: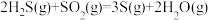 △H=-92.8kJ∙mol-1
△H=-92.8kJ∙mol-1
克劳斯工艺中获得气态硫黄的总反应的热化学方程式:______ 。
(2)T∙F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示,下列说法正确的是______ 。
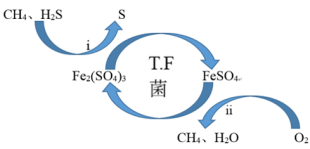
A.脱硫过程需要不断添加Fe2(SO4)3溶液
B.i过程可导致环境pH减小
C.该脱硫过程的总反应为:2H2S+O2=2S↓+2H2O
D.该过程可以在高温下进行
(3) 分解反应
分解反应 △H>0。在无催化剂及
△H>0。在无催化剂及 催化下,
催化下, 在反应器中不同温度时反应,间隔相同时间测定一次
在反应器中不同温度时反应,间隔相同时间测定一次 的转化率,其转化率与温度的关系如图所示:
的转化率,其转化率与温度的关系如图所示:
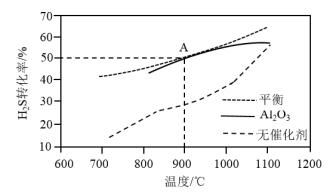
①在约1100℃时,有无 催化,其转化率几乎相等,是因为
催化,其转化率几乎相等,是因为______ 。
②在压强p、温度T, 催化条件下,将
催化条件下,将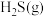 、
、 按照物质的量比为1∶n混合,发生热分解反应
按照物质的量比为1∶n混合,发生热分解反应 ,
, 平衡产率为α。掺入
平衡产率为α。掺入 能提高
能提高 的平衡产率,解释说明该事实
的平衡产率,解释说明该事实______ ,平衡常数Kp=______ (以分压表示,分压=总压×物质的量分数)
(4)当废气中硫化氢浓度较低时常用纯碱溶液进行吸收,已知 、
、 的电离平衡常数如下表所示:
的电离平衡常数如下表所示:
纯碱溶液吸收少量  的离子方程式为
的离子方程式为______ 。
 ,直接排放会污染空气,通过下列方法可以进行处理。
,直接排放会污染空气,通过下列方法可以进行处理。(1)工业上用克劳斯工艺处理含
 的尾气获得硫黄,流程如图:
的尾气获得硫黄,流程如图:
反应炉中的反应:
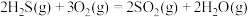 △H=-1035.6kJ∙mol-1
△H=-1035.6kJ∙mol-1催化转化器中的反应:
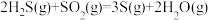 △H=-92.8kJ∙mol-1
△H=-92.8kJ∙mol-1克劳斯工艺中获得气态硫黄的总反应的热化学方程式:
(2)T∙F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示,下列说法正确的是

A.脱硫过程需要不断添加Fe2(SO4)3溶液
B.i过程可导致环境pH减小
C.该脱硫过程的总反应为:2H2S+O2=2S↓+2H2O
D.该过程可以在高温下进行
(3)
 分解反应
分解反应 △H>0。在无催化剂及
△H>0。在无催化剂及 催化下,
催化下, 在反应器中不同温度时反应,间隔相同时间测定一次
在反应器中不同温度时反应,间隔相同时间测定一次 的转化率,其转化率与温度的关系如图所示:
的转化率,其转化率与温度的关系如图所示:
①在约1100℃时,有无
 催化,其转化率几乎相等,是因为
催化,其转化率几乎相等,是因为②在压强p、温度T,
 催化条件下,将
催化条件下,将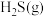 、
、 按照物质的量比为1∶n混合,发生热分解反应
按照物质的量比为1∶n混合,发生热分解反应 ,
, 平衡产率为α。掺入
平衡产率为α。掺入 能提高
能提高 的平衡产率,解释说明该事实
的平衡产率,解释说明该事实(4)当废气中硫化氢浓度较低时常用纯碱溶液进行吸收,已知
 、
、 的电离平衡常数如下表所示:
的电离平衡常数如下表所示:| 电离平衡常数 | 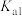 | 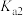 |
 |  | 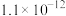 |
 | 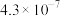 | 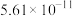 |
 的离子方程式为
的离子方程式为
您最近一年使用:0次
2021-01-03更新
|
1246次组卷
|
9卷引用:解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)
(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)2022年浙江省6月高考真题变式题26-31八省八校(T8联考)2020-2021学年高三上学期第一次联考化学试题(华中师大一附中)(已下线)大题06 化学反应原理综合题(一)-【考前抓大题】备战2021年高考化学(全国通用)(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)2022年天津市普通高中学业水平等级性考试化学试题变式题(原理综合题)(已下线)03 化学反应原理综合题型集训之Kp计算(解析)-备战2023年高考化学大题逐空突破系列(全国通用)福建省福州第三中学2023届高三下学期第一次质量检测化学试题辽宁省沈阳市五校协作体2023-2024学年高三上学期期中考试化学试题