1 . 某兴趣小组以重铬酸钾( )溶液为研究对象,改变条件使其发生“色彩变幻”。
)溶液为研究对象,改变条件使其发生“色彩变幻”。
已知:① 溶液存在平衡:
溶液存在平衡: 。
。
②含铬元素的离子在溶液中的颜色: (橙色);
(橙色); (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。 的正反应是
的正反应是_____ (填“吸热”或“放热”)反应。
(2)ⅱ是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是_____ (填化学式)。
(3)ⅲ的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验不能达到预期目的,理由是______ 。
(4)根据实验Ⅱ中不同现象,可以得出的结论是______ 。
(5)继续实验Ⅲ:______ 。
②第二步溶液变绿色:该反应的离子方程式是_______ 。
 )溶液为研究对象,改变条件使其发生“色彩变幻”。
)溶液为研究对象,改变条件使其发生“色彩变幻”。已知:①
 溶液存在平衡:
溶液存在平衡: 。
。②含铬元素的离子在溶液中的颜色:
 (橙色);
(橙色); (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。
 的正反应是
的正反应是(2)ⅱ是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是
(3)ⅲ的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验不能达到预期目的,理由是
(4)根据实验Ⅱ中不同现象,可以得出的结论是
(5)继续实验Ⅲ:
实验Ⅲ: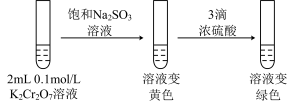
②第二步溶液变绿色:该反应的离子方程式是
您最近一年使用:0次
2 . 利用含钴废料(主要成分为 、
、 、
、 、
、 以及
以及 、
、 等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示:
等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示: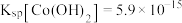 ;
;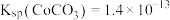 。
。
请回答下列问题:
(1)“碱浸”时所得滤液中溶质的主要成分为 和
和___________ 。“酸浸”时 发生反应的总离子方程式为
发生反应的总离子方程式为___________ 。
(2)“萃取”时 萃取的反应原理如下:
萃取的反应原理如下: (有机层)
(有机层)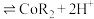 ,若萃取剂的量一定时,
,若萃取剂的量一定时,___________ (填“一次萃取”或“少量多次萃取”)的萃取效率更高。若“酸浸”后浸出液的 ,
, ,萃取完成后水相中
,萃取完成后水相中 为
为 ,则钴的萃取率为
,则钴的萃取率为___________ (结果保留一位小数,溶液体积变化忽略不计)。
(3)“沉锰”时, 转化为
转化为 ,则“沉锰”时发生反应的离子方程式为
,则“沉锰”时发生反应的离子方程式为___________ 。
(4)可以通过电解 溶液获得单质
溶液获得单质 和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是
和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是___________ 。若Ⅱ室溶液中溶质的质量增加了 ,则理论上获得的单质
,则理论上获得的单质 的质量为
的质量为___________ 。
 、
、 、
、 、
、 以及
以及 、
、 等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示:
等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示: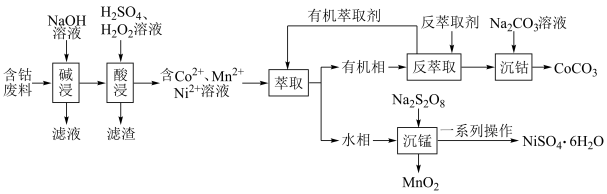
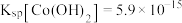 ;
;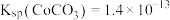 。
。请回答下列问题:
(1)“碱浸”时所得滤液中溶质的主要成分为
 和
和 发生反应的总离子方程式为
发生反应的总离子方程式为(2)“萃取”时
 萃取的反应原理如下:
萃取的反应原理如下: (有机层)
(有机层)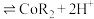 ,若萃取剂的量一定时,
,若萃取剂的量一定时, ,
, ,萃取完成后水相中
,萃取完成后水相中 为
为 ,则钴的萃取率为
,则钴的萃取率为(3)“沉锰”时,
 转化为
转化为 ,则“沉锰”时发生反应的离子方程式为
,则“沉锰”时发生反应的离子方程式为(4)可以通过电解
 溶液获得单质
溶液获得单质 和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是
和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是 ,则理论上获得的单质
,则理论上获得的单质 的质量为
的质量为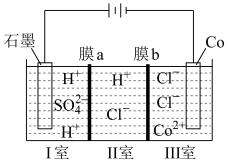
您最近一年使用:0次
名校
解题方法
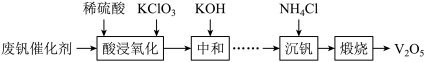
3 . 五氧化二钒(V2O5)广泛用作合金添加剂及有机化工催化剂。从废钒催化剂(含有V2O5、VOSO4及少量Fe2O3、Al2O3等杂质)回收V2O5的部分工艺流程如下:
已知:a.常温下,部分含钒物质在水中的溶解性见下表:
b.+5价钒在溶液中的主要存在形式与溶液pH的关系见下表:
(1)“酸浸、氧化”时,VO2+发生反应的离子方程式为___________ 。
(2)“中和”时调节pH为7的目的,一是沉淀部分杂质离子;二是___________ 。
(3)①“沉钒”前需将溶液先进行“离子交换”和“洗脱”,再加入NH4Cl生成NH4VO3;“离子交换”和“洗脱”两步操作可表示为ROH+VO
 RVO3+OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
RVO3+OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈___________ (填“酸性”或“碱性”),理由是___________ 。
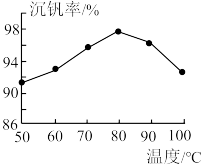
②用沉钒率(NH4VO3沉淀中V的质量和废钒催化剂中V的质量之比)表示该工艺钒的回收率。图1中是沉钒率随温度变化的关系曲线,沉钒时,温度超过80℃以后,沉钒率下降的可能原因是___________ 。
(4)在Ar气氛中加热“煅烧”NH4VO3,测得加热升温过程中固体的质量变化如图2所示,加热分解NH4VO3制备V2O5需要控制的温度为___________ 。


已知:a.常温下,部分含钒物质在水中的溶解性见下表:
| 物质 | V2O5 | VOSO4 | (VO2)2SO4 | NH4VO3 |
| 溶解性 | 难溶 | 可溶 | 易溶 | 难溶 |
| pH | <6 | 6~8 | 8~10 | 10~12 |
| 主要离子 | VO | VO | V2O | VO |
(1)“酸浸、氧化”时,VO2+发生反应的离子方程式为
(2)“中和”时调节pH为7的目的,一是沉淀部分杂质离子;二是
(3)①“沉钒”前需将溶液先进行“离子交换”和“洗脱”,再加入NH4Cl生成NH4VO3;“离子交换”和“洗脱”两步操作可表示为ROH+VO

 RVO3+OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
RVO3+OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈②用沉钒率(NH4VO3沉淀中V的质量和废钒催化剂中V的质量之比)表示该工艺钒的回收率。图1中是沉钒率随温度变化的关系曲线,沉钒时,温度超过80℃以后,沉钒率下降的可能原因是

(4)在Ar气氛中加热“煅烧”NH4VO3,测得加热升温过程中固体的质量变化如图2所示,加热分解NH4VO3制备V2O5需要控制的温度为

您最近一年使用:0次
名校
解题方法
4 . 实验小组探究酸对Fe3++3SCN- Fe(SCN)3平衡的影响。将0.005mol∙L−1FeCl3溶液(接近无色)和0.01mol∙L−1KSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。
Fe(SCN)3平衡的影响。将0.005mol∙L−1FeCl3溶液(接近无色)和0.01mol∙L−1KSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。
(1)FeCl3水解显酸性的原因是_____ (用离子方程式表示)。
(2)甲同学认为加入酸后,会使Fe3++3SCN- Fe(SCN)3体系中
Fe(SCN)3体系中_____ 浓度改变,导致该平衡正向移动,溶液颜色加深。
【设计并实施实验】
【查阅资料】
Fe3+和Cl-、SO 均能发生络合反应:
均能发生络合反应:
Fe3++4Cl- [FeCl4]-(黄色);Fe3++2SO
[FeCl4]-(黄色);Fe3++2SO
 [Fe(SO4)2]-(无色)。
[Fe(SO4)2]-(无色)。
实验Ⅰ、探究现象a中溶液颜色变化的原因
(3)实验①的目的是_____ 。
(4)根据实验①和实验②的结果,从平衡移动角度解释现象a:_____ 。
实验Ⅱ、探究现象b中溶液呈浅黄色的原因
(5)结合实验③可推测现象b中使溶液呈浅黄色的微粒可能有两种,分别是_____ 。
(6)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒只是(5)中的一种,请将实验④的操作及现象补充完整:_____ ,_____ 。
 Fe(SCN)3平衡的影响。将0.005mol∙L−1FeCl3溶液(接近无色)和0.01mol∙L−1KSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。
Fe(SCN)3平衡的影响。将0.005mol∙L−1FeCl3溶液(接近无色)和0.01mol∙L−1KSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。(1)FeCl3水解显酸性的原因是
(2)甲同学认为加入酸后,会使Fe3++3SCN-
 Fe(SCN)3体系中
Fe(SCN)3体系中【设计并实施实验】
 |  |
Fe3+和Cl-、SO
 均能发生络合反应:
均能发生络合反应:Fe3++4Cl-
 [FeCl4]-(黄色);Fe3++2SO
[FeCl4]-(黄色);Fe3++2SO
 [Fe(SO4)2]-(无色)。
[Fe(SO4)2]-(无色)。实验Ⅰ、探究现象a中溶液颜色变化的原因
| 编号 | 操作 | 现象 |
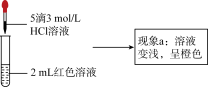
| ① | 向2mL红色溶液中滴加5滴水 | 溶液颜色无明显变化 |
| ② | 向2mL红色溶液中滴加5滴3mol∙L−1KCl溶液 | 溶液颜色变浅,呈橙色 |
(3)实验①的目的是
(4)根据实验①和实验②的结果,从平衡移动角度解释现象a:
实验Ⅱ、探究现象b中溶液呈浅黄色的原因
| 编号 | 操作 | 现象 |
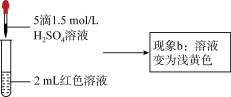
| ③ | 取1mL0.0025mol∙L−1Fe2(SO4)3溶液(无色),加入1mL0.01mol∙L−1KSCN溶液,再加入5滴1.5mol∙L−1H2SO4溶液 | 溶液先变红,加硫酸后变为浅黄色 |
| ④ | 取1mL0.005mol∙L−1FeCl3溶液,_____ | _____ |
(5)结合实验③可推测现象b中使溶液呈浅黄色的微粒可能有两种,分别是
(6)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒只是(5)中的一种,请将实验④的操作及现象补充完整:
您最近一年使用:0次
名校
5 . 钼酸铵是豆科植物的生命素。工业上欲利用废钼催化剂(主要成分为 ,还含少量的
,还含少量的 、CoS、NiO)制备钼酸铵,其具体流程为下:
、CoS、NiO)制备钼酸铵,其具体流程为下:
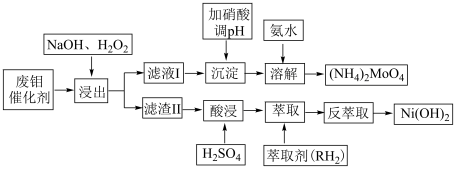
回答下列问题:
(1)为了提高浸出效率,可采取的措施为粉碎、___________ (写出2条)。
(2)写出浸出过程中主要反应的离子方程式___________ 。
(3)钼酸铵溶液经___________ 、过滤、洗涤、干燥可得到钼酸铵晶体,为减小产品损失,应选择下列___________ 试剂洗涤晶体。
A.蒸馏水 B.钼酸铵饱和溶液 C.乙醇水溶液
(4)由萃取过程的方程式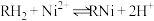 可知反萃取时应向体系中加入
可知反萃取时应向体系中加入___________ (酸性、碱性、中性)溶液。
(5)室温下,为保证反萃取后的溶液中 沉淀完全,应控制
沉淀完全,应控制 在什么范围
在什么范围___________ (已知:离子浓度小于 时可认为完全沉淀;
时可认为完全沉淀; )。
)。
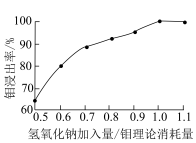
(6) 用量对钼的浸出率的影响如图所示,则浸出时最佳的
用量对钼的浸出率的影响如图所示,则浸出时最佳的 加入量与钼理论消耗量之比为
加入量与钼理论消耗量之比为___________ 。
 ,还含少量的
,还含少量的 、CoS、NiO)制备钼酸铵,其具体流程为下:
、CoS、NiO)制备钼酸铵,其具体流程为下:
回答下列问题:
(1)为了提高浸出效率,可采取的措施为粉碎、
(2)写出浸出过程中主要反应的离子方程式
(3)钼酸铵溶液经
A.蒸馏水 B.钼酸铵饱和溶液 C.乙醇水溶液
(4)由萃取过程的方程式
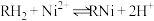 可知反萃取时应向体系中加入
可知反萃取时应向体系中加入(5)室温下,为保证反萃取后的溶液中
 沉淀完全,应控制
沉淀完全,应控制 在什么范围
在什么范围 时可认为完全沉淀;
时可认为完全沉淀; )。
)。(6)
 用量对钼的浸出率的影响如图所示,则浸出时最佳的
用量对钼的浸出率的影响如图所示,则浸出时最佳的 加入量与钼理论消耗量之比为
加入量与钼理论消耗量之比为
您最近一年使用:0次
解题方法
6 . 某班同学用如下实验探究 、
、 的性质,回答下列问题:
的性质,回答下列问题:
(1)分别取一定量 、
、 固体,均配制成0.1 mol⋅L-1的溶液。在
固体,均配制成0.1 mol⋅L-1的溶液。在 溶液中需加入少量铁屑,其目的是
溶液中需加入少量铁屑,其目的是___________ (用化学方程式表示)。
(2)甲组同学取2 mL 0.1 mol⋅L-1 溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红。或滴1滴KSCN溶液,无明显现象,再滴加几滴3%H2O2溶液(用
溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红。或滴1滴KSCN溶液,无明显现象,再滴加几滴3%H2O2溶液(用 酸化至
酸化至 ),溶液颜色变红。甲组同学通过上述实验分析
),溶液颜色变红。甲组同学通过上述实验分析 具有
具有___________ (填“氧化”或“还原”)性。 与KSCN溶液反应的离子方程式为
与KSCN溶液反应的离子方程式为___________ 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL 溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是
溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是___________ 。同时乙组同学查阅资料发现 与
与 可发生反应,生成无色的配合物。为证实该性质,用过量
可发生反应,生成无色的配合物。为证实该性质,用过量 溶液与
溶液与 溶液反应得到
溶液反应得到 ,用于验证
,用于验证 与
与 发生反应,进行a和b两组实验:
发生反应,进行a和b两组实验:

 的制备离子方程式为
的制备离子方程式为___________ ,实验b的目的是___________ ,从沉淀溶解平衡角度解释实验a和b最终溶液颜色不同的原因是___________ 。
(4)丙同学设计实验进一步证明 可与
可与 反应,进行d和c的对照实验。
反应,进行d和c的对照实验。
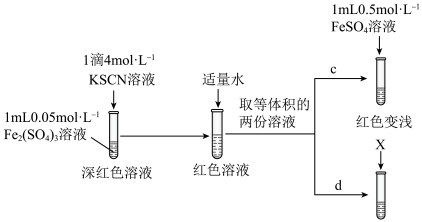
①X为___________ 。
②实验能够证实 可与
可与 反应,则应观察到的现象是
反应,则应观察到的现象是___________ 。
③实验中若未加适量水稀释,则无法通过现象得出结论。推测加水稀释的目的可能有:使后续实验颜色变化易于观察;降低 ,
,___________ 。
 、
、 的性质,回答下列问题:
的性质,回答下列问题:(1)分别取一定量
 、
、 固体,均配制成0.1 mol⋅L-1的溶液。在
固体,均配制成0.1 mol⋅L-1的溶液。在 溶液中需加入少量铁屑,其目的是
溶液中需加入少量铁屑,其目的是(2)甲组同学取2 mL 0.1 mol⋅L-1
 溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红。或滴1滴KSCN溶液,无明显现象,再滴加几滴3%H2O2溶液(用
溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红。或滴1滴KSCN溶液,无明显现象,再滴加几滴3%H2O2溶液(用 酸化至
酸化至 ),溶液颜色变红。甲组同学通过上述实验分析
),溶液颜色变红。甲组同学通过上述实验分析 具有
具有 与KSCN溶液反应的离子方程式为
与KSCN溶液反应的离子方程式为(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL
 溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是
溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是 与
与 可发生反应,生成无色的配合物。为证实该性质,用过量
可发生反应,生成无色的配合物。为证实该性质,用过量 溶液与
溶液与 溶液反应得到
溶液反应得到 ,用于验证
,用于验证 与
与 发生反应,进行a和b两组实验:
发生反应,进行a和b两组实验:
 的制备离子方程式为
的制备离子方程式为(4)丙同学设计实验进一步证明
 可与
可与 反应,进行d和c的对照实验。
反应,进行d和c的对照实验。
①X为
②实验能够证实
 可与
可与 反应,则应观察到的现象是
反应,则应观察到的现象是③实验中若未加适量水稀释,则无法通过现象得出结论。推测加水稀释的目的可能有:使后续实验颜色变化易于观察;降低
 ,
,
您最近一年使用:0次
名校
解题方法
7 . 金属铂(Pt)对气体(特别是H2、O2和CO)具有较强的吸附能力。因此常用来做电极材料,从某废旧电极材料(主要含有Pt、C、Al2O3、MgO)中回收Pt的一种工艺流程如图所示。
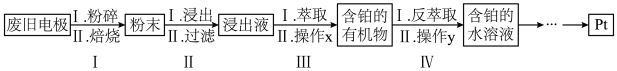
回答下列问题:
(1)过程Ⅰ中“焙烧”之前将废旧电极“粉碎”的目的是___________ 。
(2)实验人员采用三种不同的浸出液分别研究过程Ⅱ中Pt的浸出率。所用浸出液甲、乙、丙分别是HCl-H2SO4-NaClO3、HCI-NaClO3和HCl-H2O2。
①将浸出液为乙时的离子方程式补充完整:_____________
3Pt+___________Cl-+___________ +___________=3[PtCl6]2-+___________H2O
+___________=3[PtCl6]2-+___________H2O
②当NaClO3或H2O2作为氧化剂浸出等量Pt时,n(NaClO3):n(H2O2)=___________ 。
③c(H+)相同、浸出时间相同时,甲、乙、丙三种浸出液对Pt的浸出率如下表。[注:c(NaClO3)按照②中的物质的量关系换算成c(H2O2)计]。
a.以HCl-NaClO3为例,说明当其中氧化剂浓度大于0.2mol/L时,Pt的浸出率降低的原因:随着c(NaClO3)增大,其氧化性增强,部分 被
被___________ 还原而消耗。
b.氧化剂浓度均为0.2mol/L时,甲中Pt的浸出率最低的可能原因:由于三种浸出液中的c(H+)均相同,
(3)过程Ⅲ中萃取剂(R3N)的萃取机理如下(O表示有机体系,A表示水溶液体系)。
ⅰ.R3N(O)+ +
+
 R3NHCl(O)。
R3NHCl(O)。
ⅱ.2R3NHCl(O)+
 (R3NH)2[PtCl6](O)+2
(R3NH)2[PtCl6](O)+2
①分离操作x是___________ 。
②“反萃取”时向含Pt的有机物中加入NaOH溶液,可使[PtCl6]2-进入水溶液体系,反应的离子方程式是___________ 。

回答下列问题:
(1)过程Ⅰ中“焙烧”之前将废旧电极“粉碎”的目的是
(2)实验人员采用三种不同的浸出液分别研究过程Ⅱ中Pt的浸出率。所用浸出液甲、乙、丙分别是HCl-H2SO4-NaClO3、HCI-NaClO3和HCl-H2O2。
①将浸出液为乙时的离子方程式补充完整:
3Pt+___________Cl-+___________
 +___________=3[PtCl6]2-+___________H2O
+___________=3[PtCl6]2-+___________H2O②当NaClO3或H2O2作为氧化剂浸出等量Pt时,n(NaClO3):n(H2O2)=
③c(H+)相同、浸出时间相同时,甲、乙、丙三种浸出液对Pt的浸出率如下表。[注:c(NaClO3)按照②中的物质的量关系换算成c(H2O2)计]。
| 编号 | 氧化剂浓度/mol·L-1 | 0.1 | 0.2 | 0.3 | 0.4 |
| 甲 | HCl-H2SO4-NaClO3对Pt的浸出率/% | 72.7 | 78.2 | 77.5 | 75.4 |
| 乙 | HCl-NaClO3对Pt的浸出率/% | 79.6 | 85.3. | 82.1 | 81.6. |
| 丙 | HCl-H2O2对Pt的浸出率/% | 80.0 | 85.6. | 83.2 | 82.5 |
 被
被b.氧化剂浓度均为0.2mol/L时,甲中Pt的浸出率最低的可能原因:由于三种浸出液中的c(H+)均相同,
(3)过程Ⅲ中萃取剂(R3N)的萃取机理如下(O表示有机体系,A表示水溶液体系)。
ⅰ.R3N(O)+
 +
+
 R3NHCl(O)。
R3NHCl(O)。ⅱ.2R3NHCl(O)+

 (R3NH)2[PtCl6](O)+2
(R3NH)2[PtCl6](O)+2
①分离操作x是
②“反萃取”时向含Pt的有机物中加入NaOH溶液,可使[PtCl6]2-进入水溶液体系,反应的离子方程式是
您最近一年使用:0次
名校
解题方法
8 . 氟碳铈矿(主要成分为 )是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图:
)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图:

(1) 中
中 的化合价为
的化合价为___________ ;氧化焙烧时不能使用陶瓷容器的原因是产物 会腐蚀
会腐蚀 生成
生成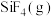 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(2)氧化焙烧后的产物之一为 ,则酸浸时发生反应的离子方程式为
,则酸浸时发生反应的离子方程式为___________ 。
(3)操作I的名称为___________ ;有机物 能将
能将 从水溶液中提取出来,该过程可表示为
从水溶液中提取出来,该过程可表示为 。向
。向 中加入稀硫酸能获得较纯的含
中加入稀硫酸能获得较纯的含 水溶液,从平衡移动角度解释其原因
水溶液,从平衡移动角度解释其原因___________ 。
(4)写出向 悬浊液中通入氧气得到产品
悬浊液中通入氧气得到产品 的化学方程式
的化学方程式___________ 。
 )是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图:
)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图:
(1)
 中
中 的化合价为
的化合价为 会腐蚀
会腐蚀 生成
生成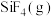 ,该反应的化学方程式为
,该反应的化学方程式为(2)氧化焙烧后的产物之一为
 ,则酸浸时发生反应的离子方程式为
,则酸浸时发生反应的离子方程式为(3)操作I的名称为
 能将
能将 从水溶液中提取出来,该过程可表示为
从水溶液中提取出来,该过程可表示为 。向
。向 中加入稀硫酸能获得较纯的含
中加入稀硫酸能获得较纯的含 水溶液,从平衡移动角度解释其原因
水溶液,从平衡移动角度解释其原因(4)写出向
 悬浊液中通入氧气得到产品
悬浊液中通入氧气得到产品 的化学方程式
的化学方程式
您最近一年使用:0次
名校
解题方法
9 . 探究甲醇对丙烷制丙烯的影响。丙烷制烯烃过程主要发生的反应有
ⅰ.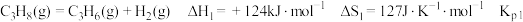
ⅱ.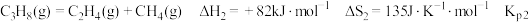
ⅲ.
已知: 为用气体分压表示的平衡常数,分压=物质的量分数×总压。在
为用气体分压表示的平衡常数,分压=物质的量分数×总压。在 下,丙烷单独进料时,平衡体系中各组分的体积分数
下,丙烷单独进料时,平衡体系中各组分的体积分数 见下表。
见下表。
(1)比较反应自发进行(∆G=∆H-T∆S<0)的最低温度,反应ⅰ_____ 反应 ⅱ(填“>”或“<”)。
(2)①从初始投料到达到平衡,反应 ⅰ、ⅱ、ⅲ 的丙烷消耗的平均速率从大到小的顺序为:_____ 。
②平衡体系中检测不到 ,可认为存在反应:
,可认为存在反应: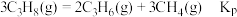 ,下列相关说法正确的是
,下列相关说法正确的是_____ (填标号)。
a.
b.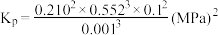
c.使用催化剂,可提高丙烯的平衡产率
d.平衡后再通入少量丙烷,可提高丙烯的体积分数
③由表中数据推算:丙烯选择性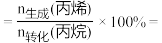
_____ (列出计算式)。
(3)丙烷甲醇共进料时,还发生反应:ⅳ.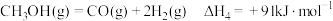 ,在
,在 下,平衡体系中各组分体积分数与进料比的关系如图所示。
下,平衡体系中各组分体积分数与进料比的关系如图所示。
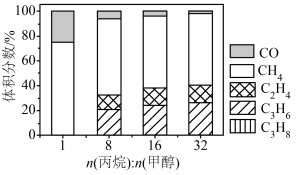
①进料比n(丙烷):n(甲醇) 时,体系总反应:
时,体系总反应: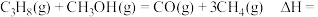
______  。
。
②随着甲醇投料增加,平衡体系中丙烯的体积分数降低的原因是______ 。
ⅰ.
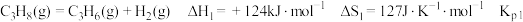
ⅱ.
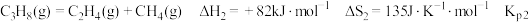
ⅲ.

已知:
 为用气体分压表示的平衡常数,分压=物质的量分数×总压。在
为用气体分压表示的平衡常数,分压=物质的量分数×总压。在 下,丙烷单独进料时,平衡体系中各组分的体积分数
下,丙烷单独进料时,平衡体系中各组分的体积分数 见下表。
见下表。| 物质 | 丙烯 | 乙烯 | 甲烷 | 丙烷 | 氢气 |
| 体积分数(%) | 21 | 23.7 | 55.2 | 0.1 | 0 |
(1)比较反应自发进行(∆G=∆H-T∆S<0)的最低温度,反应ⅰ
(2)①从初始投料到达到平衡,反应 ⅰ、ⅱ、ⅲ 的丙烷消耗的平均速率从大到小的顺序为:
②平衡体系中检测不到
 ,可认为存在反应:
,可认为存在反应: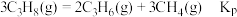 ,下列相关说法正确的是
,下列相关说法正确的是a.

b.
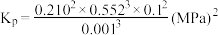
c.使用催化剂,可提高丙烯的平衡产率
d.平衡后再通入少量丙烷,可提高丙烯的体积分数
③由表中数据推算:丙烯选择性
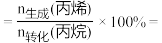
(3)丙烷甲醇共进料时,还发生反应:ⅳ.
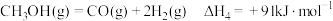 ,在
,在 下,平衡体系中各组分体积分数与进料比的关系如图所示。
下,平衡体系中各组分体积分数与进料比的关系如图所示。
①进料比n(丙烷):n(甲醇)
 时,体系总反应:
时,体系总反应: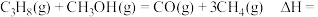
 。
。②随着甲醇投料增加,平衡体系中丙烯的体积分数降低的原因是
您最近一年使用:0次
10 . 铜盐是五颜六色的。某学习小组发现固体 (白色)、固体
(白色)、固体 (棕黄色)、固体
(棕黄色)、固体 (深褐色)。
(深褐色)。 和
和 溶液呈蓝色,
溶液呈蓝色, 溶液时而呈绿色,时而呈蓝色,于是对颜色不同的原因展开了探究。
溶液时而呈绿色,时而呈蓝色,于是对颜色不同的原因展开了探究。
【查阅资料】
1.固体铜盐的颜色与阴离子极化能力有关,随化学键共价性增强,吸收光的能量下降,因此颜色加深。
2.在 溶液中存在如下平衡:
溶液中存在如下平衡:

【提出假设】
1.铜盐的颜色不同与离子种类有关。
2. 溶液呈绿色的原因是溶液中既有黄色的
溶液呈绿色的原因是溶液中既有黄色的 ,又有蓝色的
,又有蓝色的 ,根据光学原理蓝色和黄色的混合色为绿色。
,根据光学原理蓝色和黄色的混合色为绿色。
【设计方案】
回答下列问题:
(1)解释 的颜色深于
的颜色深于 的原因
的原因___________ 。
(2)配制 溶液的方法是
溶液的方法是___________ 。
(3)根据表中信息,补充试剂和数据:饱和___________ 、a=___________ 。
(4)实验4和5中溶液颜色差异的原因___________ (用平衡移动原理解释)。
(5)以上实验说明影响 溶液颜色的因素主要有
溶液颜色的因素主要有___________ 。(答两点即可)
【实验结论】假设1,2成立。
(6) 溶液呈现不同颜色的根本原因与
溶液呈现不同颜色的根本原因与 、
、 和
和___________ 微粒(写结构式)的浓度有关。
 (白色)、固体
(白色)、固体 (棕黄色)、固体
(棕黄色)、固体 (深褐色)。
(深褐色)。 和
和 溶液呈蓝色,
溶液呈蓝色, 溶液时而呈绿色,时而呈蓝色,于是对颜色不同的原因展开了探究。
溶液时而呈绿色,时而呈蓝色,于是对颜色不同的原因展开了探究。【查阅资料】
1.固体铜盐的颜色与阴离子极化能力有关,随化学键共价性增强,吸收光的能量下降,因此颜色加深。
2.在
 溶液中存在如下平衡:
溶液中存在如下平衡:
【提出假设】
1.铜盐的颜色不同与离子种类有关。
2.
 溶液呈绿色的原因是溶液中既有黄色的
溶液呈绿色的原因是溶液中既有黄色的 ,又有蓝色的
,又有蓝色的 ,根据光学原理蓝色和黄色的混合色为绿色。
,根据光学原理蓝色和黄色的混合色为绿色。【设计方案】
| 序号 | 温度/℃ | V( 氯化铜)/mL 氯化铜)/mL | V(饱和硫酸铜)/mL | V(饱和___________)/mL | V(饱和氯化钠)/mL | V(水)/mL | 溶液颜色 |
| 1 | 25 | 4.0 | 无色 | ||||
| 2 | 25 | 4.0 | 无色 | ||||
| 3 | 25 | 4.0 | 蓝色 | ||||
| 4 | 25 | 4.0 | 绿色 | ||||
| 5 | 25 | 2.0 | a | 蓝绿色 | |||
| 6 | 25 | 2.0 | 2.0 | 蓝绿色 | |||
| 7 | 25 | 2.0 | 2.0 | 黄绿色 | |||
| 8 | 50 | 4.0 | 黄绿色 |
(1)解释
 的颜色深于
的颜色深于 的原因
的原因(2)配制
 溶液的方法是
溶液的方法是(3)根据表中信息,补充试剂和数据:饱和
(4)实验4和5中溶液颜色差异的原因
(5)以上实验说明影响
 溶液颜色的因素主要有
溶液颜色的因素主要有【实验结论】假设1,2成立。
(6)
 溶液呈现不同颜色的根本原因与
溶液呈现不同颜色的根本原因与 、
、 和
和
您最近一年使用:0次
2024-01-13更新
|
653次组卷
|
4卷引用:辽宁省沈阳市部分高中2023-2024学年高三上学期教学质量监测(一)化学试题



