名校
1 . 某学习小组欲利用 平衡体系探究影响平衡的因素,将220 mL 0.005 mol⋅L
平衡体系探究影响平衡的因素,将220 mL 0.005 mol⋅L
 溶液和20 mL 0.015 mol⋅L
溶液和20 mL 0.015 mol⋅L KSCN溶液混合,得血红色溶液X,进行下列实验:
KSCN溶液混合,得血红色溶液X,进行下列实验:
实验Ⅰ.改变 、
、 、
、 、
、 等离子浓度对平衡的影响
等离子浓度对平衡的影响
(1)取2 mL溶液X,加入5滴0.01 mol⋅L KSCN溶液,溶液红色
KSCN溶液,溶液红色_______ (填“变深”、“变浅”或“不变”,下同);取2 mL溶液X,插入经砂纸打磨过的铁丝,溶液红色_______ 。基于上述两个实验可以得到的结论是_______ 。
(2)取2 mL溶液X,加入5滴0.03 mol⋅L KCl溶液,观察到溶液红色变浅,产生该现象的原因可能是
KCl溶液,观察到溶液红色变浅,产生该现象的原因可能是_______ 或者不直接参与平衡体系的 或
或 对平衡产生了影响。
对平衡产生了影响。
实验Ⅱ.探究KCl对 平衡体系的影响为了确定KCl是否对平衡产生影响,学习小组同学进行如下探究:各取2mL溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
平衡体系的影响为了确定KCl是否对平衡产生影响,学习小组同学进行如下探究:各取2mL溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
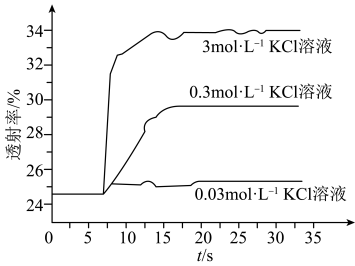
(3)上述实验可以得到以下结论:一是KCl对 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响_______ 。二是_______ 。
(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①: 产生的影响。
产生的影响。
猜想②: 产生的影响。
产生的影响。
猜想③:_______ 。
实验Ⅲ.探究盐对 和
和 平衡体系产生的影响
平衡体系产生的影响
资料信息:
a.溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
b.在 溶液中存在反应
溶液中存在反应 。
。
(5)根据上述信息,学习小组同学各取2 mL溶液X,分别加入5滴①去离子水、②0.3 mol⋅L KCl溶液、③0.3 mol⋅L
KCl溶液、③0.3 mol⋅L NaCl溶液、④0.3 mol⋅L
NaCl溶液、④0.3 mol⋅L
 溶液、⑤3 mol⋅L
溶液、⑤3 mol⋅L HCl溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
HCl溶液进行实验,测得各溶液的透射率随时间的变化如图所示。

上述实验能证明阳离子盐效应影响 平衡体系的实验组是
平衡体系的实验组是_______ 。盐效应影响较大的阳离子是_______ 。
A.实验①②③ B.实验①②④ C.实验①③④
(6)解释出现实验⑤现象的原因:_______ 。
 平衡体系探究影响平衡的因素,将220 mL 0.005 mol⋅L
平衡体系探究影响平衡的因素,将220 mL 0.005 mol⋅L
 溶液和20 mL 0.015 mol⋅L
溶液和20 mL 0.015 mol⋅L KSCN溶液混合,得血红色溶液X,进行下列实验:
KSCN溶液混合,得血红色溶液X,进行下列实验:实验Ⅰ.改变
 、
、 、
、 、
、 等离子浓度对平衡的影响
等离子浓度对平衡的影响(1)取2 mL溶液X,加入5滴0.01 mol⋅L
 KSCN溶液,溶液红色
KSCN溶液,溶液红色(2)取2 mL溶液X,加入5滴0.03 mol⋅L
 KCl溶液,观察到溶液红色变浅,产生该现象的原因可能是
KCl溶液,观察到溶液红色变浅,产生该现象的原因可能是 或
或 对平衡产生了影响。
对平衡产生了影响。实验Ⅱ.探究KCl对
 平衡体系的影响为了确定KCl是否对平衡产生影响,学习小组同学进行如下探究:各取2mL溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
平衡体系的影响为了确定KCl是否对平衡产生影响,学习小组同学进行如下探究:各取2mL溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
(3)上述实验可以得到以下结论:一是KCl对
 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①:
 产生的影响。
产生的影响。猜想②:
 产生的影响。
产生的影响。猜想③:
实验Ⅲ.探究盐对
 和
和 平衡体系产生的影响
平衡体系产生的影响资料信息:
a.溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
b.在
 溶液中存在反应
溶液中存在反应 。
。(5)根据上述信息,学习小组同学各取2 mL溶液X,分别加入5滴①去离子水、②0.3 mol⋅L
 KCl溶液、③0.3 mol⋅L
KCl溶液、③0.3 mol⋅L NaCl溶液、④0.3 mol⋅L
NaCl溶液、④0.3 mol⋅L
 溶液、⑤3 mol⋅L
溶液、⑤3 mol⋅L HCl溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
HCl溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
上述实验能证明阳离子盐效应影响
 平衡体系的实验组是
平衡体系的实验组是A.实验①②③ B.实验①②④ C.实验①③④
(6)解释出现实验⑤现象的原因:
您最近一年使用:0次
2023-05-21更新
|
327次组卷
|
2卷引用:江西省萍乡中学、新余市第一中学2023-2024学年高二上学期10月创新班联考化学试题
名校
解题方法
2 . 某小组同学探究盐对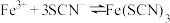 平衡体系的影响。
平衡体系的影响。
实验Ⅰ:探究KCl对 和
和 平衡体系的影响
平衡体系的影响
将等体积、低浓度的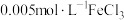 溶液(已用稀盐酸酸化)和
溶液(已用稀盐酸酸化)和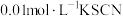 溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。

已知:①溶液的透光率与溶液颜色深浅有关,颜色深,透光率低。
② 在水溶液中由于水解而显黄色;
在水溶液中由于水解而显黄色; 溶液中存在
溶液中存在 (黄色)。
(黄色)。
(1)稀盐酸酸化 溶液的目的是
溶液的目的是___________ 。采用浓度较低的 溶液制备
溶液制备 和
和 平衡体系,是为了避免
平衡体系,是为了避免___________ (填离子符号)的颜色对实验干扰。
(2)从实验结果来看,KCl溶液确实对 和
和 平衡体系有影响,且随着KCl浓度增大,
平衡体系有影响,且随着KCl浓度增大, 平衡向
平衡向___________ (填“正”或“逆”)反应方向移动。
同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。KCl溶液的加入使 和
和 平衡状态因盐效应而发生变化。
平衡状态因盐效应而发生变化。
原因2:溶液中存在副反应 ,离子浓度发生变化,导致
,离子浓度发生变化,导致 和
和 平衡状态发生变化。
平衡状态发生变化。
(3)基于以上分析,该组同学取等体积的溶液a,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
①上述实验可证明盐效应影响了 和
和 平衡体系的是
平衡体系的是___________ (填字母序号)。
a.1和2 b.1和3 c.1和4
②选择实验___________ (填序号)可得出结论: 的盐效应弱于
的盐效应弱于 的盐效应。
的盐效应。
(4)取等体积的溶液a继续进行实验,结果如下表。
上述实验可证明副反应影响了 和
和 平衡体系,结合实验现象及化学用语分析副反应对
平衡体系,结合实验现象及化学用语分析副反应对 和
和 平衡体系有影响的原因:
平衡体系有影响的原因:___________ 。
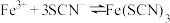 平衡体系的影响。
平衡体系的影响。实验Ⅰ:探究KCl对
 和
和 平衡体系的影响
平衡体系的影响将等体积、低浓度的
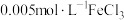 溶液(已用稀盐酸酸化)和
溶液(已用稀盐酸酸化)和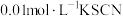 溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
已知:①溶液的透光率与溶液颜色深浅有关,颜色深,透光率低。
②
 在水溶液中由于水解而显黄色;
在水溶液中由于水解而显黄色; 溶液中存在
溶液中存在 (黄色)。
(黄色)。(1)稀盐酸酸化
 溶液的目的是
溶液的目的是 溶液制备
溶液制备 和
和 平衡体系,是为了避免
平衡体系,是为了避免(2)从实验结果来看,KCl溶液确实对
 和
和 平衡体系有影响,且随着KCl浓度增大,
平衡体系有影响,且随着KCl浓度增大, 平衡向
平衡向同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。KCl溶液的加入使
 和
和 平衡状态因盐效应而发生变化。
平衡状态因盐效应而发生变化。原因2:溶液中存在副反应
 ,离子浓度发生变化,导致
,离子浓度发生变化,导致 和
和 平衡状态发生变化。
平衡状态发生变化。(3)基于以上分析,该组同学取等体积的溶液a,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
| 序号 | 加入少量盐 | 溶液颜色 |
| 1 | 无 | 红色 |
| 2 | KCl | 变浅 |
| 3 |  | 略变浅 |
| 4 | NaCl | 变浅程度较大 |
 和
和 平衡体系的是
平衡体系的是a.1和2 b.1和3 c.1和4
②选择实验
 的盐效应弱于
的盐效应弱于 的盐效应。
的盐效应。(4)取等体积的溶液a继续进行实验,结果如下表。
| 序号 | 加入溶液 | 溶液颜色 |
| 5 | 1mL浓盐酸 | 明显变浅,溶液偏黄 |
| 6 | 1mL去离子水 | 略变浅 |
 和
和 平衡体系,结合实验现象及化学用语分析副反应对
平衡体系,结合实验现象及化学用语分析副反应对 和
和 平衡体系有影响的原因:
平衡体系有影响的原因:
您最近一年使用:0次
2023-04-20更新
|
117次组卷
|
4卷引用:江西省宜春市宜丰中学2023-2024学年高一上学期12月月考化学试题
3 . 某小组同学探究盐对Fe3++3SCN- Fe(SCN)3平衡体系的影响。
Fe(SCN)3平衡体系的影响。
实验I:探究KCl对Fe3+和SCN-平衡体系的影响将已用稀盐酸酸化0.005mol·L-1FeCl3溶液(无色)和0.01mol·L-1KSCN溶液等体积混合,静置至体系达平衡,得红色溶液X。各取2mL溶液X放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
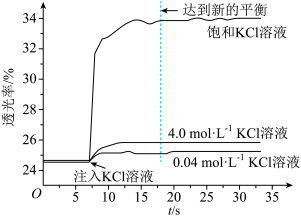
已知:①溶液的透光率与溶液颜色深浅有关,颜色深,透光率低。
②Cl、 与Fe3+均能发生络合反应:Fe3++4C1-
与Fe3+均能发生络合反应:Fe3++4C1- [FeCl4]-(黄色)、Fe3++2
[FeCl4]-(黄色)、Fe3++2
 [Fe(SO4)2]-(无色)。
[Fe(SO4)2]-(无色)。
(1)稀盐酸酸化FeCl3溶液的目的是___________ 。(用离子方程式表示)。采用浓度较低的FeCl3溶液制备Fe3+和SCN-的平衡体系,是为了避免___________ (填离子符号)的颜色对实验干扰。
(2)从实验结果来看,KCl溶液确实对Fe3+和SCN-平衡体系有影响,且随着KCl浓度增大,Fe3++3SCN- Fe(SCN)3平衡向
Fe(SCN)3平衡向___________ (填“正反应”或“逆反应”)方向移动。
实验II:探究盐对Fe3+和SCN-平衡体系产生影响的原因
同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。KCl溶液的加入使Fe3+和SCN-平衡状态因盐效应而发生变化。
原因2:溶液中存在副反应Fe3++4C1- [FeCl4]-,离子浓度发生变化,导致Fe3+和SCN-平衡状态发生变化。
[FeCl4]-,离子浓度发生变化,导致Fe3+和SCN-平衡状态发生变化。
(3)基于以上分析,该组同学取2mL红色溶液X,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
基于以上实验现象可得出结论:K+的盐效应弱于Na+的盐效应。简述获得结论的依据:______ 。
(4)取2mL溶液X继续进行实验,结果如下表。
上述实验③和实验④可证明副反应影响了Fe3+和SCN-平衡体系,结合实验现象及化学用语分析副反应对Fe3+和SCN-平衡体系有影响的原因:___________ 。
实验III:探究现象a中溶液变为浅黄色的的原因
(5)由实验④、实验⑤和实验⑥可知,溶液变为浅黄色与___________ (填微粒的化学式)无关。
(6)为了进一步确认现象a中使溶液呈浅黄色的微粒只有Fe(SCN)3,补充完整实验⑦的操作___________ 。
 Fe(SCN)3平衡体系的影响。
Fe(SCN)3平衡体系的影响。实验I:探究KCl对Fe3+和SCN-平衡体系的影响将已用稀盐酸酸化0.005mol·L-1FeCl3溶液(无色)和0.01mol·L-1KSCN溶液等体积混合,静置至体系达平衡,得红色溶液X。各取2mL溶液X放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。

已知:①溶液的透光率与溶液颜色深浅有关,颜色深,透光率低。
②Cl、
 与Fe3+均能发生络合反应:Fe3++4C1-
与Fe3+均能发生络合反应:Fe3++4C1- [FeCl4]-(黄色)、Fe3++2
[FeCl4]-(黄色)、Fe3++2
 [Fe(SO4)2]-(无色)。
[Fe(SO4)2]-(无色)。(1)稀盐酸酸化FeCl3溶液的目的是
(2)从实验结果来看,KCl溶液确实对Fe3+和SCN-平衡体系有影响,且随着KCl浓度增大,Fe3++3SCN-
 Fe(SCN)3平衡向
Fe(SCN)3平衡向实验II:探究盐对Fe3+和SCN-平衡体系产生影响的原因
同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。KCl溶液的加入使Fe3+和SCN-平衡状态因盐效应而发生变化。
原因2:溶液中存在副反应Fe3++4C1-
 [FeCl4]-,离子浓度发生变化,导致Fe3+和SCN-平衡状态发生变化。
[FeCl4]-,离子浓度发生变化,导致Fe3+和SCN-平衡状态发生变化。(3)基于以上分析,该组同学取2mL红色溶液X,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
| 序号 | 加入少量盐 | 溶液颜色 |
| ① | KCl | 变浅 |
| ② | NaCl | 变浅程度较大 |
(4)取2mL溶液X继续进行实验,结果如下表。
| 序号 | 加入溶液 | 溶液颜色 |
| ③ | 1mL蒸馏水 | 略变浅 |
| ④ | 1mL3mol·L-1盐酸 | 明显变浅,溶液偏黄 |
| ⑤ | 1mL1.5mol·L-1硫酸 | 现象a:溶液变为浅黄色 |
实验III:探究现象a中溶液变为浅黄色的的原因
| 序号 | 实验操作 | 溶液颜色 |
| ⑥ | 取1mL0.0025mol:L-1Fe2(SO4)3溶液(无色),加入1mL0.01mol·L-1KSCN溶液,再加入1mL1.5mol·L-1硫酸 | 溶液先变红,加入硫酸后变为浅黄色 |
| ⑦ | 取1mL0.005mol·L-1FeCl3溶液(无色) | 溶液为无色 |
(6)为了进一步确认现象a中使溶液呈浅黄色的微粒只有Fe(SCN)3,补充完整实验⑦的操作
您最近一年使用:0次
解题方法
4 . 工业上合成氨的化学反应,在容积为10L的密闭容器中,通入40molN2和120molH2在一定条件下进行反应,4s后达到平衡状态,此时N2的浓度为2mol/L。通过计算回答下列问题:
(1)用N2表示的4s内化学反应的平均速率是___________ 。
(2)若生成17g氨气,放出46.2kJ热量,写出生成2摩尔氨反应的热化学方程式___________ 。
(3)若外界条件改变为降低温度,则平衡向___________ (填“正反应”或“逆反应”)方向移动,达到平衡后,N2的物质的量浓度___________ (填“大于、小于、等于”)2mol/L
(4)上述反应达到平衡后,在其它条件不变的情况下,通过增大容器体积减小压强,则NH3的合成率___________ (填“增大”“减少”或“不变”)。
(1)用N2表示的4s内化学反应的平均速率是
(2)若生成17g氨气,放出46.2kJ热量,写出生成2摩尔氨反应的热化学方程式
(3)若外界条件改变为降低温度,则平衡向
(4)上述反应达到平衡后,在其它条件不变的情况下,通过增大容器体积减小压强,则NH3的合成率
您最近一年使用:0次
名校
5 . 1776年,法国化学家LaVoisier首次确定硫元素。自然界天然的硫单质主要存在于火山区,发生反应如下(a、b均大于0):ⅰ.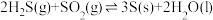
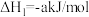 ;
;
ⅱ. 。回答下列问题:
。回答下列问题:
(1)根据上述信息,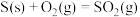 )
) 
_______ kJ/mol。推测a____ b或(填“>”“<”或“=”)。
(2)一定温度下,在恒容密闭容器中充入适量的 、
、 和
和 气体,仅发生上述反应。下列叙述正确的是_______(填字母)。
气体,仅发生上述反应。下列叙述正确的是_______(填字母)。
(3)一定温度下,向2L密闭容器中充入 和
和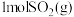 ,仅发生反应①,达到平衡后,测得
,仅发生反应①,达到平衡后,测得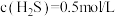 。温度保持不变,压缩容器至1L且保持体积不变,达到新平衡时
。温度保持不变,压缩容器至1L且保持体积不变,达到新平衡时
_______ mol/L。
(4)在恒容密闭容器中充入一定量 和
和 气体,测得
气体,测得 的平衡转化率与温度、投料比
的平衡转化率与温度、投料比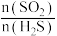 关系如图所示。
关系如图所示。
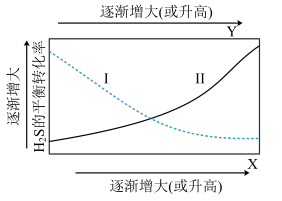
①代表 的平衡转化率随温度变化的曲线为
的平衡转化率随温度变化的曲线为_______ 。
②解释曲线Ⅱ变化趋势:_______ 。
(5)一定温度下,向密闭容器中充入 、
、 和
和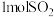 ,达到平衡时测得平衡体系中有
,达到平衡时测得平衡体系中有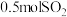 和
和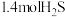 ,平衡时总压强为21kPa。该温度下,反应②的平衡常数
,平衡时总压强为21kPa。该温度下,反应②的平衡常数
_______ 。(不要求带单位,可用分数表示,提示:用分压计算的平衡常数为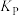 ,分压等于总压×物质的量分数)。
,分压等于总压×物质的量分数)。
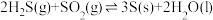
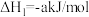 ;
;ⅱ.
 。回答下列问题:
。回答下列问题:(1)根据上述信息,
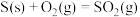 )
) 
(2)一定温度下,在恒容密闭容器中充入适量的
 、
、 和
和 气体,仅发生上述反应。下列叙述正确的是_______(填字母)。
气体,仅发生上述反应。下列叙述正确的是_______(填字母)。| A.混合气体密度不再随时间变化时达到平衡状态 |
| B.增大硫单质的质量,逆反应速率会增大 |
C.达到平衡后,适当升温, 的平衡转化率减小 的平衡转化率减小 |
| D.平衡后充入少量惰性气体(不反应),平衡向左移动 |
 和
和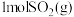 ,仅发生反应①,达到平衡后,测得
,仅发生反应①,达到平衡后,测得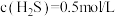 。温度保持不变,压缩容器至1L且保持体积不变,达到新平衡时
。温度保持不变,压缩容器至1L且保持体积不变,达到新平衡时
(4)在恒容密闭容器中充入一定量
 和
和 气体,测得
气体,测得 的平衡转化率与温度、投料比
的平衡转化率与温度、投料比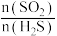 关系如图所示。
关系如图所示。
①代表
 的平衡转化率随温度变化的曲线为
的平衡转化率随温度变化的曲线为②解释曲线Ⅱ变化趋势:
(5)一定温度下,向密闭容器中充入
 、
、 和
和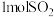 ,达到平衡时测得平衡体系中有
,达到平衡时测得平衡体系中有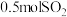 和
和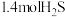 ,平衡时总压强为21kPa。该温度下,反应②的平衡常数
,平衡时总压强为21kPa。该温度下,反应②的平衡常数
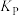 ,分压等于总压×物质的量分数)。
,分压等于总压×物质的量分数)。
您最近一年使用:0次
2022-12-15更新
|
358次组卷
|
3卷引用:江西省2022-2023学年高二上学期12月统一调研测试(联考)化学试题
解题方法
6 . 兴趣小组同学为探究影响化学反应速率及化学平衡的因素,设计以下实验:

(1)利用实验I探究锌与稀硫酸反应的速率,需要记录的实验数据有:___________ 。
(2)利用实验II探究浓度对化学平衡的影响。已知: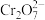 (橙色)
(橙色)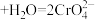 (黄色)
(黄色)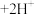 ,推测B试管中的实验现象为:
,推测B试管中的实验现象为:___________ ,用平衡移动原理解释其原因:___________ 。
(3)该小组同学继续用酸性 溶液和草酸(
溶液和草酸( )溶液进行实验,设计实验方案如表所示。请回答相关问题:
)溶液进行实验,设计实验方案如表所示。请回答相关问题:
①实验时,分别量取 溶液和酸性
溶液和酸性 溶液,迅速混合并开始计时,通过测定
溶液,迅速混合并开始计时,通过测定___________ 来判断反应的快慢。
②实验a、b、c所加的 溶液均要过量。理由是
溶液均要过量。理由是___________ 。
③实验a和b是探究___________ 对化学反应速率的影响。实验b和c是探究___________ 对化学反应速率的影响。
④实验a和b起初反应均很慢,过了一会儿速率突然增大,可能原因是___________ 。

(1)利用实验I探究锌与稀硫酸反应的速率,需要记录的实验数据有:
(2)利用实验II探究浓度对化学平衡的影响。已知:
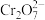 (橙色)
(橙色)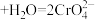 (黄色)
(黄色)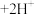 ,推测B试管中的实验现象为:
,推测B试管中的实验现象为:(3)该小组同学继续用酸性
 溶液和草酸(
溶液和草酸( )溶液进行实验,设计实验方案如表所示。请回答相关问题:
)溶液进行实验,设计实验方案如表所示。请回答相关问题:| 编号 | 温度℃ |  溶液 溶液 | 酸性 溶液 溶液 | ||
浓度/( ) ) | 体积/mL | 浓度/( ) ) | 体积/mL | ||
| a | 25 | 0.10 | 2.0 | 0.010 | 4.0 |
| b | 25 | 0.20 | 2.0 | 0.010 | 4.0 |
| c | 50 | 0.20 | 2.0 | 0.010 | 4.0 |
 溶液和酸性
溶液和酸性 溶液,迅速混合并开始计时,通过测定
溶液,迅速混合并开始计时,通过测定②实验a、b、c所加的
 溶液均要过量。理由是
溶液均要过量。理由是③实验a和b是探究
④实验a和b起初反应均很慢,过了一会儿速率突然增大,可能原因是
您最近一年使用:0次
名校
7 . 研究氮氧化物、碳氧化物的产生及利用有重要的化学意义。回答下列问题:
(1)汽车燃料中不含氮元素,汽车尾气中所含NO产生的原因是_______ 。
(2)将SrCO3放入密闭的真空容器中,发生反应SrCO3(s)⇌SrCO3(s)+CO2(g),反应达到平衡时c(CO2)为x mol/L,如反应温度不变,将反应体系的体积快速压缩为原来的一半,则c(CO2)的变化范围为_______ 。
(3)用CO2和H2在一定条件下可转化生成甲醇蒸气和水蒸气:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ∆H
已知部分化学键键能如表所示:
①∆H=_______ kJ∙mol-1;
②一定条件下,在相同体积的恒容密闭容器中充入1.0mol CO2和3.0mol H2,相同时间段内测得CO2的转化率随温度变化如图所示:
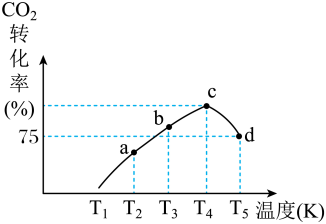
d点v正_______ v逆(填“>”“<”或“=”)。已知容器内的起始压强为160kPa,则图中d点对应温度下反应的平衡常数Kp=_______ kPa-2(KP为以分压表示的平衡常数,分压=总压×物质的量分数)
(1)汽车燃料中不含氮元素,汽车尾气中所含NO产生的原因是
(2)将SrCO3放入密闭的真空容器中,发生反应SrCO3(s)⇌SrCO3(s)+CO2(g),反应达到平衡时c(CO2)为x mol/L,如反应温度不变,将反应体系的体积快速压缩为原来的一半,则c(CO2)的变化范围为
(3)用CO2和H2在一定条件下可转化生成甲醇蒸气和水蒸气:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ∆H
已知部分化学键键能如表所示:
| 化学键 | H-H | C=O | C-O | H-O | C-H |
| E/(kJ·mol-1) | 436 | 745 | 351 | 463 | 413 |
②一定条件下,在相同体积的恒容密闭容器中充入1.0mol CO2和3.0mol H2,相同时间段内测得CO2的转化率随温度变化如图所示:

d点v正
您最近一年使用:0次
名校
解题方法
8 . 某研究小组学生探究硫酸铁溶液与铜粉的反应,回答下列问题:
(1)由 固体配制
固体配制 溶液,下列图示仪器中不需要用到的有
溶液,下列图示仪器中不需要用到的有_______ (写名称)。

(2)研究小组设计如表实验,并记录实验现象:
【资料】ⅰ. 与
与 可发生氧化还原反应,也可发生配位反应生成
可发生氧化还原反应,也可发生配位反应生成 。
。
ⅱ.淡黄色、可溶的 ,与
,与 共存时溶液显绿色。
共存时溶液显绿色。
ⅲ.硫氰 的性质与卤素单质相似。
的性质与卤素单质相似。
①步骤1溶液呈浅蓝绿色时,发生反应的离子方程式是_______ 。
②经x射线衍射实验检测,步骤3中白色不溶物为CuSCN,同时有液态硫氰 生成,该反应的离子方程式是
生成,该反应的离子方程式是_______ 。
(3)某同学针对步骤4中溶液颜色变红且白色浑浊物增多的现象,提出大胆假设:当反应体系中同时存在 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。并做实验验证该假设:
。并做实验验证该假设:
③操作1中现象产生的可能原因是_______ 。
④操作2主要目的是_______ 。
⑤由操作3可知该同学的假设正确。操作3中 被氧化为
被氧化为 反应的离子方程式是
反应的离子方程式是_______ ,已知该反应的平衡常数 ,请用平衡移动原理解释实验1中步骤4出现相关现象的原因
,请用平衡移动原理解释实验1中步骤4出现相关现象的原因_______ 。
⑥由实验可知,影响氧化还原反应发生的因素有_______ 。
(1)由
 固体配制
固体配制 溶液,下列图示仪器中不需要用到的有
溶液,下列图示仪器中不需要用到的有
(2)研究小组设计如表实验,并记录实验现象:
| 实验1 | 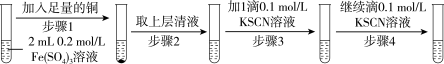 |
| 现象 | 步骤1:振荡试管后,溶液颜色呈浅蓝绿色 步骤3:溶液颜色变红,振荡试管,红色消失,并有白色沉淀产生 步骤4:溶液颜色变红,振荡试管,红色消失,白色沉淀增多 |
 与
与 可发生氧化还原反应,也可发生配位反应生成
可发生氧化还原反应,也可发生配位反应生成 。
。ⅱ.淡黄色、可溶的
 ,与
,与 共存时溶液显绿色。
共存时溶液显绿色。ⅲ.硫氰
 的性质与卤素单质相似。
的性质与卤素单质相似。①步骤1溶液呈浅蓝绿色时,发生反应的离子方程式是
②经x射线衍射实验检测,步骤3中白色不溶物为CuSCN,同时有液态硫氰
 生成,该反应的离子方程式是
生成,该反应的离子方程式是(3)某同学针对步骤4中溶液颜色变红且白色浑浊物增多的现象,提出大胆假设:当反应体系中同时存在
 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。并做实验验证该假设:
。并做实验验证该假设:| 实验2 | 操作1 | 操作2 | 操作3 |
 | 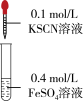 |  | |
| 现象 | 几分钟后,溶液颜色完全呈绿色。久置,溶液绿色变浅,试管底部有白色不溶物。 | 始终未见溶液颜色变红。 | 溶液颜色立刻变红,产生白色浑浊,振荡后红色消失。 |
④操作2主要目的是
⑤由操作3可知该同学的假设正确。操作3中
 被氧化为
被氧化为 反应的离子方程式是
反应的离子方程式是 ,请用平衡移动原理解释实验1中步骤4出现相关现象的原因
,请用平衡移动原理解释实验1中步骤4出现相关现象的原因⑥由实验可知,影响氧化还原反应发生的因素有
您最近一年使用:0次
2022-05-19更新
|
456次组卷
|
4卷引用:江西省赣州市2021-2022学年高三下学期3月摸底考试理综化学试题
江西省赣州市2021-2022学年高三下学期3月摸底考试理综化学试题 (已下线)押新高考卷16题 化学实验综合题-备战2022年高考化学临考题号押题(新高考通版)福建省泉州第五中学2021-2022学年学高三下学期化学期中考试化学试题(已下线)专题28 性质探究类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
名校
解题方法
9 . 探究化学反应的快慢和限度具有十分重要的意义。
I.某实验小组欲通过用酸性 和
和 (草酸)反应测定单位时间内生成
(草酸)反应测定单位时间内生成 的速率研究影响反应速率的因素,设计实验方案如下(
的速率研究影响反应速率的因素,设计实验方案如下( 溶液已酸化),实验装置如图甲所示:
溶液已酸化),实验装置如图甲所示:

(1)上述反应的离子方程式为:___________ ,该实验是探究___________ 对反应速率的影响。
(2)若实验①在2min末收集了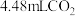 (标准状况下),则在2min末,
(标准状况下),则在2min末,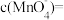
___________ mol/L(假设混合溶液的体积为50mL,反应前后体积变化忽略不计)。
(3)小组同学发现反应速率变化如图乙,其中 时间内速率变快的主要原因可能是:
时间内速率变快的主要原因可能是:___________ 。
Ⅱ.溶液中存在平衡 (橙色)
(橙色)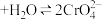 (黄色)
(黄色)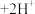 。用溶液进行下列实验:
。用溶液进行下列实验:

(4)向 溶液中加入
溶液中加入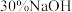 溶液,溶液呈
溶液,溶液呈___________ 色。向 溶液中逐滴加入
溶液中逐滴加入 溶液(已知
溶液(已知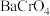 为黄色沉淀),则平衡向着
为黄色沉淀),则平衡向着___________ 方向移动,溶液颜色变化为___________ 。
(5)对比实验②和④可得出的结论是___________ 。
I.某实验小组欲通过用酸性
 和
和 (草酸)反应测定单位时间内生成
(草酸)反应测定单位时间内生成 的速率研究影响反应速率的因素,设计实验方案如下(
的速率研究影响反应速率的因素,设计实验方案如下( 溶液已酸化),实验装置如图甲所示:
溶液已酸化),实验装置如图甲所示:
| 实验序号 | A溶液 | B溶液 |
| ① | 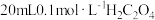 溶液 溶液 | 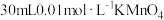 溶液 溶液 |
| ② | 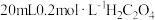 溶液 溶液 | 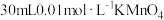 溶液 溶液 |
(2)若实验①在2min末收集了
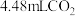 (标准状况下),则在2min末,
(标准状况下),则在2min末,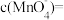
(3)小组同学发现反应速率变化如图乙,其中
 时间内速率变快的主要原因可能是:
时间内速率变快的主要原因可能是:Ⅱ.溶液中存在平衡
 (橙色)
(橙色)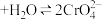 (黄色)
(黄色)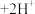 。用溶液进行下列实验:
。用溶液进行下列实验:
(4)向
 溶液中加入
溶液中加入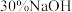 溶液,溶液呈
溶液,溶液呈 溶液中逐滴加入
溶液中逐滴加入 溶液(已知
溶液(已知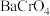 为黄色沉淀),则平衡向着
为黄色沉淀),则平衡向着(5)对比实验②和④可得出的结论是
您最近一年使用:0次
2021-12-21更新
|
272次组卷
|
2卷引用:江西省景德镇市乐平中学20222-2023学年高二上学期第一次月考化学试题
名校
10 . 探究化学反应的快慢和限度具有十分重要的意义。
Ⅰ.某实验小组欲通过用酸性KMnO4和H2C2O4(草酸)反应测定单位时间内生成CO2的速率研究影响反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:

(1)上述反应的离子方程式为:___ ,该实验探究的是___ 对化学反应速率的影响。
(2)若实验①在2min末收集了4.48mLCO2(标准状况下),则在2min末,c(MnO )=
)=____ mol·L-1(假设混合溶液的体积为50mL,反应前后体积变化忽略不计)。
(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定____ 来比较化学反应速率。
(4)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:___ 。
Ⅱ.K2Cr2O7溶液中存在平衡:Cr2O (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+。用K2Cr2O7溶液进行下列实验:
(黄色)+2H+。用K2Cr2O7溶液进行下列实验:

(5)向K2Cr2O7溶液中加入30%NaOH溶液,溶液呈____ 色,若再加入过量稀硫酸,则溶液呈____ 色。
(6)向K2Cr2O7溶液中逐滴加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡向着____ 方向移动,溶液颜色变化为___ 。对比实验②和④可得出的结论是___ 。
Ⅰ.某实验小组欲通过用酸性KMnO4和H2C2O4(草酸)反应测定单位时间内生成CO2的速率研究影响反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:

| 实验序号 | A溶液 | B溶液 |
| ① | 20mL0.1mol·L-1 H2C2O4溶液 | 30mL0.01mol·L-1 KMnO4溶液 |
| ② | 20mL0.2mol·L-1 H2C2O4溶液 | 30mL0.01mol·L-1 KMnO4溶液 |
(2)若实验①在2min末收集了4.48mLCO2(标准状况下),则在2min末,c(MnO
 )=
)=(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定
(4)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:
Ⅱ.K2Cr2O7溶液中存在平衡:Cr2O
 (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+。用K2Cr2O7溶液进行下列实验:
(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
(5)向K2Cr2O7溶液中加入30%NaOH溶液,溶液呈
(6)向K2Cr2O7溶液中逐滴加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡向着
您最近一年使用:0次
2021-09-30更新
|
430次组卷
|
3卷引用:江西省吉安市(吉安县三中、泰和二中、安福二中、井大附中 )2021-2022学年高二上学期9月联考化学试题



