名校
解题方法
1 . 研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:

已知:①+6价铬盐在一定条件下可被还原为 ,
, 在水溶液中为绿色:②微热
在水溶液中为绿色:②微热 溶液,黄色加深。
溶液,黄色加深。
(1) 溶液中存在的转化反应是
溶液中存在的转化反应是___________ (用离子方程式表示);b试管中加水后平衡___________ (填“正向”、“不”或“逆向”)移动,
___________ (填“增大”、“减小”或“不变”)。
(2)对比试管c和b,推测试管c的现象是___________ 。对比试管a和b,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是 增大影响的结果;乙认为橙色加深一定是
增大影响的结果;乙认为橙色加深一定是 增大对平衡的影响。你认为是否需要再设计实验证明
增大对平衡的影响。你认为是否需要再设计实验证明 对平衡的影响,并说明理由:
对平衡的影响,并说明理由:___________ 。
(3)分析试管c继续滴加 溶液和过量稀
溶液和过量稀 的实验现象,说明+6价铬盐氧化性
的实验现象,说明+6价铬盐氧化性
___________  (填“大于”、“小于”或“不确定”);此过程中氧化还原反应的离子方程式为
(填“大于”、“小于”或“不确定”);此过程中氧化还原反应的离子方程式为___________ 。

已知:①+6价铬盐在一定条件下可被还原为
 ,
, 在水溶液中为绿色:②微热
在水溶液中为绿色:②微热 溶液,黄色加深。
溶液,黄色加深。(1)
 溶液中存在的转化反应是
溶液中存在的转化反应是
(2)对比试管c和b,推测试管c的现象是
 增大影响的结果;乙认为橙色加深一定是
增大影响的结果;乙认为橙色加深一定是 增大对平衡的影响。你认为是否需要再设计实验证明
增大对平衡的影响。你认为是否需要再设计实验证明 对平衡的影响,并说明理由:
对平衡的影响,并说明理由:(3)分析试管c继续滴加
 溶液和过量稀
溶液和过量稀 的实验现象,说明+6价铬盐氧化性
的实验现象,说明+6价铬盐氧化性
 (填“大于”、“小于”或“不确定”);此过程中氧化还原反应的离子方程式为
(填“大于”、“小于”或“不确定”);此过程中氧化还原反应的离子方程式为
您最近一年使用:0次
名校
解题方法
2 . 现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的正反应为____ 热反应,且m+n____ p(填“>”、“=”或“<”)。
(2)若容积不变加入B,则A的转化率____ ,B的转化率____ 。(填“增大”、“减小”或“不变”,下同)
(3)若升高温度,则平衡时B、C的浓度之比 将
将____ 。
(4)若加入催化剂,平衡时气体混合物的总物质的量____ 。
(5)若B是有色物质,A、C均无色,体积不变、加入C时混合物颜色____ ;维持容器内压强不变,充入氖气时,混合物颜色____ 。(填“变深”、“变浅”或“不变”)
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:(1)该反应的正反应为
(2)若容积不变加入B,则A的转化率
(3)若升高温度,则平衡时B、C的浓度之比
 将
将(4)若加入催化剂,平衡时气体混合物的总物质的量
(5)若B是有色物质,A、C均无色,体积不变、加入C时混合物颜色
您最近一年使用:0次
2022-09-27更新
|
183次组卷
|
2卷引用:山西运城盐湖五中2022-2023学年高二上学期阶段性测试化学试题
名校
3 . 在密闭容器中进行如下反应:
 ,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。
,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。
(1)增加 ,则平衡
,则平衡___________ (填“逆向移动”“正向移动”或“不移动”,下同),
___________ (填“增大”“减小”或“不变”,下同)。
(2)保持温度不变,增大反应容器的容积,则平衡___________ ,
___________ 。
(3)保持反应容器的容积和温度不变,通入 ,则平衡
,则平衡___________ ,
___________ 。
(4)保持反应容器的容积不变,升高温度,则平衡___________ ,
___________ 。

 ,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。
,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。(1)增加
 ,则平衡
,则平衡
(2)保持温度不变,增大反应容器的容积,则平衡

(3)保持反应容器的容积和温度不变,通入
 ,则平衡
,则平衡
(4)保持反应容器的容积不变,升高温度,则平衡

您最近一年使用:0次
2021-10-23更新
|
101次组卷
|
6卷引用:山西省大同市平城中学校2021-2022学年高二上学期10月月考化学试卷
山西省大同市平城中学校2021-2022学年高二上学期10月月考化学试卷(已下线)2.3.2 温度变化对化学平衡的影响(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)(已下线)2.2.3 浓度、压强对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)安徽省六安市晓天中学2021-2022学年高二上学期期中测试化学试题云南省保山第一中学2022-2023学年高二下学期期末考试化学试题云南省昌宁县第一中学2022-2023学年高二下学期期末考试化学试题
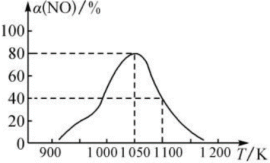
4 . 研究大气污染物和水污染物的处理对建设美丽中国具有重要意义。汽车尾气中的CO、NOx和碳氮化合物是大气污染物。科研工作者经过研究,可以用不同方法处理氮的氧化物﹐防止空气污染。回答下列问题:
(1)已知: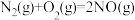



 能将NO转化成无毒物质。写出在298K时该反应的热化学方程式:
能将NO转化成无毒物质。写出在298K时该反应的热化学方程式:___________ 。
(2)我国科研人员研究出了用活性炭对汽车尾气中NO处理的方法: 。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,反应相同时间时,测得NO的转化率
。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,反应相同时间时,测得NO的转化率 (NO)随温度的变化关系如图所示:
(NO)随温度的变化关系如图所示:
由图可知,温度低于1050K时,NO的转化率随温度升高而增大,原因是___________ 。
(3)科研人员进一步对比研究了活性炭负载钙、镧氧化物的反应活性。在三个反应器中分别加入C、CaO/C、La2O3/C,通入NO使其浓度达到0.1mol/L。不同温度下,测得2小时时NO去除率如图所示:

①据图分析,490℃以下反应活化能最小的是___________ (用a、b、c表示);CaO/C、La2O3/C去除NO效果比C更好,其理由是___________ 。(写出一条即可)
②上述实验中,490℃时,若测得CaO/C对NO的去除率为60%,则可能采取的措施是___________ 。
A.恒容下,及时分离出 B.压缩体积 C.恒容下,向体系通入氮气
B.压缩体积 C.恒容下,向体系通入氮气
③490℃时的反应速率
___________  ,该温度下此反应的平衡常数为121,则反应达到平衡时NO的去除率为
,该温度下此反应的平衡常数为121,则反应达到平衡时NO的去除率为___________ (保留两位有效数字)。
(4)氮氧化物也可以用尿素[ ]水溶液吸收。用尿素水溶液吸收体积比为1∶1的NO和NO2混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为
]水溶液吸收。用尿素水溶液吸收体积比为1∶1的NO和NO2混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为___________ 。
(1)已知:
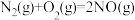



 能将NO转化成无毒物质。写出在298K时该反应的热化学方程式:
能将NO转化成无毒物质。写出在298K时该反应的热化学方程式:(2)我国科研人员研究出了用活性炭对汽车尾气中NO处理的方法:
 。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,反应相同时间时,测得NO的转化率
。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,反应相同时间时,测得NO的转化率 (NO)随温度的变化关系如图所示:
(NO)随温度的变化关系如图所示:
由图可知,温度低于1050K时,NO的转化率随温度升高而增大,原因是
(3)科研人员进一步对比研究了活性炭负载钙、镧氧化物的反应活性。在三个反应器中分别加入C、CaO/C、La2O3/C,通入NO使其浓度达到0.1mol/L。不同温度下,测得2小时时NO去除率如图所示:

①据图分析,490℃以下反应活化能最小的是
②上述实验中,490℃时,若测得CaO/C对NO的去除率为60%,则可能采取的措施是
A.恒容下,及时分离出
 B.压缩体积 C.恒容下,向体系通入氮气
B.压缩体积 C.恒容下,向体系通入氮气③490℃时的反应速率

 ,该温度下此反应的平衡常数为121,则反应达到平衡时NO的去除率为
,该温度下此反应的平衡常数为121,则反应达到平衡时NO的去除率为(4)氮氧化物也可以用尿素[
 ]水溶液吸收。用尿素水溶液吸收体积比为1∶1的NO和NO2混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为
]水溶液吸收。用尿素水溶液吸收体积比为1∶1的NO和NO2混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为
您最近一年使用:0次
5 . 碳酸钴( )是一种红色粉末,主要用作催化剂、选矿剂和陶瓷釉.以含钴废料 (主要成分为
)是一种红色粉末,主要用作催化剂、选矿剂和陶瓷釉.以含钴废料 (主要成分为 、
、 还含少量
还含少量 、Zn等杂质)为原料制备
、Zn等杂质)为原料制备 的一种工艺如下:
的一种工艺如下:

常温下,Ksp[Al(OH)3]≈1.0×10-34。
回答下列问题:
(1)“酸浸”前常将含钴废料粉碎,其主要目的是__________________ 。
(2)“还原”过程中还原 理论上需消耗
理论上需消耗 的体积为
的体积为___________ L(标准状况)。
(3)已知“萃取” 的原理为
的原理为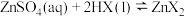 (有机层)
(有机层)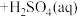 ,从有机层中获得
,从有机层中获得 溶液的操作是加入
溶液的操作是加入____________ (填试剂名称),其作用是__________________ (从平衡移动原理角度分析)。
(4)常温下“除铝”过程中,调节 为5.0时,溶液中c(Al3+)=
为5.0时,溶液中c(Al3+)=_____________ 。
(5)“沉钴”中,其他条件相同时, 产品纯度与
产品纯度与 溶液浓度、反应温度的关系如图所示,
溶液浓度、反应温度的关系如图所示,
__________ (填“>”或“<”) 。
。

 )是一种红色粉末,主要用作催化剂、选矿剂和陶瓷釉.以含钴废料 (主要成分为
)是一种红色粉末,主要用作催化剂、选矿剂和陶瓷釉.以含钴废料 (主要成分为 、
、 还含少量
还含少量 、Zn等杂质)为原料制备
、Zn等杂质)为原料制备 的一种工艺如下:
的一种工艺如下:
常温下,Ksp[Al(OH)3]≈1.0×10-34。
回答下列问题:
(1)“酸浸”前常将含钴废料粉碎,其主要目的是
(2)“还原”过程中还原
 理论上需消耗
理论上需消耗 的体积为
的体积为(3)已知“萃取”
 的原理为
的原理为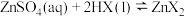 (有机层)
(有机层)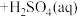 ,从有机层中获得
,从有机层中获得 溶液的操作是加入
溶液的操作是加入(4)常温下“除铝”过程中,调节
 为5.0时,溶液中c(Al3+)=
为5.0时,溶液中c(Al3+)=(5)“沉钴”中,其他条件相同时,
 产品纯度与
产品纯度与 溶液浓度、反应温度的关系如图所示,
溶液浓度、反应温度的关系如图所示,
 。
。
您最近一年使用:0次
2020-11-06更新
|
133次组卷
|
2卷引用:山西省怀仁市第一中学云东校区2020-2021学年高二上学期第三次月考化学试题
名校
6 . 合成氨是人类科学技术上的一项重大突破,其反应原理为: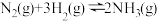 △H=-92.4kJ·L-1,一种工业合成氨的简易流程图如下:
△H=-92.4kJ·L-1,一种工业合成氨的简易流程图如下:
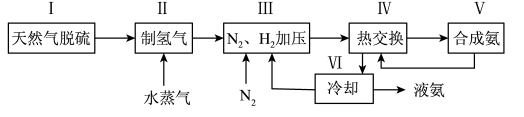
(1)步骤II中制氢气原理如下:
I.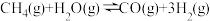 △H=+206.4kJ·L-1
△H=+206.4kJ·L-1
II. △H=-41.2kJ·L-1
△H=-41.2kJ·L-1
①对于反应I,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是____________________ 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应II,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为_______________ 。
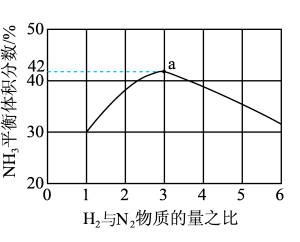
(2)图1表示500℃、60.0Mpa条件下,原料气投料比平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:________ 。
(3)上述流程图中,使合成氨气放出的能量得到充分利用的主要步骤是(填序号)________ 。简述本流程中提高合成氨原料总转化率的方法:_______________ 。
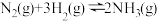 △H=-92.4kJ·L-1,一种工业合成氨的简易流程图如下:
△H=-92.4kJ·L-1,一种工业合成氨的简易流程图如下:
(1)步骤II中制氢气原理如下:
I.
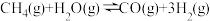 △H=+206.4kJ·L-1
△H=+206.4kJ·L-1II.
 △H=-41.2kJ·L-1
△H=-41.2kJ·L-1①对于反应I,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应II,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为
(2)图1表示500℃、60.0Mpa条件下,原料气投料比平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:

(3)上述流程图中,使合成氨气放出的能量得到充分利用的主要步骤是(填序号)
您最近一年使用:0次



