名校
解题方法
1 . 利用某矿渣(含 )制备
)制备 的工艺流程如下:
的工艺流程如下:

已知:① ;
;
②
 。
。
回答下列问题:
(1)为提高焙烧效率可采取的操作有___________ (至少写两条,温度改变除外)。
(2)“滤液”中 元素的主要存在形式为
元素的主要存在形式为 ,“焙烧”时
,“焙烧”时 发生反应的化学方程式为
发生反应的化学方程式为___________ ;“滤渣”的主要成分为___________ 。
(3)“调 ”后溶液中
”后溶液中 的浓度是
的浓度是 ,则
,则 的浓度是
的浓度是___________  。
。
(4)在“转化”过程中淀粉水解液起___________ 作用。
(5)室温下,加入石灰乳调节 ,当
,当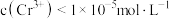 时,
时,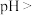
___________ 。
 )制备
)制备 的工艺流程如下:
的工艺流程如下:
已知:①
 ;
;②

 。
。回答下列问题:
(1)为提高焙烧效率可采取的操作有
(2)“滤液”中
 元素的主要存在形式为
元素的主要存在形式为 ,“焙烧”时
,“焙烧”时 发生反应的化学方程式为
发生反应的化学方程式为(3)“调
 ”后溶液中
”后溶液中 的浓度是
的浓度是 ,则
,则 的浓度是
的浓度是 。
。(4)在“转化”过程中淀粉水解液起
(5)室温下,加入石灰乳调节
 ,当
,当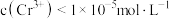 时,
时,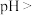
您最近一年使用:0次
2023-12-03更新
|
231次组卷
|
4卷引用:黑龙江省齐齐哈尔市2023-2024学年高二上学期1月期末化学试题
名校
解题方法
2 . 海洋是生命的摇篮,蕴藏着丰富的化学资源。回答下列问题:
(1)粗盐中可溶性杂质离子包含Mg2+、Ca2+、 。要除去这些杂质离子得到精盐水,加入试剂的顺序可为
。要除去这些杂质离子得到精盐水,加入试剂的顺序可为___________
A.BaCl2溶液、NaOH溶液、Na2CO3溶液、盐酸
B.NaOH溶液、Na2CO3溶液、BaCl2溶液、盐酸
C.BaCl2溶液、Na2CO3溶液、NaOH溶液、盐酸
制取 晶体的“结晶”操作为
晶体的“结晶”操作为___________
(2)从海带中提取碘的实验过程如下图所示:
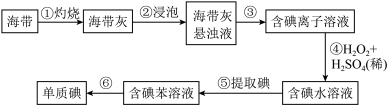
①灼烧海带时,应将海带放入___________ 中灼烧
A.烧杯 B.容量瓶 C.坩埚 D.锥形瓶
②请写出步骤④反应的离子方程式__________ 。
(3)海水显碱性,海水提溴过程中,先调其pH<3.5后,再通入氯气,调节海水pH可提高C12的利用率,用平衡原理解释其原因是___________ 。
(1)粗盐中可溶性杂质离子包含Mg2+、Ca2+、
 。要除去这些杂质离子得到精盐水,加入试剂的顺序可为
。要除去这些杂质离子得到精盐水,加入试剂的顺序可为A.BaCl2溶液、NaOH溶液、Na2CO3溶液、盐酸
B.NaOH溶液、Na2CO3溶液、BaCl2溶液、盐酸
C.BaCl2溶液、Na2CO3溶液、NaOH溶液、盐酸
制取
 晶体的“结晶”操作为
晶体的“结晶”操作为(2)从海带中提取碘的实验过程如下图所示:

①灼烧海带时,应将海带放入
A.烧杯 B.容量瓶 C.坩埚 D.锥形瓶
②请写出步骤④反应的离子方程式
(3)海水显碱性,海水提溴过程中,先调其pH<3.5后,再通入氯气,调节海水pH可提高C12的利用率,用平衡原理解释其原因是
您最近一年使用:0次
3 . 某小组同学探究铁离子与苯酚的反应。
已知:Fe3++6C6H5O [Fe(C6H5O)6]3;[Fe(C6H5O)6]3为紫色配合物。
[Fe(C6H5O)6]3;[Fe(C6H5O)6]3为紫色配合物。
(1)配制100mL0.1mol·L-1苯酚溶液,需要用到的玻璃仪器有:烧杯、玻璃棒、胶头滴管、___________ 。
(2)氯化铁溶液呈___________ (填“酸性”或“碱性”),用离子方程式表示原因___________ 。
(3)[Fe(C6H5O)6]3中,提供空轨道用以形成配位键的微粒是___________ 。
(4)进行如下实验。
实验1:

实验2:

【提出猜想】
i.Cl对铁离子与苯酚的反应有促进作用;
ii.SO 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。
①向实验2反应后溶液中加入___________ ,溶液颜色无变化,证明猜想i不成立。
②实验证明猜想ii成立,请写出实验操作和现象___________ 。
(5)实验证明,H+对Fe3+与苯酚反应生成的配合物有抑制作用,请从平衡角度结合化学用语进行解释___________ 。
(6)有同学提出,溶液pH越大,越利于铁离子与苯酚发生显色反应。你认为是否合理,并说明理由___________ 。
(7)由以上研究可知,影响铁离子与苯酚反应的因素有___________ 。
已知:Fe3++6C6H5O
 [Fe(C6H5O)6]3;[Fe(C6H5O)6]3为紫色配合物。
[Fe(C6H5O)6]3;[Fe(C6H5O)6]3为紫色配合物。(1)配制100mL0.1mol·L-1苯酚溶液,需要用到的玻璃仪器有:烧杯、玻璃棒、胶头滴管、
(2)氯化铁溶液呈
(3)[Fe(C6H5O)6]3中,提供空轨道用以形成配位键的微粒是
(4)进行如下实验。
实验1:

实验2:

【提出猜想】
i.Cl对铁离子与苯酚的反应有促进作用;
ii.SO
 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。①向实验2反应后溶液中加入
②实验证明猜想ii成立,请写出实验操作和现象
(5)实验证明,H+对Fe3+与苯酚反应生成的配合物有抑制作用,请从平衡角度结合化学用语进行解释
(6)有同学提出,溶液pH越大,越利于铁离子与苯酚发生显色反应。你认为是否合理,并说明理由
(7)由以上研究可知,影响铁离子与苯酚反应的因素有
您最近一年使用:0次
名校
解题方法
4 . 实验小组探究酸对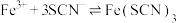 平衡的影响。将0.005mol/L
平衡的影响。将0.005mol/L  溶液(接近无色)和0.01mol/L KSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。
溶液(接近无色)和0.01mol/L KSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。
(1) 水解显酸性的原因是
水解显酸性的原因是_______ (用方程式表示)。
(2)甲同学认为加入酸后,会使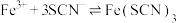 体系中
体系中_______ 浓度改变,导致该平衡正向移动,溶液颜色加深。
【设计并实施实验】
【查阅资料】
 和
和 、
、 均能发生络合反应:
均能发生络合反应:
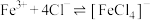 (黄色);
(黄色);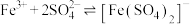 (无色)。
(无色)。
实验Ⅰ.探究现象a中溶液颜色变化的原因
(3)实验①的目的是_______ 。
(4)根据实验①和实验②的结果,从平衡移动角度解释现象a:_______ 。
实验Ⅱ.探究现象b中溶液呈浅黄色的原因
(5)结合实验③可推测现象b中使溶液呈浅黄色的微粒可能有两种,分别是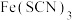 、
、_______ 。
(6)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒只是(5)中的一种,请将实验④的操作及现象补充完整:_______ 。
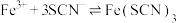 平衡的影响。将0.005mol/L
平衡的影响。将0.005mol/L  溶液(接近无色)和0.01mol/L KSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。
溶液(接近无色)和0.01mol/L KSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。(1)
 水解显酸性的原因是
水解显酸性的原因是(2)甲同学认为加入酸后,会使
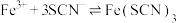 体系中
体系中【设计并实施实验】
 |  |
 和
和 、
、 均能发生络合反应:
均能发生络合反应: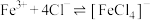 (黄色);
(黄色);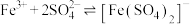 (无色)。
(无色)。实验Ⅰ.探究现象a中溶液颜色变化的原因
| 编号 | 操作 | 现象 |
| ① | 向2mL红色溶液中滴加5滴水 | 溶液颜色无明显变化 |
| ② | 向2mL红色溶液中滴加5滴3mol/L KCl溶液 | 溶液颜色变浅,呈橙色 |
(4)根据实验①和实验②的结果,从平衡移动角度解释现象a:
实验Ⅱ.探究现象b中溶液呈浅黄色的原因
| 编号 | 操作 | 现象 |
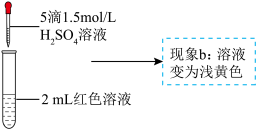
| ③ | 取1mL 0.0025mol/L  溶液(无色),加入1mL 0.01mol/L KSCN溶液,再加入5滴1.5mol/L 溶液(无色),加入1mL 0.01mol/L KSCN溶液,再加入5滴1.5mol/L  溶液 溶液 | 溶液先变红,加硫酸后变为浅黄色 |
| ④ | 取1mL 0.005mol/L  溶液, 溶液, |
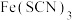 、
、(6)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒只是(5)中的一种,请将实验④的操作及现象补充完整:
您最近一年使用:0次
2023-07-01更新
|
192次组卷
|
2卷引用:北京市十一学校2022-2023学年高二下学期期末考试化学试题
5 . 甲基丙烯酸甲酯[ ]是有机玻璃的单体,其一种实验室制备方法如下:
]是有机玻璃的单体,其一种实验室制备方法如下:
Ⅰ.向 烧瓶中依次加入:
烧瓶中依次加入: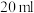 甲基丙烯酸、
甲基丙烯酸、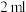 浓硫酸,冷却至室温,再加入
浓硫酸,冷却至室温,再加入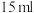 甲醇和几粒碎瓷片;
甲醇和几粒碎瓷片;
Ⅱ.按图示连接装置加热烧瓶中混合液,通过分水器分离出水,当分水器中水位不再增加时停止加热;冷却。
Ⅲ.纯化产品
粗产品依次用水洗、试剂Y溶液洗、水洗,在油层中加入无水硫酸镁,再经蒸馏得到较纯净的甲基丙烯酸甲酯17.6 g。
已知:
回答下列问题:
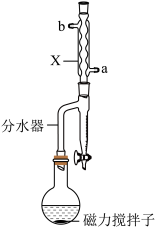
(1)图中仪器X的名称为___________ 。
(2)制备甲基丙烯酸甲酯的化学方程式为___________ 。
(3)每隔一段时间,打开油水分离器,将下层水放出来。从分水器中及时分离出水的目的是___________ 。
(4)纯化过程中,试剂Y是___________ ,其作用有___________ 。
(5)蒸馏提纯产品时温度应控制在___________ ℃。
(6)本实验中甲基丙烯酸甲酯的产率为___________ (保留三位有效数字)。
 ]是有机玻璃的单体,其一种实验室制备方法如下:
]是有机玻璃的单体,其一种实验室制备方法如下:Ⅰ.向
 烧瓶中依次加入:
烧瓶中依次加入: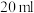 甲基丙烯酸、
甲基丙烯酸、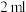 浓硫酸,冷却至室温,再加入
浓硫酸,冷却至室温,再加入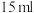 甲醇和几粒碎瓷片;
甲醇和几粒碎瓷片;Ⅱ.按图示连接装置加热烧瓶中混合液,通过分水器分离出水,当分水器中水位不再增加时停止加热;冷却。
Ⅲ.纯化产品
粗产品依次用水洗、试剂Y溶液洗、水洗,在油层中加入无水硫酸镁,再经蒸馏得到较纯净的甲基丙烯酸甲酯17.6 g。
已知:
| 药品 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度( ) ) | 相对分子质量 |
| 甲醇 | -98 | 64.5 | 与水混溶,易溶于有机溶剂 | 0.79 | 32 |
| 甲基丙烯酸 | 15 | 161 | 溶于热水,易溶于有机剂 | 1.01 | 86 |
| 甲基丙烯酸甲酯 | -48 | 100 | 微溶于水,易溶于有机溶剂 | 0.944 | 100 |

(1)图中仪器X的名称为
(2)制备甲基丙烯酸甲酯的化学方程式为
(3)每隔一段时间,打开油水分离器,将下层水放出来。从分水器中及时分离出水的目的是
(4)纯化过程中,试剂Y是
(5)蒸馏提纯产品时温度应控制在
(6)本实验中甲基丙烯酸甲酯的产率为
您最近一年使用:0次
名校
6 . 向 的含硫废水中加入适量
的含硫废水中加入适量 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图

(1) 水溶液中存在电离平衡
水溶液中存在电离平衡 和
和 。下列关于
。下列关于 溶液的说法正确的是_____
溶液的说法正确的是_____
(2) 时,溶液中硫元素的主要存在形态为
时,溶液中硫元素的主要存在形态为_____
(3)用化学平衡移动原理解释向 的含硫废水中加入
的含硫废水中加入 溶液后pH降低的原因:
溶液后pH降低的原因:_____ 。
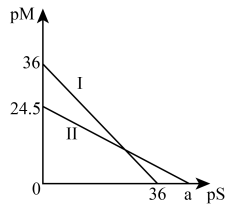
(4)某温度下,CuS和 饱和溶液中pS和pM的关系如图所示,其中
饱和溶液中pS和pM的关系如图所示,其中 ,
,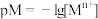 ,
, 为
为 或
或 ,下列说法错误的是____
,下列说法错误的是____
 的含硫废水中加入适量
的含硫废水中加入适量 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图
(1)
 水溶液中存在电离平衡
水溶液中存在电离平衡 和
和 。下列关于
。下列关于 溶液的说法正确的是_____
溶液的说法正确的是_____| A.滴加新制氯水,平衡向左移动,溶液pH减小 |
| B.加水,平衡向右移动,溶液中氢离子浓度增大 |
C.通入过量 气体,平衡向左移动,溶液pH增大 气体,平衡向左移动,溶液pH增大 |
| D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子的浓度都减小 |
 时,溶液中硫元素的主要存在形态为
时,溶液中硫元素的主要存在形态为(3)用化学平衡移动原理解释向
 的含硫废水中加入
的含硫废水中加入 溶液后pH降低的原因:
溶液后pH降低的原因:(4)某温度下,CuS和
 饱和溶液中pS和pM的关系如图所示,其中
饱和溶液中pS和pM的关系如图所示,其中 ,
,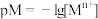 ,
, 为
为 或
或 ,下列说法错误的是____
,下列说法错误的是____
A.曲线Ⅱ代表的是 | B. |
C.此温度下CuS的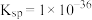 | D.此温度下的饱和溶液中 |
您最近一年使用:0次
名校
7 . 氮的氧化物(如 ,
, ,
, 等)应用很广,在一定条件下可以相互转化。
等)应用很广,在一定条件下可以相互转化。
(1)已知: 在一定条件下发生分解2N2O5(g)
在一定条件下发生分解2N2O5(g) 4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
设反应开始时体系压强为p0,第2.00min时体系压强为p,则p:p0=_______ ;
(2)①对于反应2N2O5(g) 4NO2(g)+O2(g)有人提出如下反应历程:
4NO2(g)+O2(g)有人提出如下反应历程:
第一步N2O5(g) NO2(g)+NO3(g) 快速平衡;
NO2(g)+NO3(g) 快速平衡;
第二步NO2(g)+NO3→NO+NO2+O2慢反应;
第三步NO+NO3→2NO2快反应
其中可近似认为第二步反应不影响第一步的平衡,一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,下列表述正确的是_______ 。
A.υ(第一步的逆反应)<υ(第二步反应)
B.反应的中间产物只有NO3
C.容器中压强不再变化能说明反应已达平衡
D.气体的密度保持不变能说明反应已达平衡
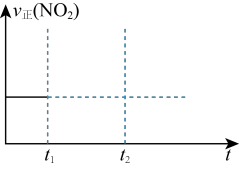
②对于反应2N2O5(g) 4NO2(g)+O2(g),在恒容密闭容器中反应达到平衡,t1时充入N2O5(g),t2时又达到平衡,在下图中画出υ正(NO2)随时间变化的趋势图
4NO2(g)+O2(g),在恒容密闭容器中反应达到平衡,t1时充入N2O5(g),t2时又达到平衡,在下图中画出υ正(NO2)随时间变化的趋势图_______ 。
(3)NO2存在如下平衡: ,在一定条件下
,在一定条件下 与
与 的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2);v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2);v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
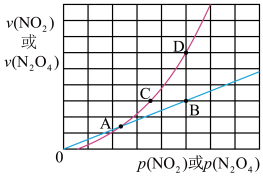
在图上标示的各点中,表示反应已达到平衡状态的点是___________ 。
(4) 、
、 和熔融
和熔融 可作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。请写出负极的电极反应方程式
可作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。请写出负极的电极反应方程式___________ 。

 ,
, ,
, 等)应用很广,在一定条件下可以相互转化。
等)应用很广,在一定条件下可以相互转化。(1)已知:
 在一定条件下发生分解2N2O5(g)
在一定条件下发生分解2N2O5(g) 4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/mol/L | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
(2)①对于反应2N2O5(g)
 4NO2(g)+O2(g)有人提出如下反应历程:
4NO2(g)+O2(g)有人提出如下反应历程:第一步N2O5(g)
 NO2(g)+NO3(g) 快速平衡;
NO2(g)+NO3(g) 快速平衡;第二步NO2(g)+NO3→NO+NO2+O2慢反应;
第三步NO+NO3→2NO2快反应
其中可近似认为第二步反应不影响第一步的平衡,一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,下列表述正确的是
A.υ(第一步的逆反应)<υ(第二步反应)
B.反应的中间产物只有NO3
C.容器中压强不再变化能说明反应已达平衡
D.气体的密度保持不变能说明反应已达平衡
②对于反应2N2O5(g)
 4NO2(g)+O2(g),在恒容密闭容器中反应达到平衡,t1时充入N2O5(g),t2时又达到平衡,在下图中画出υ正(NO2)随时间变化的趋势图
4NO2(g)+O2(g),在恒容密闭容器中反应达到平衡,t1时充入N2O5(g),t2时又达到平衡,在下图中画出υ正(NO2)随时间变化的趋势图
(3)NO2存在如下平衡:
 ,在一定条件下
,在一定条件下 与
与 的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2);v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2);v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
在图上标示的各点中,表示反应已达到平衡状态的点是
(4)
 、
、 和熔融
和熔融 可作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。请写出负极的电极反应方程式
可作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。请写出负极的电极反应方程式
您最近一年使用:0次
名校
8 . 硫酸亚铁晶体(FeSO4●7H2O)在医药上作补血剂。工业上用废铁生产FeSO4●7H2O的一种流程如图所示:
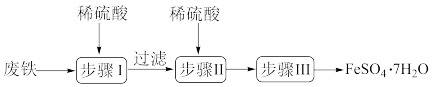
(1)步骤Ⅰ中除铁和硫酸、铁锈和硫酸反应外,还有一个反应的化学方程式为:___________ 。
(2)证明步骤I滤液中只含有 的方法:取样,先滴加
的方法:取样,先滴加___________ ,再滴加___________ (填试剂,名称),该过程的现象___________ 。
(3)步骤Ⅲ从硫酸亚铁溶液中获得硫酸亚铁晶体( )的实验操作为蒸发浓缩、冷却结晶、
)的实验操作为蒸发浓缩、冷却结晶、___________ 、冰水洗涤、烘干。烘干操作需在低温条件下进行,原因是:___________ 。
(4)将FeCl3和KSCN溶液混合,发生可逆反应: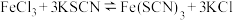 ,已知反应处于平衡状态中,现改变条件请回答下列问题:
,已知反应处于平衡状态中,现改变条件请回答下列问题:
向上述混合液中,若加入少量 固体后,混合溶液红色
固体后,混合溶液红色___________ ;若加入少量 粉后,混合溶液红色
粉后,混合溶液红色___________ ;若加入少量 固体后,混合溶液红色
固体后,混合溶液红色___________ ;若加入 溶液后,混合溶液红色
溶液后,混合溶液红色___________ 。(填“变深”、“变浅”或“不变”;注意,溶液中加入少量固体可以忽略体积变化)

(1)步骤Ⅰ中除铁和硫酸、铁锈和硫酸反应外,还有一个反应的化学方程式为:
(2)证明步骤I滤液中只含有
 的方法:取样,先滴加
的方法:取样,先滴加(3)步骤Ⅲ从硫酸亚铁溶液中获得硫酸亚铁晶体(
 )的实验操作为蒸发浓缩、冷却结晶、
)的实验操作为蒸发浓缩、冷却结晶、(4)将FeCl3和KSCN溶液混合,发生可逆反应:
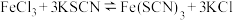 ,已知反应处于平衡状态中,现改变条件请回答下列问题:
,已知反应处于平衡状态中,现改变条件请回答下列问题:向上述混合液中,若加入少量
 固体后,混合溶液红色
固体后,混合溶液红色 粉后,混合溶液红色
粉后,混合溶液红色 固体后,混合溶液红色
固体后,混合溶液红色 溶液后,混合溶液红色
溶液后,混合溶液红色
您最近一年使用:0次
9 . 工业上用黄铜矿(主要成分是CuFeS2,还含有少量SiO2等)制备CuCl的工艺流程如图:
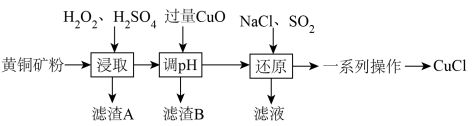
已知:①CuCl是一种难溶于水和乙醇的白色固体,在潮湿的空气中易水解氧化为碱式氯化铜Cu2(OH)3Cl。
(2)25℃时,Ksp[Cu(OH)2]=2.2×10-20、Ksp[Fe(OH)3]=1.0×10-38。
回答下列问题:
(1)“滤渣A”的主要成分是_______ (填化学式)。
(2)“浸取”时,H2O2的实际用量远远超过理论用量,可能原因是______ 。
(3)当溶液中离子浓度≤1.0×10-5mol•L-1时,可认为该离子已沉淀完全。加入CuO调pH,使溶液中Fe3+沉淀完全,此时,溶液中c(Cu2+)=0.22mol•L-1,则“调pH”的合理范围为_______ 。
(4)“还原”过程生成CuCl的离子方程式是_______ 。
(5)“一系列操作”是指:加入去氧水、过滤、用无水乙醇洗涤、真空干燥。加入去氧水的目的是______ 。
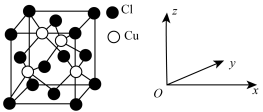
(6)①已知:CuCl的熔点为326℃,能升华,熔化呈液态时不导电。则CuCl晶体属于_______ (填晶体类型)。写出基态Cu+的核外电子排布式_______ 。
②原子坐标参数表示晶胞内部各原子的相对位置,图中 位置原子的坐标参数为(
位置原子的坐标参数为( ,
, ,
, ),则图中
),则图中 位置原子的坐标参数为
位置原子的坐标参数为_______ 。

已知:①CuCl是一种难溶于水和乙醇的白色固体,在潮湿的空气中易水解氧化为碱式氯化铜Cu2(OH)3Cl。
(2)25℃时,Ksp[Cu(OH)2]=2.2×10-20、Ksp[Fe(OH)3]=1.0×10-38。
回答下列问题:
(1)“滤渣A”的主要成分是
(2)“浸取”时,H2O2的实际用量远远超过理论用量,可能原因是
(3)当溶液中离子浓度≤1.0×10-5mol•L-1时,可认为该离子已沉淀完全。加入CuO调pH,使溶液中Fe3+沉淀完全,此时,溶液中c(Cu2+)=0.22mol•L-1,则“调pH”的合理范围为
(4)“还原”过程生成CuCl的离子方程式是
(5)“一系列操作”是指:加入去氧水、过滤、用无水乙醇洗涤、真空干燥。加入去氧水的目的是
(6)①已知:CuCl的熔点为326℃,能升华,熔化呈液态时不导电。则CuCl晶体属于
②原子坐标参数表示晶胞内部各原子的相对位置,图中
 位置原子的坐标参数为(
位置原子的坐标参数为( ,
, ,
, ),则图中
),则图中 位置原子的坐标参数为
位置原子的坐标参数为
您最近一年使用:0次
名校
10 . 某小组探究含Cr元素的化合物间的转化,进行如下实验。
资料:
i.含Cr元素的常见粒子: (橙色)、
(橙色)、 (黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、
(黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、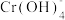 (亮绿色)。
(亮绿色)。
ii.H2O2在碱性环境中比在酸性环境中分解速率快。
iii.在碱性环境中,O2不能氧化+3价铬元素。
实验操作及现象如表:
(1)已知 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:
(黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:_____ 。
(2)I中,溶液由橙色变为绿色的总反应的离子方程式是_____ 。
(3)Ⅱ中,继续滴入NaOH溶液后,又有气泡生成的原因是_____ 。
(4)Ⅱ中,继续滴入NaOH溶液后,预测有Cr(OH)3沉淀生成,但实验时未观察到。
提出假设:在碱性环境中,+3价铬元素被H2O2氧化。
①甲同学设计实验证明假设成立:
取少量I中的绿色溶液,在滴入NaOH溶液前增加一步操作:______ 。然后滴入NaOH溶液,有蓝灰色沉淀生成,继续滴入NaOH溶液,沉淀溶解,溶液变为______ 色。
②乙同学进一步研究碱性环境对+3价铬元素的还原性或H2O2的氧化性的影响,设计如图实验。
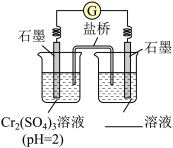
右侧烧杯的溶液中,氧化剂是_____ 。
开始时灵敏电流计指针不偏转,分别继续进行如下实验。
i.向左侧烧杯中滴入NaOH溶液,出现蓝灰色沉淀,继续缓慢滴入NaOH溶液,灵敏电流计指针向右偏转(电子从左向右运动),此时左侧的电极反应式为_____ 。
ii.向右侧烧杯中滴入NaOH溶液,有微小气泡生成,灵敏电流计指针向左偏转,左侧无明显变化。此时原电池中的总反应的化学方程式为_____ 。
(5)由上述实验, 与H2O2、
与H2O2、 与H2O2的氧化性强弱(填“>”或“<”):
与H2O2的氧化性强弱(填“>”或“<”):
酸性条件下,
_____ H2O2;碱性条件下, 
_____ H2O2。
资料:
i.含Cr元素的常见粒子:
 (橙色)、
(橙色)、 (黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、
(黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、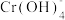 (亮绿色)。
(亮绿色)。ii.H2O2在碱性环境中比在酸性环境中分解速率快。
iii.在碱性环境中,O2不能氧化+3价铬元素。
实验操作及现象如表:
| 装置 | 步骤 | 操作 | 现象 |
 2mL0.0125mol•L-1K2Cr2O7溶液 | I | 先滴入稀硫酸至pH≈2,再滴入5滴5%H2O2溶液,振荡 | 溶液橙色加深。滴入H2O2溶液后迅速变为蓝紫色,有气泡生成。稍后,无明显气泡时,溶液由蓝紫色完全变为绿色 |
| Ⅱ | 继续缓慢滴入10滴2mol•L-1NaOH溶液,边滴,边振荡 | 又有气泡生成,溶液最终变为黄色 |
 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:
(黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:(2)I中,溶液由橙色变为绿色的总反应的离子方程式是
(3)Ⅱ中,继续滴入NaOH溶液后,又有气泡生成的原因是
(4)Ⅱ中,继续滴入NaOH溶液后,预测有Cr(OH)3沉淀生成,但实验时未观察到。
提出假设:在碱性环境中,+3价铬元素被H2O2氧化。
①甲同学设计实验证明假设成立:
取少量I中的绿色溶液,在滴入NaOH溶液前增加一步操作:
②乙同学进一步研究碱性环境对+3价铬元素的还原性或H2O2的氧化性的影响,设计如图实验。

右侧烧杯的溶液中,氧化剂是
开始时灵敏电流计指针不偏转,分别继续进行如下实验。
i.向左侧烧杯中滴入NaOH溶液,出现蓝灰色沉淀,继续缓慢滴入NaOH溶液,灵敏电流计指针向右偏转(电子从左向右运动),此时左侧的电极反应式为
ii.向右侧烧杯中滴入NaOH溶液,有微小气泡生成,灵敏电流计指针向左偏转,左侧无明显变化。此时原电池中的总反应的化学方程式为
(5)由上述实验,
 与H2O2、
与H2O2、 与H2O2的氧化性强弱(填“>”或“<”):
与H2O2的氧化性强弱(填“>”或“<”):酸性条件下,


您最近一年使用:0次
2023-01-07更新
|
406次组卷
|
4卷引用:北京市西城区2022-2023学年高二上学期1月期末考试化学试题



