1 . 下列实验方案不能达到实验目的是
| 选项 | 实验目的 | 实验方案 |
| A | 测定铝箔中氧化铝的含量 | 取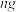 铝箔与足量稀盐酸充分反应,逸出气体用排水法收集,测其体积为 铝箔与足量稀盐酸充分反应,逸出气体用排水法收集,测其体积为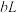 (已转化为标准状况下) (已转化为标准状况下) |
| B | 比较醋酸与硼酸的酸性强弱 | 分别向 醋酸和饱和硼酸溶液中加等浓度碳酸氢钠溶液,观察现象,前者生成气体而后者不能 醋酸和饱和硼酸溶液中加等浓度碳酸氢钠溶液,观察现象,前者生成气体而后者不能 |
| C | 验证 可用于制备防火剂 可用于制备防火剂 | 取滤纸条放入 饱和溶液中,吸浸后,稍沥干,放置在酒精灯外焰处,观察现象 饱和溶液中,吸浸后,稍沥干,放置在酒精灯外焰处,观察现象 |
| D | 证明溶液中存在平衡: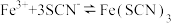 | 向盛有 溶液中加入 溶液中加入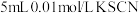 溶液,再继续加入少量 溶液,再继续加入少量 固体,观察现象 固体,观察现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 硫酰氯(SO2Cl2)可用于有机合成和药物制造等。实验室利用SO2和Cl2在活性炭作用下制取SO2Cl2[SO2(g)+Cl2(g) SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
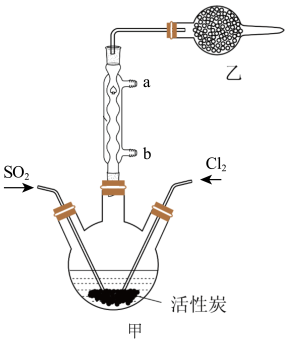
I.SO2Cl2的制备
(1)水应从___ (选填“a”或“b”)口进入。
(2)制取SO2的最佳组合是___ (填标号)。
①Fe+18.4mol/LH2SO4
②Na2SO3+70%H2SO4
③Na2SO3+3mo/LHNO3
(3)乙装置中盛放的试剂是___ 。
(4)制备过程中需要将装置甲置于冰水浴中,原因是___ 。
(5)反应结束后,分离甲中混合物的最佳实验操作是___ 。
II.测定产品中SO2Cl2的含量,实验步骤如下:
①取1.5g产品加入足量Ba(OH)2溶液,充分振荡、过滤、洗涤,将所得溶液均放入锥形瓶中;
②向锥形瓶中加入硝酸酸化,再加入0.2000mol·L-1的AgNO3溶液l00.00mL;
③向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
④加入NH4Fe(SO4)2指示剂,用0.1000mol·L-1NH4SCN溶液滴定过量Ag+,终点所用体积为10.00mL。
已知:Ksp(AgCl)=3.2×10-10 Ksp(AgSCN)=2×10-12
(6)滴定终点的现象为___ 。
(7)产品中SO2Cl2的质量分数为___ %,若步骤③不加入硝基苯则所测SO2Cl2含量将___ (填“偏高”、“偏低”或“无影响”)。
 SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
I.SO2Cl2的制备
(1)水应从
(2)制取SO2的最佳组合是
①Fe+18.4mol/LH2SO4
②Na2SO3+70%H2SO4
③Na2SO3+3mo/LHNO3
(3)乙装置中盛放的试剂是
(4)制备过程中需要将装置甲置于冰水浴中,原因是
(5)反应结束后,分离甲中混合物的最佳实验操作是
II.测定产品中SO2Cl2的含量,实验步骤如下:
①取1.5g产品加入足量Ba(OH)2溶液,充分振荡、过滤、洗涤,将所得溶液均放入锥形瓶中;
②向锥形瓶中加入硝酸酸化,再加入0.2000mol·L-1的AgNO3溶液l00.00mL;
③向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
④加入NH4Fe(SO4)2指示剂,用0.1000mol·L-1NH4SCN溶液滴定过量Ag+,终点所用体积为10.00mL。
已知:Ksp(AgCl)=3.2×10-10 Ksp(AgSCN)=2×10-12
(6)滴定终点的现象为
(7)产品中SO2Cl2的质量分数为
您最近一年使用:0次
2019-12-10更新
|
482次组卷
|
3卷引用:2019年四川省泸州市高三第一次教学质量检测理综化学试题
名校
3 . 氯化铁(FeCl3)是一种黑棕色结晶,易升华,易溶于水并且有强烈的吸水性。实验室制备无水氯化铁并探究氯化铁的相关实验如下。
I.利用MnO2粉末、浓盐酸、还原铁粉制备无水氯化铁
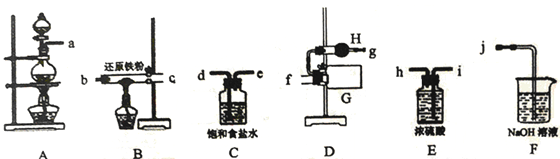
(1)写出装置A中发生的离子方程式_______ 。
(2)整套实验装置接口的连接顺序是_______ ,仪器H的名称是_______ 。
(3)当出现_______ 实验现象时,再点燃B处的酒精灯。
II.探究FeCl3的相关性质
(4)将G中所得固体进行相关实验,完成下列实验,回答问题。
Ⅲ.探究FeCl3与KSCN溶液的反应
(5)向试管中滴加5mL0.01mol/LKSCN溶液,再滴加5mL0.005mol/L FeCl3,溶液显红色,发生反应:Fe3+(aq)+3SCN-(aq)⇌Fe(SCN)3(aq)。将该红色溶液分成2份,分别装于A、B三支试管中,分别完成下列实验。
I.利用MnO2粉末、浓盐酸、还原铁粉制备无水氯化铁

(1)写出装置A中发生的离子方程式
(2)整套实验装置接口的连接顺序是
(3)当出现
II.探究FeCl3的相关性质
(4)将G中所得固体进行相关实验,完成下列实验,回答问题。
| 序号 | 实验操作 | 实验现象 | 问题或结论 |
| ① | 取少量G中固体置于烧杯中,加入适量蒸馏水,搅拌,溶解 | 溶液显浑浊,经过处理,得到澄清溶液。 | 该“处理”的操作是① |
| ② | 取少量①中的澄清溶液于试管中,滴加2滴② | 无明显现象 | 证明原固体中不含FeCl2, 原固体是FeCl3固体 |
| ③ | 将SO2气体通入BaCl2溶液中,再滴入①中的澄清溶液 | 开始无明显现象,后来有白色沉淀生成 | FeCl3表现出③ |
| ④ | 将①中的澄清溶液滴入刚刚做完银镜反应实验的试管中,振荡 | 银镜溶解,溶液显浑浊 | 相关离子方程式是④ |
(5)向试管中滴加5mL0.01mol/LKSCN溶液,再滴加5mL0.005mol/L FeCl3,溶液显红色,发生反应:Fe3+(aq)+3SCN-(aq)⇌Fe(SCN)3(aq)。将该红色溶液分成2份,分别装于A、B三支试管中,分别完成下列实验。
| 序号 | 实验操作 | 实验现象 | 给出合理的解释 |
| ① | 向A试管中滴加5滴1 mol/L KSCN溶液 | 红色溶液变为血红色 | |
| ② | 向B试管中加入lgKCl固体(足量,溶液体积变化忽略不计),振荡,静置 | 固体未完全溶解,红色溶液变浅(接近无色) |
您最近一年使用:0次
解题方法
4 . 下列实验中能达到预期实验目的的是
实验操作 | 预期实验目的 | |
A | 分别加热Fe2(SO4)3溶液和FeCl3溶液 | 得到Fe2(SO4)3和FeCl3固体 |
B | 在室温下分别向2支盛有4.0mL浓度为0.01mol/LKMnO4溶液的试管中同时加入2.0mL浓度分别为0.10mol/L和0.20mol/L的H2C2O4溶液,观察实验现象 | 探究浓度对化学反应速率的影响 |
C | 向盛有5.0mL0.005mol/LFeCl3溶液中加入5.0mL0.01mol/LKSCN溶液,再继续加入少量KCl固体 | 证明溶液中存在平衡:Fe3++3SCN-⇌Fe(SCN)3 |
D | 用玻璃棒蘸取少量0.1mol/LNaClO溶液,滴在pH试纸上 | 测定0.1mol/LNaClO溶液的pH |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
5 . 根据下列实验设计,回答问题:
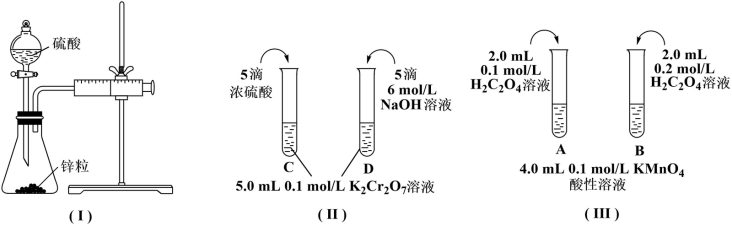
(1)利用实验(Ⅰ)探究锌与0.1mol/L硫酸和2mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):___ 。
(2)实验(Ⅱ)探究浓度对化学化学平衡的影响。
已知:Cr2O (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+推测D试管中实验现象为
(黄色)+2H+推测D试管中实验现象为___ ,用平衡移动原理解释原因:___ 。
(3)实验(Ⅲ)目的是探究浓度对反应速率的影响,实验中反应离子方程式为___ ,推测该实验设计___ (填“能”或“不能”)达到实验目的,判断理由是___ 。
(4)某小组也用酸性KMnO4溶液和草酸(H2C2O4)溶液进行实验,实验操作及现象如下表:
①由实验ⅰ、实验ⅱ可得出的结论是___ 。
②关于实验ⅱ中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的Mn2+对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
提供的试剂:0.01mol/L酸性KMnO4溶液,0.1mol/L草酸溶液,3mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水。
补全实验ⅲ的操作:向试管中先加入5mL0.01mol/L酸性KMnO4溶液,___ ,最后加入5mL0.1mol/L草酸溶液。

(1)利用实验(Ⅰ)探究锌与0.1mol/L硫酸和2mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(写出1项):
(2)实验(Ⅱ)探究浓度对化学化学平衡的影响。
已知:Cr2O
 (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+推测D试管中实验现象为
(黄色)+2H+推测D试管中实验现象为(3)实验(Ⅲ)目的是探究浓度对反应速率的影响,实验中反应离子方程式为
(4)某小组也用酸性KMnO4溶液和草酸(H2C2O4)溶液进行实验,实验操作及现象如下表:
| 编号 | 实验操作 | 实验现象 |
| ⅰ | 向一支试管中先加入5mL0.01mol/L酸性KMnO4溶液,再加入1滴3mol/L硫酸和9滴蒸馏水,最后加入5mL0.1mol/L草酸溶液 | 前10min内溶液紫色无明显变化,后颜色逐渐变浅,30min后几乎变为无色 |
| ⅱ | 向另一支试管中先加入5mL0.01mol/L酸性KMnO4溶液,再加入10滴3mol/L硫酸,最后加入5mL0.1mol/L草酸溶液 | 80s内溶液紫色无明显变化,后颜色迅速变浅,约150s后几乎变为无色 |
②关于实验ⅱ中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的Mn2+对反应有催化作用。利用提供的试剂设计实验ⅲ,验证猜想。
提供的试剂:0.01mol/L酸性KMnO4溶液,0.1mol/L草酸溶液,3mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水。
补全实验ⅲ的操作:向试管中先加入5mL0.01mol/L酸性KMnO4溶液,
您最近一年使用:0次
解题方法
6 . 为达到相应实验目的,下列实验设计可行的是
| 编号 | 实验目的 | 实验过程 |
| A | 探究浓度对化学平衡移动的影响 | 向盛有 5 mL 0. 1 mol/ L K2Cr2O7溶液的试管中滴入 5~15滴浓硫酸,振荡 |
| B | 观察 Fe(OH)2颜色 | 向盛有FeSO4溶液的试管中滴入氨水,立即振荡 |
| C | 检验K+ | 用玻璃棒蘸取待测液在无色火焰上灼烧,观察现象 |
| D | 探究浓度对反应速率的影响 | 向 2 支盛有 2 mL 0. 01 mol/ L H2C2O4溶液的试管中分别加入4mL 0.01mol/ L 和0. 02 mol/ L KMnO4溶液,观察现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-11-12更新
|
394次组卷
|
4卷引用:四川省成都市2019-2020学年高二下学期期末摸底考试化学试题
四川省成都市2019-2020学年高二下学期期末摸底考试化学试题(已下线)2.3.1 浓度对化学平衡的影响(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)四川省宜宾市叙州区第二中学校2021届高三上学期阶段一考试理综化学试题浙江杭州师范大学附属实验学校2020-2021学年高二12月测试化学试题
名校
7 . 为探究浓度对化学平衡的影响,某同学进行如下实验:下列说法不正确 的是
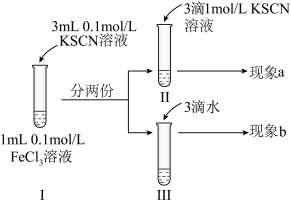

| A.该实验通过观察颜色变化以判断生成物浓度的变化 |
| B.观察到现象a比现象b中红色更深,即可证明增加反应物浓度,平衡正向移动 |
| C.进行II、III对比实验的主要目的是防止由于溶液体积变化引起各离子浓度变化而干扰实验结论得出 |
| D.若I中加入KSCN溶液的体积改为2mL也可以达到实验目的 |
您最近一年使用:0次
2020-07-09更新
|
270次组卷
|
7卷引用:北京市延庆区2019-2020学年高二下学期期末考试化学试题
北京市延庆区2019-2020学年高二下学期期末考试化学试题(已下线)第19讲 化学平衡 (练) — 2022年高考化学一轮复习讲练测(新教材新高考)湖南省长沙市长郡中学2021-2022学年高二上学期第一次月考化学试题(已下线)考向22 化学平衡状态 化学平衡的移动-备战2022年高考化学一轮复习考点微专题(已下线)第19讲 化学平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)河南省商丘名校联盟2022-2023学年高二上学期期中考试化学试题河南省兰考县第一高级中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
8 . 下列装置及设计能达到实验目的的是
A.测定中和热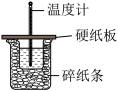 |
B.向外拉动注射器的活塞,检查装置是否漏气 |
C.探究浓度对化学平衡的影响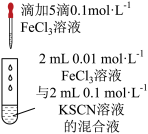 |
D.组装铜银原电池 |
您最近一年使用:0次
2020-11-05更新
|
293次组卷
|
5卷引用:湖北省四地六校2020-2021学年高二上学期联合考试化学试题
名校
解题方法
9 . 为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究“2Fe3++2I- 2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如图1:
2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如图1:

(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到___________ 。
(2)iii是ii的对比试验,目的是排除有ii中___________ 造成的影响。
(3)i和ii的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。用化学平衡移动原理解释i颜色变化原因:___________ 。
(4)根据氧化还原反应的规律,该同学推测i中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致I-的还原性弱于Fe2+,用图2装置(a、b均为石墨电极)进行实验验证。
①K闭合时,指针向右偏转,b作___________ 极。
②当指针归零(反应达到平衡)后,向U形管左管滴加0.01 mol/L AgNO3溶液,产生的现象证实了其推测,该现象是___________ 。
(5)按照(4)的原理,该同学用上图装置进行实验,证实了ii中Fe2+向Fe3+转化的原因,转化原因是___________ 。
(6)实验I中,还原性:I->Fe2+;而实验II中,还原性:Fe2+>I-,将(3)和(4)、(5)作对比,得出的结论是___________ 。
 2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如图1:
2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如图1:
(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到
(2)iii是ii的对比试验,目的是排除有ii中
(3)i和ii的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。用化学平衡移动原理解释i颜色变化原因:
(4)根据氧化还原反应的规律,该同学推测i中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致I-的还原性弱于Fe2+,用图2装置(a、b均为石墨电极)进行实验验证。
①K闭合时,指针向右偏转,b作
②当指针归零(反应达到平衡)后,向U形管左管滴加0.01 mol/L AgNO3溶液,产生的现象证实了其推测,该现象是
(5)按照(4)的原理,该同学用上图装置进行实验,证实了ii中Fe2+向Fe3+转化的原因,转化原因是
(6)实验I中,还原性:I->Fe2+;而实验II中,还原性:Fe2+>I-,将(3)和(4)、(5)作对比,得出的结论是
您最近一年使用:0次
名校
10 . 进入实验室后,一切行动听指挥。不听老师指挥或者不听课的同学就容易做错这一题。下列实验设计或实验现象描述正确的是
①水溶液中,K2Cr2O7存在以下平衡:Cr2O +H2O
+H2O CrO
CrO +2H+,加入2-3滴NaOH溶液,溶液变黄
+2H+,加入2-3滴NaOH溶液,溶液变黄
②探究温度对反应速率的影响:在两支试管中分别混合等体积、同浓度的Na2S2O3溶液和稀硫酸,一支放在热水中,另一支放在冰水中,观察出现浑浊的先后
③[Cu(H2O)4]2+(蓝色)+4C1- [CuCl4]2-(黄色)+4H2OΔH>0,升高温度,溶液由蓝色变成黄色
[CuCl4]2-(黄色)+4H2OΔH>0,升高温度,溶液由蓝色变成黄色
④把装有NO2与N2O4混合气体的平衡球一端置于冷水,一端置于热水中,置于冷水中的颜色更深
⑤实验室用足量的Zn和稀硫酸反应制备H2,加入几滴CuSO4溶液,反应速率加快,产生H2的量不变
①水溶液中,K2Cr2O7存在以下平衡:Cr2O
 +H2O
+H2O CrO
CrO +2H+,加入2-3滴NaOH溶液,溶液变黄
+2H+,加入2-3滴NaOH溶液,溶液变黄②探究温度对反应速率的影响:在两支试管中分别混合等体积、同浓度的Na2S2O3溶液和稀硫酸,一支放在热水中,另一支放在冰水中,观察出现浑浊的先后
③[Cu(H2O)4]2+(蓝色)+4C1-
 [CuCl4]2-(黄色)+4H2OΔH>0,升高温度,溶液由蓝色变成黄色
[CuCl4]2-(黄色)+4H2OΔH>0,升高温度,溶液由蓝色变成黄色④把装有NO2与N2O4混合气体的平衡球一端置于冷水,一端置于热水中,置于冷水中的颜色更深
⑤实验室用足量的Zn和稀硫酸反应制备H2,加入几滴CuSO4溶液,反应速率加快,产生H2的量不变
| A.②④⑤ | B.②③⑤ | C.①⑤ | D.①②④ |
您最近一年使用:0次



