1 . 合成氨工艺的一个重要工序是铜洗,其目的是用铜液 醋酸二氨合铜
醋酸二氨合铜 Ⅰ
Ⅰ ,氨水
,氨水 吸收在生产过程中产生的CO和
吸收在生产过程中产生的CO和 等气体,铜液吸收CO的反应是放热反应,其反应方程式为:
等气体,铜液吸收CO的反应是放热反应,其反应方程式为: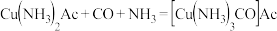 ; 完成下列填空:
; 完成下列填空:
 如果要提高上述反应的反应速率,可以采取的措施是
如果要提高上述反应的反应速率,可以采取的措施是 ______  选填编号
选填编号
 减压
减压  增加
增加 的浓度
的浓度  升温
升温  及时移走产物
及时移走产物
 铜液中的氨可吸收二氧化碳,写出该反应的化学方程式:
铜液中的氨可吸收二氧化碳,写出该反应的化学方程式: ______
 简述铜液吸收CO及铜液再生的操作步骤
简述铜液吸收CO及铜液再生的操作步骤 注明吸收和再生的条件
注明吸收和再生的条件 .
.______
 铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为
铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为 ______ 通过比较 ______ 可判断氮、磷两种元素的非金属性强弱.
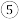 已知
已知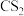 与
与 分子结构相似,
分子结构相似,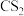 的电子式是
的电子式是 ______ 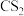 熔点高于
熔点高于 ,其原因是
,其原因是 ______
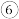 提取的
提取的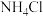 中含少量
中含少量 、SO
、SO 。将产品溶解,加入
。将产品溶解,加入 ,加热至沸,再加入
,加热至沸,再加入 溶液,过滤,蒸发结晶,得到工业氯化铵.加热至沸的目的是
溶液,过滤,蒸发结晶,得到工业氯化铵.加热至沸的目的是 ______ 。滤渣的主要成分是 ______ 、 ______ .
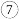 称取
称取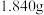 小苏打样品
小苏打样品 含少量
含少量 ,配置成250mL溶液,取
,配置成250mL溶液,取 用
用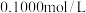 盐酸滴定,消耗盐酸
盐酸滴定,消耗盐酸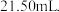 实验中所需的定量仪器出滴定管外,还有
实验中所需的定量仪器出滴定管外,还有 ______ 。选甲基橙而不选酚酞作为指示剂的原因是 ______  样品中
样品中 质量分数为
质量分数为 ______ 。( 保留3位小数)
 将一定量小苏打样品
将一定量小苏打样品 含少量
含少量 溶于足量盐酸,蒸干后称量固体质量,也可测量小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果
溶于足量盐酸,蒸干后称量固体质量,也可测量小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果 ______ 。(选填“偏高”、“偏低”或“不受影响”)
 醋酸二氨合铜
醋酸二氨合铜 Ⅰ
Ⅰ ,氨水
,氨水 吸收在生产过程中产生的CO和
吸收在生产过程中产生的CO和 等气体,铜液吸收CO的反应是放热反应,其反应方程式为:
等气体,铜液吸收CO的反应是放热反应,其反应方程式为: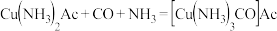 ; 完成下列填空:
; 完成下列填空:  如果要提高上述反应的反应速率,可以采取的措施是
如果要提高上述反应的反应速率,可以采取的措施是  选填编号
选填编号
 减压
减压  增加
增加 的浓度
的浓度  升温
升温  及时移走产物
及时移走产物  铜液中的氨可吸收二氧化碳,写出该反应的化学方程式:
铜液中的氨可吸收二氧化碳,写出该反应的化学方程式:  简述铜液吸收CO及铜液再生的操作步骤
简述铜液吸收CO及铜液再生的操作步骤 注明吸收和再生的条件
注明吸收和再生的条件 .
. 铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为
铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为  已知
已知 与
与 分子结构相似,
分子结构相似,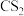 的电子式是
的电子式是 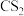 熔点高于
熔点高于 ,其原因是
,其原因是 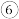 提取的
提取的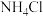 中含少量
中含少量 、SO
、SO 。将产品溶解,加入
。将产品溶解,加入 ,加热至沸,再加入
,加热至沸,再加入 溶液,过滤,蒸发结晶,得到工业氯化铵.加热至沸的目的是
溶液,过滤,蒸发结晶,得到工业氯化铵.加热至沸的目的是 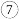 称取
称取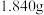 小苏打样品
小苏打样品 含少量
含少量 ,配置成250mL溶液,取
,配置成250mL溶液,取 用
用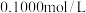 盐酸滴定,消耗盐酸
盐酸滴定,消耗盐酸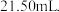 实验中所需的定量仪器出滴定管外,还有
实验中所需的定量仪器出滴定管外,还有  样品中
样品中 质量分数为
质量分数为  将一定量小苏打样品
将一定量小苏打样品 含少量
含少量 溶于足量盐酸,蒸干后称量固体质量,也可测量小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果
溶于足量盐酸,蒸干后称量固体质量,也可测量小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果
您最近一年使用:0次
2019-12-27更新
|
148次组卷
|
2卷引用:2019年秋高三化学复习强化练习—— 酸碱中和滴定
名校
2 . 硫酰氯(SO2Cl2)可用于有机合成和药物制造等。实验室利用SO2和Cl2在活性炭作用下制取SO2Cl2[SO2(g)+Cl2(g) SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
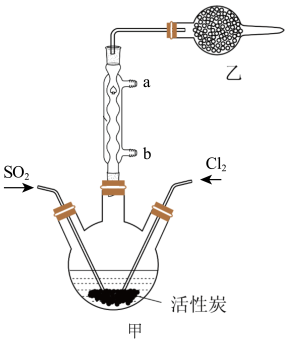
I.SO2Cl2的制备
(1)水应从___ (选填“a”或“b”)口进入。
(2)制取SO2的最佳组合是___ (填标号)。
①Fe+18.4mol/LH2SO4
②Na2SO3+70%H2SO4
③Na2SO3+3mo/LHNO3
(3)乙装置中盛放的试剂是___ 。
(4)制备过程中需要将装置甲置于冰水浴中,原因是___ 。
(5)反应结束后,分离甲中混合物的最佳实验操作是___ 。
II.测定产品中SO2Cl2的含量,实验步骤如下:
①取1.5g产品加入足量Ba(OH)2溶液,充分振荡、过滤、洗涤,将所得溶液均放入锥形瓶中;
②向锥形瓶中加入硝酸酸化,再加入0.2000mol·L-1的AgNO3溶液l00.00mL;
③向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
④加入NH4Fe(SO4)2指示剂,用0.1000mol·L-1NH4SCN溶液滴定过量Ag+,终点所用体积为10.00mL。
已知:Ksp(AgCl)=3.2×10-10 Ksp(AgSCN)=2×10-12
(6)滴定终点的现象为___ 。
(7)产品中SO2Cl2的质量分数为___ %,若步骤③不加入硝基苯则所测SO2Cl2含量将___ (填“偏高”、“偏低”或“无影响”)。
 SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
I.SO2Cl2的制备
(1)水应从
(2)制取SO2的最佳组合是
①Fe+18.4mol/LH2SO4
②Na2SO3+70%H2SO4
③Na2SO3+3mo/LHNO3
(3)乙装置中盛放的试剂是
(4)制备过程中需要将装置甲置于冰水浴中,原因是
(5)反应结束后,分离甲中混合物的最佳实验操作是
II.测定产品中SO2Cl2的含量,实验步骤如下:
①取1.5g产品加入足量Ba(OH)2溶液,充分振荡、过滤、洗涤,将所得溶液均放入锥形瓶中;
②向锥形瓶中加入硝酸酸化,再加入0.2000mol·L-1的AgNO3溶液l00.00mL;
③向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
④加入NH4Fe(SO4)2指示剂,用0.1000mol·L-1NH4SCN溶液滴定过量Ag+,终点所用体积为10.00mL。
已知:Ksp(AgCl)=3.2×10-10 Ksp(AgSCN)=2×10-12
(6)滴定终点的现象为
(7)产品中SO2Cl2的质量分数为
您最近一年使用:0次
2019-12-10更新
|
482次组卷
|
3卷引用:2019年四川省泸州市高三第一次教学质量检测理综化学试题
3 . 氮化铝(AlN)广泛应用于集成电路,其制备原理是将氧化铝与碳粉混合均匀,在持续流动的氮气流中加热至1750℃,发生如下反应:
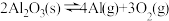
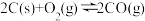
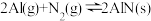
(1)断开N2分子内的共价键要_____ 热量(填“吸收”或“放出”)
(2)分析反应②对①、③平衡移动的影响_____ 。
(3)Al2O3、C、N2合成AlN的平衡常数表达式K=___________ 。
(4)用蒸馏法测定产品中AlN的含量,装置如下(加热及夹持装置略):
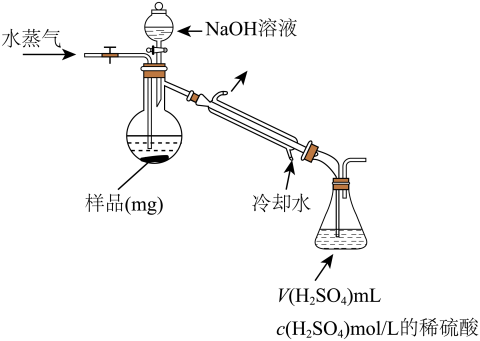
①AlN与NaOH溶液反应产生NH3的化学方程式是____________ 。
②锥形瓶内吸收NH3的离子方程式是____________ 。
③检验NH3是否完全蒸出的方法是:另取少量蒸馏出的溶液,_____ (将检验过程补充完整)。
④NH3完全吸收后,向锥形瓶中加入指示剂,用浓度为c((N aOH)mol/L的NaOH标准溶液滴定过量的H2SO4,终点时用去标准溶液的体积为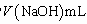 。下面有关计算正确的是
。下面有关计算正确的是_____ 。A.样品中AlN的质量: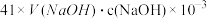
B.AlN的质量分数:
C.锥形瓶吸收NH3的物质的量: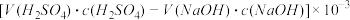
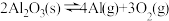
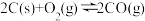
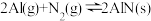
(1)断开N2分子内的共价键要
(2)分析反应②对①、③平衡移动的影响
(3)Al2O3、C、N2合成AlN的平衡常数表达式K=
(4)用蒸馏法测定产品中AlN的含量,装置如下(加热及夹持装置略):

①AlN与NaOH溶液反应产生NH3的化学方程式是
②锥形瓶内吸收NH3的离子方程式是
③检验NH3是否完全蒸出的方法是:另取少量蒸馏出的溶液,
④NH3完全吸收后,向锥形瓶中加入指示剂,用浓度为c((N aOH)mol/L的NaOH标准溶液滴定过量的H2SO4,终点时用去标准溶液的体积为
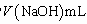 。下面有关计算正确的是
。下面有关计算正确的是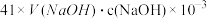
B.AlN的质量分数:

C.锥形瓶吸收NH3的物质的量:
您最近一年使用:0次
10-11高二·福建·阶段练习
4 . 在一密闭容器中通入A、B两种气体,在一定条件下发生反应2A(g)+B(g) 2C(g) ΔH<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合下图中曲线的是( )
2C(g) ΔH<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合下图中曲线的是( )
 2C(g) ΔH<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合下图中曲线的是( )
2C(g) ΔH<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合下图中曲线的是( )| x | y | 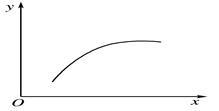 | |
| A | 温度 | 混合气体的平均相对分子质量 | |
| B | 压强 | A的百分含量 | |
| C | 再通入A | B的转化率 | |
| D | 加入催化剂 | A的质量分数 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
5 . 在一密闭容器中,反应 达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
 达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是| A.平衡向逆反应方向移动了 | B.物质A的转化率减小了 |
| C.物质B的质量分数增大了 | D. |
您最近一年使用:0次
2023-11-14更新
|
377次组卷
|
25卷引用:黑龙江省伊春市伊美区第二中学2018-2019学年高二上学期阶段考试(12月)化学试题
黑龙江省伊春市伊美区第二中学2018-2019学年高二上学期阶段考试(12月)化学试题(已下线)【浙江新东方】双师118安徽省淮北市树人高级中学2020-2021学年高二上学期第一次联考化学试题天津市武清区梅厂中学2021-2022学年高二上学期阶段性练习化学试题广西百色中学2021-2022学年高二上学期第一次月考化学试题黑龙江省哈尔滨市依兰县高级中学2021-2022学年高二上学期第一次月考化学试题天津市外国语大学附属外国语学校2021-2022学年高二上学期期中阶段性检测化学试题黑龙江省大庆市东风中学2021-2022学年高二下学期开学考试化学试题黑龙江省绥化市第一中学2021-2022学年高二上学期期末考试化学试题吉林省长春希望高中2021-2022学年高二上学期期末考试化学试题广西桂林市第十八中学2021-2022学年高二下学期开学考试化学试题天津市第二南开学校2022-2023学年高二上学期9月阶段性线上练习化学试题 天津市宁河区芦台第一中学2022-2023学年高二上学期第一次学习诊断化学试题浙江省金华第一中学2022-2023学年高一下学期6月期末化学试题宁夏回族自治区中宁县第一中学2022-2023学年高二上学期10月月考化学试题山西省太原市第五中学校2023-2024学年高二上学期10月月考化学试题浙江省浙东北联盟(ZDB)2023-2024学年高二上学期期中考试化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题 北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题(已下线)寒假作业03 化学平衡-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)新疆石河子第一中学2023-2024学年高二上学期11月月考化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题河北省石家庄市第十五中学2023-2024学年高二上学期12月阶段考试化学试题安徽省阜阳市临泉第一中学(高铁分校)2023-2024学年高二上学期期末考试化学试题广东省汕头市潮阳区河溪中学2023-2024学年高二上学期月考化学试题
6 . 现有反应aA(g)+bB(g) pC(g),达到平衡后,当降低温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当降低温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的正反应是_______ 热反应,且a+b _______ p (填”>““<“或”=“)。
(2)减压时,A的质量分数_______ (填”增大”“减小”或”不变”,下同),正反应速率_______ 。
(3)若加入B(体积不变),则A的转化率_______ ,B的转化率_______ 。
(4)若升高温度,则平衡时,B、C的浓度之比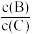 将
将_______ 。
(5)若加入催化剂,平衡时气体压强_______ 。
(6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色_______ ,而维持容器体积不变,充入氖气时,混合物的颜色_______ 。(填”变浅”“变深”或”不变”)
 pC(g),达到平衡后,当降低温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当降低温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:(1)该反应的正反应是
(2)减压时,A的质量分数
(3)若加入B(体积不变),则A的转化率
(4)若升高温度,则平衡时,B、C的浓度之比
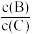 将
将(5)若加入催化剂,平衡时气体压强
(6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色
您最近一年使用:0次
解题方法
7 . t℃时,将3mol A和2mol B气体通入体积为2L的密闭容器中(容积不变),发生反应:3A(g)+ xB(g) ⇌C(g),4min时反应达到平衡状态(温度不变),剩余0.4mol B,并测得C的浓度为0.4mol/L。请填写下列空白:
(1)x_________ 。
(2)用A表示该反应的速率为_________ mol/(L·min)。
(3)若继续向平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是_________ (填写选项字母符号)
A.化学平衡向正反应方向移动
B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动
D.正、逆反应的化学反应速率将发生同等程度的改变
(4)现有反应:mA(g)+nB(g)⇌ pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质分数减小,则:
①该反应的逆反应为_________ 反应(填“吸热”或“放热“),且m+n_________ p(填“>” “=”或“<”)。
②减压使容器体积增大时,A的质量分数_________ 。(填“增大少”“减小”或“不变”,下同)
③若加入B(维持体积不变),则A的转化率_________ 。
④若升高温度,则平衡时B、C的浓度之比将_________ 。
⑤若加入催化剂,平衡时气体混合物的总物质的量_________ 。
(1)x
(2)用A表示该反应的速率为
(3)若继续向平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是
A.化学平衡向正反应方向移动
B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动
D.正、逆反应的化学反应速率将发生同等程度的改变
(4)现有反应:mA(g)+nB(g)⇌ pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质分数减小,则:
①该反应的逆反应为
②减压使容器体积增大时,A的质量分数
③若加入B(维持体积不变),则A的转化率
④若升高温度,则平衡时B、C的浓度之比将
⑤若加入催化剂,平衡时气体混合物的总物质的量
您最近一年使用:0次
8 . 氯化亚铜(CuCl)是一种重要的化工产品。它难溶于H2SO4、HNO3和醇,微溶于水,可溶于浓盐酸和氨水,在水溶液中存在平衡:CuCl(白色)+2Cl﹣⇌[CuCl3]2﹣(无色溶液)。在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)4﹣nCln],n随着环境酸度的改变而改变。某研究小组设计如下两种方案制备氯化亚铜。
方案一:铜粉还原CuSO4溶液
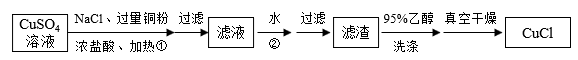
请回答:
(1)步骤①中发生反应的离子方程式为_______ 。
(2)步骤②中,加入大量水的作用是_______ 。
(3)如图流程中用95%乙醇洗涤和真空干燥是为了防止_______ 。
(4)随着pH减小,Cu2(OH)4﹣nCln中铜的质量分数_______ 。
A增大B不变C减小D不能确定
方案二:在氯化氢气流中加热CuCl2•2H2O晶体制备,其流程和实验装置(夹持仪器略)如图:
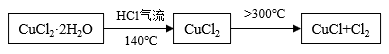
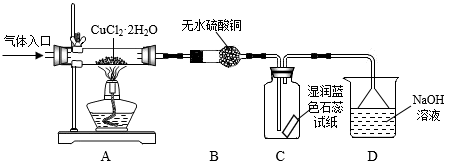
请回答:
(5)实验操作的先后顺序是a→_______ →_______ →_______ →e(填操作的编号)
a检查装置的气密性后加入药品b点燃酒精灯,加热
c在“气体入口”处通入干燥HCl d熄灭酒精灯,冷却
e停止通入HCl,然后通入N2
(6)在实验过程中,观察到B中无水硫酸铜由白色变为蓝色,C中试纸的颜色变化是_______ 。
(7)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2杂质,请分析产生CuCl2杂质的原因_______ 。
方案一:铜粉还原CuSO4溶液

请回答:
(1)步骤①中发生反应的离子方程式为
(2)步骤②中,加入大量水的作用是
(3)如图流程中用95%乙醇洗涤和真空干燥是为了防止
(4)随着pH减小,Cu2(OH)4﹣nCln中铜的质量分数
A增大B不变C减小D不能确定
方案二:在氯化氢气流中加热CuCl2•2H2O晶体制备,其流程和实验装置(夹持仪器略)如图:


请回答:
(5)实验操作的先后顺序是a→
a检查装置的气密性后加入药品b点燃酒精灯,加热
c在“气体入口”处通入干燥HCl d熄灭酒精灯,冷却
e停止通入HCl,然后通入N2
(6)在实验过程中,观察到B中无水硫酸铜由白色变为蓝色,C中试纸的颜色变化是
(7)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2杂质,请分析产生CuCl2杂质的原因
您最近一年使用:0次
名校
9 . 现有反应mA(g)+nB(g)  pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)m+n___________ p(填“>”、“<”或“=”)。
(2)减压时,A的质量分数___________ (填“增大”、“减小”或“不变”,下同)。
(3)若加入B(容器体积不变),则A的转化率___________ ,B的转化率___________ 。
(4)若升高温度,则平衡时,B、C的浓度之比将___________ 。
(5)若加入催化剂,平衡时气体混合物的总物质的量___________ 。
(6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色___________ (填“变浅”、“变深”或“不变”,下同),而维持容器内气体的压强不变充入氖气时,混合物的颜色___________ 。
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:(1)m+n
(2)减压时,A的质量分数
(3)若加入B(容器体积不变),则A的转化率
(4)若升高温度,则平衡时,B、C的浓度之比将
(5)若加入催化剂,平衡时气体混合物的总物质的量
(6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色
您最近一年使用:0次
名校
10 . 在一定条件下,aA+bB cC的可逆反应达到平衡:
cC的可逆反应达到平衡:
(1)若A、B、C都是气体,缩小容器体积,则反应速率______________ (填“增大”或“减小”或“不变”)。
(2)若A、B、C都是气体,减小压强,平衡向逆反应方向移动,则a+b__________ c(填“>”或“=”或“<”)。
(3)若A为固体、B为无色气体、C为有色气体,再加入适量的A物质,则平衡__________ 移动(填“向左”或“向右”或“不”),气体的颜色_________ (填“加深”或“变浅”或“不变”)。
(4)若加热后C的质量分数减少,则正反应是__________ 反应(填“放热”或“吸热”)。
 cC的可逆反应达到平衡:
cC的可逆反应达到平衡:(1)若A、B、C都是气体,缩小容器体积,则反应速率
(2)若A、B、C都是气体,减小压强,平衡向逆反应方向移动,则a+b
(3)若A为固体、B为无色气体、C为有色气体,再加入适量的A物质,则平衡
(4)若加热后C的质量分数减少,则正反应是
您最近一年使用:0次



