(1)H2S溶于水分步电离出HS-、S2-。产生HS-的电离方程式是
(2)脱除H2S有多种方法。
①沉淀法。
将H2S气体通入ZnSO4溶液,只产生少量白色ZnS沉淀,即反应不完全。如果在ZnSO4溶液中事先加入CH3COONa,再通入H2S气体,则可得大量ZnS沉淀。
a.ZnSO4溶液吸收H2S的离子反应方程式是
b.加入CH3COONa后得到大量ZnS沉淀的原因是
②沉淀氧化法。过程如图所示:
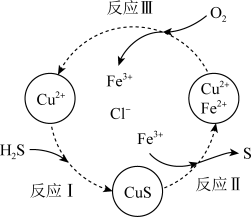
a.反应Ⅱ的离子方程式是
b.资料1:Cu2+在反应Ⅲ中起催化作用:
i.Cu2++Fe2+=Cu++Fe3+
ii.
c.在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有
d.下面实验证实了资料1,Cu2+能提高反应Ⅲ的速率。
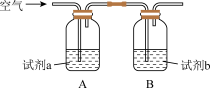
i.试剂a是
ii.Cu2+提高反应Ⅲ速率的实验证据是
 是一种重要的化工原料。以铬铁矿(主要成分为
是一种重要的化工原料。以铬铁矿(主要成分为 ,还含有
,还含有 等杂质)为原料制备
等杂质)为原料制备 的一种工艺流程如下。回答下列问题:
的一种工艺流程如下。回答下列问题:
已知:(a)
 ;
;
(b)不同温度下各物质的溶解度:
| 物质 | KCl | NaCl |  |  | |
| 溶解度(g/100gH2O) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 70 | 376 | |
(1)步骤①的主要反应为
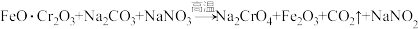 ,该反应配平后
,该反应配平后 与
与 的系数比为
的系数比为(2)“滤渣1”和“滤渣2”的主要成分分别是
a.
 b.KOHc.CH3COOHd.HCl
b.KOHc.CH3COOHd.HCl(3)在步骤⑤中加入适量KCl,
 固体。
固体。(4)化学还原法可除去废水中的
 ,取含
,取含 的模拟水样在不同pH条件下,分别向每个水样中加一定量的
的模拟水样在不同pH条件下,分别向每个水样中加一定量的 、
、 ,搅拌,充分反应,然后滴加
,搅拌,充分反应,然后滴加 悬浊液,静置沉淀,测定+6价Cr的去除率,实验结果如图所示。
悬浊液,静置沉淀,测定+6价Cr的去除率,实验结果如图所示。①在酸性条件下,
 使
使 还原为Cr3+,请写出该反应的离子方程式
还原为Cr3+,请写出该反应的离子方程式②
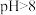 时,亚铁盐对+6价Cr的去除效果反而下降,可能的原因是
时,亚铁盐对+6价Cr的去除效果反而下降,可能的原因是
 与
与 在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):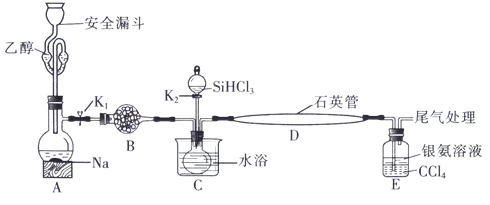
已知:①
 的沸点为33.0℃,密度为
的沸点为33.0℃,密度为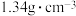 ;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;②
 ;
;③银氨溶液中存在:
 。
。回答下列问题:
(1)装置B中试剂宜选择
a.碱石灰 b.无水氯化钙 C.五氧化二磷 d.硅胶
(2)实验操作步骤有:
①加热装置D至1357K;
②关闭K1;
③加热装置C,打开K2,滴加
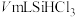 ;
;④关闭K2;
⑤打开K1,向安全漏斗中加入足量乙醇,装置A中反应一段时间。
正确的操作顺序为
(3)E中CCl4的作用是防倒吸和
(4)石英管中发生反应的化学方程式为
(5)本实验制得高纯硅ag,则SiHCl3的利用率为
(1)科学家用
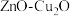 做催化剂,可将
做催化剂,可将 和
和 转化为甲烷。已知有关化学反应的能量变化如图所示,则该转化反应的热化学方程式为
转化为甲烷。已知有关化学反应的能量变化如图所示,则该转化反应的热化学方程式为
(2)用惰性电极电解
 溶液,可将空气中的
溶液,可将空气中的 转化为甲酸根(
转化为甲酸根( ),然后进一步可制得化工原料甲酸。
),然后进一步可制得化工原料甲酸。 发生反应的电极反应式为
发生反应的电极反应式为(3)乙苯催化脱氢制取苯乙烯的反应为:
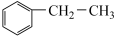 (g)+CO2(g)
(g)+CO2(g)
 (g)+H2O(g)+CO(g),其反应历程如下:
(g)+H2O(g)+CO(g),其反应历程如下: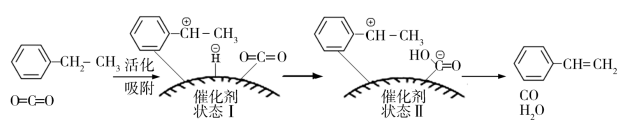
①由原料到“状态Ⅰ”
②一定温度下,向恒容密闭容器中充入2mol乙苯和
 ,起始压强为
,起始压强为 ,平衡时容器内气体总物质的量为5mol,乙苯的转化率为
,平衡时容器内气体总物质的量为5mol,乙苯的转化率为
③乙苯平衡转化率与
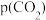 的关系如图所示,乙苯平衡转化率随着
的关系如图所示,乙苯平衡转化率随着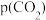 变化的原因是
变化的原因是

已知:萃取Co2+的反应原理:Co2++2HR(有机磷)
 CoR2+2H+。下列说法错误的是
CoR2+2H+。下列说法错误的是| A.“滤液Ⅰ”中溶质的主要成分是Na[Al(OH)4] |
| B.“酸溶”中H2O2的作用是将Co2+氧化为Co3+ |
| C.“反萃取”中可加入H2SO4分离出Co2+ |
| D.“沉钴”时增大Na2CO3溶液的浓度或滴加速率,能够提高产品的纯度 |
(1)银的浸出
I.两步法:

已知:i.
 溶液与
溶液与 溶液直接混合能发生氧化还原反应;
溶液直接混合能发生氧化还原反应;ii.
 ,
,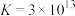 。
。①
 溶液将胶片上的单质银转化为
溶液将胶片上的单质银转化为 ,其离子方程式是
,其离子方程式是②
 溶液能溶解
溶液能溶解 并得到含
并得到含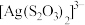 的浸出液。结合平衡移动原理解释
的浸出液。结合平衡移动原理解释 溶解的原因:
溶解的原因:II.一步法:用水溶解
 和乙二胺四乙酸二钠(用
和乙二胺四乙酸二钠(用 表示)的混合固体,调节
表示)的混合固体,调节 形成
形成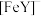 溶液,再加入一定量
溶液,再加入一定量 ,配成浸取液。将废感光胶片浸入浸取液中,发生反应:
,配成浸取液。将废感光胶片浸入浸取液中,发生反应: 。
。③从物质氧化性或还原性的角度分析加入
 的作用:
的作用:(2)银的还原
调节(1)所得浸出液的
 ,向其中加入
,向其中加入 溶液(B的化合价为
溶液(B的化合价为 )至不再产生黑色沉淀,过滤得到粗银;滤液中的
)至不再产生黑色沉淀,过滤得到粗银;滤液中的 可以循环使用。补全离子方程式:
可以循环使用。补全离子方程式: ,
,(3)银浸出率的测定
称取m1g洗净干燥的原胶片,灼烧灰化后用
 溶解,过滤。滤液用
溶解,过滤。滤液用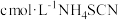 标准溶液滴定至终点,消耗标准溶液V1mL。另取m2g洗净干燥的浸取后胶片,用同样方法处理,滴定,消耗
标准溶液滴定至终点,消耗标准溶液V1mL。另取m2g洗净干燥的浸取后胶片,用同样方法处理,滴定,消耗 标准溶液V2mL。(已知:
标准溶液V2mL。(已知: )
)①银的浸出率

②实验发现在浸取试剂均过量、浸取时间足够长的情况下,与II相比,I中银的浸出率明显偏低,其原因可能是
 、Cr2O
、Cr2O 、泥沙等)的流程如图:
、泥沙等)的流程如图: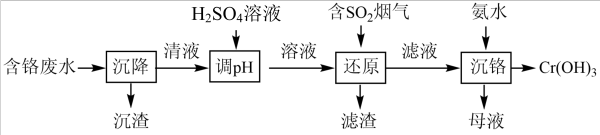
下列说法错误的是
| A.“沉降”的主要目的是除去泥沙等不溶物 |
B.“调pH”时存在CrO 转化为Cr2O 转化为Cr2O |
| C.H2SO4溶液更适合用盐酸代替 |
| D.母液经处理可获得(NH4)2SO4 |
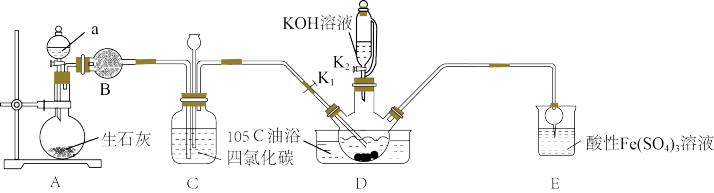
已知:①
 不溶于
不溶于 和
和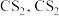 不溶于水且密度比水大;
不溶于水且密度比水大;②D中三颈烧瓶内盛放
 、水和催化剂,发生反应
、水和催化剂,发生反应 ,该反应比较缓慢且
,该反应比较缓慢且 在高于170℃时易分解,
在高于170℃时易分解, 在高于25℃时即分解。
在高于25℃时即分解。回答下列问题:
(1)试剂a是
(2)制备KSCN溶液:将D中反应混合液加热至105℃,打开K1通入氨气。
①反应一段时间后,关闭K1,此时装置C中观察到的现象是保持三颈烧瓶内反应混合液温度为105℃一段时间,这样操作的目的是
②打开K2,缓缓滴入适量的KOH溶液,继续保持反应混合液温度为105℃。
(3)装置E中发生氧化还原反应的离子方程式是
(4)制备硫氰酸钾晶体:先滤去三颈烧瓶中的固体催化剂,再经
(5)取少量所得KSCN晶体配成溶液,将装置E中混合液过滤得溶液x,进行如下实验:

①设计实验探究ⅱ中银镜产生的原因
②小组同学观察到ⅲ中实验现象后,用力振荡试管,又观察到红色褪去和沉淀增多,请用必要的文字和离子方程式解释:
 作锂电池的正极材料。
作锂电池的正极材料。I.(1)基态Co原子的价层电子排布式为
II.利用原钴矿
 (含
(含 、NiS等杂质)制备
、NiS等杂质)制备 的工艺流程如下:
的工艺流程如下: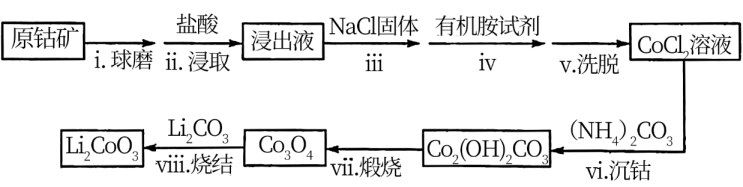
资料:①在含一定量
 的溶液中:
的溶液中: 。
。②
 溶于有机胺试剂,有机胺不溶于水。
溶于有机胺试剂,有机胺不溶于水。③盐酸溶液中,有机胺试剂对金属离子的溶解率随盐酸浓度变化如图所示:
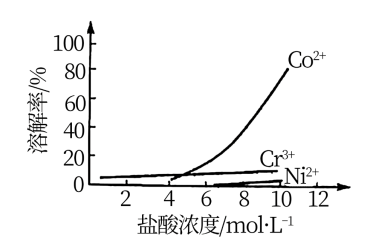
(2)步骤i的目的是
(3)步骤ii中出现了淡黄色沉淀,写出发生该反应的离子方程式:
(4)从平衡移动角度解释步骤iii中加入NaCl固体的目的是
(5)步骤vi用
 作沉钴剂,在一定条件下得到碱式碳酸钴
作沉钴剂,在一定条件下得到碱式碳酸钴 。实验测得在一段时间内加入等量
。实验测得在一段时间内加入等量 所得沉淀质量随反应温度的变化如图所示,分析曲线下降的原因
所得沉淀质量随反应温度的变化如图所示,分析曲线下降的原因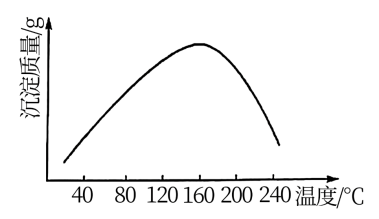
(6)步骤vi沉钴中(常温下进行),若滤液中
 含量为
含量为 ,此时溶液的pH为
,此时溶液的pH为
(7)步骤viii中
 和
和 混合后,鼓入空气,经高温烧结得到
混合后,鼓入空气,经高温烧结得到 。该反应的化学方程式是
。该反应的化学方程式是10 . 氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理和化学平衡对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g) 2NO2(g)ΔH。上述反应分两步完成,其反应历程如图所示。
2NO2(g)ΔH。上述反应分两步完成,其反应历程如图所示。

请回答下列问题:
①写出反应II的热化学方程式
②反应I和反应II中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) 2NO2(g)反应速率的是
2NO2(g)反应速率的是
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及12min和15min时各物质的平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及12min和15min时各物质的平衡浓度如表所示:
浓度(mol·L-1) 时间(min) | NO | CO2 | N2 |
0 | 0.200 | 0 | 0 |
12 | 0.050 | 0.075 | 0.075 |
15 | 0.100 | 0.050 | 0.450 |
①T℃时,该反应的平衡常数为
②在12min时,若只改变某一条件使平衡发生移动,15min时重新达到平衡,则改变的条件是
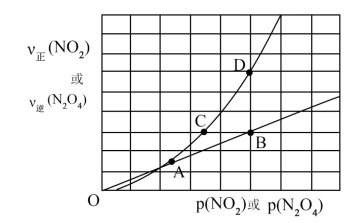
③在15min时,保持温度和容器体积不变再充入NO和N2,使NO、N2的浓度分别增加至原来的2倍4倍,此时反应v正
(3)NO2存在如下平衡:2NO2(g) N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系式:v正(NO2)=k1·P2(NO2),v逆(N2O4)=k2·P(N2O4),速率与分压关系如图所示。一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是Kp=
N2O4(g)△H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系式:v正(NO2)=k1·P2(NO2),v逆(N2O4)=k2·P(N2O4),速率与分压关系如图所示。一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是Kp=