解题方法
1 . 下列方案设计、现象和结论不正确的是
| 实验方案 | 现象 | 结论 | |
| A | 试管中依次加入3mL乙醇2mL浓硫酸、2mL乙酸及沸石后连接好装置并加热 | 饱和碳酸钠液面上出现有香味的无色油状液体 | 有酯类物质生成 |
| B | 将 液体和 液体和 固体分别暴露在潮湿空气中 固体分别暴露在潮湿空气中 | 只有前者会冒“白烟” | 相同条件下水解程度: |
| C | 室温下,将 溶液和稀 溶液和稀 混合 混合 | 溶液变浑浊且有刺激性气味的气体生成 |  既体现还原性又体现氧化性 既体现还原性又体现氧化性 |
| D | 向 溶液中加入5滴 溶液中加入5滴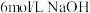 溶液 溶液 | 溶液由橙色变黄色 |  减小,平衡向 减小,平衡向 减小的方向移动 减小的方向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 已知 ,在酸化的KI溶液中通入
,在酸化的KI溶液中通入 ,观察到溶液变为棕色并出现混浊,继续通入
,观察到溶液变为棕色并出现混浊,继续通入 ,直到溶液棕色恰好褪去,发生的反应分别为:
,直到溶液棕色恰好褪去,发生的反应分别为: ,
, ,下列说法错误的是
,下列说法错误的是
 ,在酸化的KI溶液中通入
,在酸化的KI溶液中通入 ,观察到溶液变为棕色并出现混浊,继续通入
,观察到溶液变为棕色并出现混浊,继续通入 ,直到溶液棕色恰好褪去,发生的反应分别为:
,直到溶液棕色恰好褪去,发生的反应分别为: ,
, ,下列说法错误的是
,下列说法错误的是A. 和水在KI的催化下可以发生氧化还原反应 和水在KI的催化下可以发生氧化还原反应 |
| B.物质的氧化性或还原性强弱与浓度有关 |
C.整个过程中被氧化的 和被还原的 和被还原的 物质的量比为1:2 物质的量比为1:2 |
| D.配制碘酒时可以加入一定量KI |
您最近一年使用:0次
名校
3 . 下列物质性质与用途具有对应关系的是
| A.FeS具有氧化性,可用于制取硫酸 |
B. 不溶于水,可以作半导体材料 不溶于水,可以作半导体材料 |
C. 具有还原性,可用于漂白某些有色物质 具有还原性,可用于漂白某些有色物质 |
D. 具有难挥发性,可用于制取挥发性酸 具有难挥发性,可用于制取挥发性酸 |
您最近一年使用:0次
2023·全国·模拟预测
解题方法
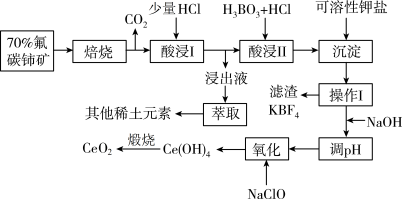
4 . 铈(Ce)是人类发现的第二种稀土元素,铈的氧化物在半导体材料、高级颜料及汽车尾气的净化器方面有广泛应用。以氟碳铈矿(主要含 )制备
)制备 的工艺流程如下:
的工艺流程如下:
已知:①铈的常见化合价为+3、+4。四价铈不易进入溶液,而三价铈易进入溶液
② 能与
能与 结合成
结合成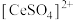 ,
, 能被萃取剂
能被萃取剂 萃取。
萃取。
(1)焙烧后铈元素转化成 和
和 ,焙烧氟碳铈矿的目的是
,焙烧氟碳铈矿的目的是___________ 。
(2)“酸浸II”过程中 转化为
转化为 ,且产生黄绿色气体,用稀硫酸和
,且产生黄绿色气体,用稀硫酸和 替换
替换 就不会造成环境污染。则稀硫酸、
就不会造成环境污染。则稀硫酸、 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
(3)“操作I”的名称是___________ 。
(4)“浸出液”中含有少量 及其他稀土元素的离子,可以通过“萃取”与“反萃取”作进一步分离、富集各离子。“萃取”时
及其他稀土元素的离子,可以通过“萃取”与“反萃取”作进一步分离、富集各离子。“萃取”时 与萃取剂
与萃取剂 存在反应:
存在反应:
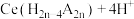 。用D表示
。用D表示 分别在有机层中与水层中存在形式的浓度之比:
分别在有机层中与水层中存在形式的浓度之比: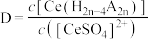 ,其他条件不变,在浸出液中加入不同量的
,其他条件不变,在浸出液中加入不同量的 ,以改变水层中的
,以改变水层中的 ,D随浸出液中
,D随浸出液中 增大而减小的原因是
增大而减小的原因是___________ 。
(5)取 上述流程中得到的
上述流程中得到的 ,加酸溶解后,向其中加入含
,加酸溶解后,向其中加入含 的硫酸亚铁溶液使
的硫酸亚铁溶液使 全部被还原成
全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点时,消耗
标准溶液滴定至终点时,消耗 标准溶液。则
标准溶液。则 的质量分数为
的质量分数为___________ (已知氧化性: ;
; 的相对分子质量为208)。
的相对分子质量为208)。
 )制备
)制备 的工艺流程如下:
的工艺流程如下:
已知:①铈的常见化合价为+3、+4。四价铈不易进入溶液,而三价铈易进入溶液
②
 能与
能与 结合成
结合成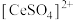 ,
, 能被萃取剂
能被萃取剂 萃取。
萃取。(1)焙烧后铈元素转化成
 和
和 ,焙烧氟碳铈矿的目的是
,焙烧氟碳铈矿的目的是(2)“酸浸II”过程中
 转化为
转化为 ,且产生黄绿色气体,用稀硫酸和
,且产生黄绿色气体,用稀硫酸和 替换
替换 就不会造成环境污染。则稀硫酸、
就不会造成环境污染。则稀硫酸、 与
与 反应的离子方程式为
反应的离子方程式为(3)“操作I”的名称是
(4)“浸出液”中含有少量
 及其他稀土元素的离子,可以通过“萃取”与“反萃取”作进一步分离、富集各离子。“萃取”时
及其他稀土元素的离子,可以通过“萃取”与“反萃取”作进一步分离、富集各离子。“萃取”时 与萃取剂
与萃取剂 存在反应:
存在反应:
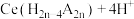 。用D表示
。用D表示 分别在有机层中与水层中存在形式的浓度之比:
分别在有机层中与水层中存在形式的浓度之比: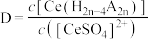 ,其他条件不变,在浸出液中加入不同量的
,其他条件不变,在浸出液中加入不同量的 ,以改变水层中的
,以改变水层中的 ,D随浸出液中
,D随浸出液中 增大而减小的原因是
增大而减小的原因是(5)取
 上述流程中得到的
上述流程中得到的 ,加酸溶解后,向其中加入含
,加酸溶解后,向其中加入含 的硫酸亚铁溶液使
的硫酸亚铁溶液使 全部被还原成
全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点时,消耗
标准溶液滴定至终点时,消耗 标准溶液。则
标准溶液。则 的质量分数为
的质量分数为 ;
; 的相对分子质量为208)。
的相对分子质量为208)。
您最近一年使用:0次
解题方法
5 . 由实验操作和现象,可得出相应正确结论的是
| 实验操作 | 现象 | 结论 | |
| A | 向NaBr溶液中滴加过量氯水,再加入淀粉KI溶液 | 先变橙色,后变蓝色 | 氧化性: Cl2>Br2>I2 |
| B | 将铁锈溶于浓盐酸,再滴加酸性高锰酸钾溶液 | 高锰酸钾溶液的紫色褪去 | 铁锈中含有二价铁 |
| C | 向铬酸钾溶液中缓慢滴加硫酸 | 黄色变为橙红色 |  +H2O +H2O 2 2 +2H+,增大氢离子浓度,平衡向生成 +2H+,增大氢离子浓度,平衡向生成 和的方向移动 和的方向移动 |
| D | 向蔗糖溶液中滴加稀硫酸,水浴加热,再加入新制Cu(OH)2悬浊液 | 无砖红色沉淀 | 蔗糖未发生水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
6 . 已知 为可逆反应,某小组设计实验测定该反应平衡常数并探究影响化学平衡移动的因素。
为可逆反应,某小组设计实验测定该反应平衡常数并探究影响化学平衡移动的因素。
(1)配制 溶液和
溶液和 溶液。
溶液。
 基态核外电子排布式为
基态核外电子排布式为_______ ,实验中所需的玻璃仪器有容量瓶、量筒和_______ 。(从下图中选择,写出名称)
将 溶液与
溶液与 溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液。(忽略反应引起的溶液体积变化)
溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液。(忽略反应引起的溶液体积变化)
①甲同学通过测定滤液中 浓度测得K。取
浓度测得K。取 滤液,用
滤液,用 标准溶液滴定滤液中
标准溶液滴定滤液中 ,至滴定终点时消耗
,至滴定终点时消耗 标准溶液
标准溶液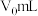 。滴定终点的现象为
。滴定终点的现象为_______ ,反应 的平衡常数
的平衡常数
_______ 。(用含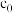 、
、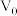 、V的计算式表示)
、V的计算式表示)
②乙同学通过测定滤液中 浓度测得K。取
浓度测得K。取 滤液,加入
滤液,加入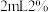 磺基水杨酸溶液,加入
磺基水杨酸溶液,加入 为9~11.5的缓冲溶液,测定吸光度。测得溶液中
为9~11.5的缓冲溶液,测定吸光度。测得溶液中 浓度为
浓度为 ,则
,则 的平衡常数
的平衡常数
_______ 。(用含c的计算式表示)
(3)该小组进一步研究常温下稀释对该平衡移动方向的影响。
用 溶液和
溶液和 溶液,按下表配制总体积相同的系列溶液,测定平衡时
溶液,按下表配制总体积相同的系列溶液,测定平衡时 浓度,记录数据。
浓度,记录数据。

_______ ,
_______ 。 和
和 存在的关系是
存在的关系是_______ (用含 和
和 的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。
的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。
 为可逆反应,某小组设计实验测定该反应平衡常数并探究影响化学平衡移动的因素。
为可逆反应,某小组设计实验测定该反应平衡常数并探究影响化学平衡移动的因素。(1)配制
 溶液和
溶液和 溶液。
溶液。 基态核外电子排布式为
基态核外电子排布式为
| 资料卡片 ⅰ. 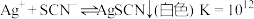 ; ;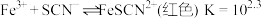 ⅱ.  为9~l1.5条件下 为9~l1.5条件下 和磺基水杨酸 和磺基水杨酸 生成稳定的黄色络合物 生成稳定的黄色络合物 , , 可以通过测定吸光度得知其浓度。 可以通过测定吸光度得知其浓度。 |
 溶液与
溶液与 溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液。(忽略反应引起的溶液体积变化)
溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液。(忽略反应引起的溶液体积变化)①甲同学通过测定滤液中
 浓度测得K。取
浓度测得K。取 滤液,用
滤液,用 标准溶液滴定滤液中
标准溶液滴定滤液中 ,至滴定终点时消耗
,至滴定终点时消耗 标准溶液
标准溶液 。滴定终点的现象为
。滴定终点的现象为 的平衡常数
的平衡常数
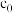 、
、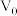 、V的计算式表示)
、V的计算式表示)②乙同学通过测定滤液中
 浓度测得K。取
浓度测得K。取 滤液,加入
滤液,加入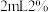 磺基水杨酸溶液,加入
磺基水杨酸溶液,加入 为9~11.5的缓冲溶液,测定吸光度。测得溶液中
为9~11.5的缓冲溶液,测定吸光度。测得溶液中 浓度为
浓度为 ,则
,则 的平衡常数
的平衡常数
(3)该小组进一步研究常温下稀释对该平衡移动方向的影响。
用
 溶液和
溶液和 溶液,按下表配制总体积相同的系列溶液,测定平衡时
溶液,按下表配制总体积相同的系列溶液,测定平衡时 浓度,记录数据。
浓度,记录数据。| 序号 | 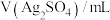 | 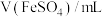 | 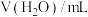 | 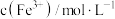 |
| Ⅰ | 10 | 10 |  | |
| Ⅱ | 2 | a | b |  |


 和
和 存在的关系是
存在的关系是 和
和 的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。
的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。
您最近一年使用:0次
名校
解题方法
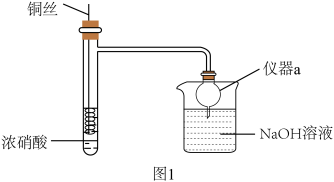
7 . HNO3是重要的化工原料,浓HNO3与Cu反应的装置如图1所示:
回答下列问题:
(1)仪器a的名称是_______ ,在该实验中的作用为_______ 。
(2)关于该实验下列说法错误的是_______。
(3)某小组同学发现Cu与浓HNO3反应所得混合溶液为绿色,Cu与稀HNO3反应所得混合溶液为蓝色,针对绿色产生的原因展开探究。
【提出猜想】
猜想a:Cu(NO3)2浓度大
猜想b:NO2溶解在Cu(NO3)2溶液中
【实验验证】
实验i:配制饱和Cu(NO3)2溶液,溶液呈_______ 色,证明猜想a不成立。
实验ii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到_______ ,5min后,溶液完全变为蓝色,证明猜想b成立。
(4)另一组同学查阅资料发现:NO2能与水反应生成HNO2,进而发生下述反应:
①由此该组同学认为通过实验说明猜想b成立不严谨,理由是_______ 。
②写出NO2与水反应生成HNO2的化学方程式_______ 。
③该组同学改进后设计了新的实验:
实验iii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。对比实验ii与实验iii,可推测Cu(NO3)2溶液为绿色的原因主要是_______ 。

回答下列问题:
(1)仪器a的名称是
(2)关于该实验下列说法错误的是_______。
| A.该反应需要加热才能进行 | B.可通过抽动铜丝控制反应开始和停止 |
| C.反应后迅速生成大量红棕色气体 | D.烧杯中仅发生中和反应 |
【提出猜想】
猜想a:Cu(NO3)2浓度大
猜想b:NO2溶解在Cu(NO3)2溶液中
【实验验证】
实验i:配制饱和Cu(NO3)2溶液,溶液呈
实验ii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到

(4)另一组同学查阅资料发现:NO2能与水反应生成HNO2,进而发生下述反应:

①由此该组同学认为通过实验说明猜想b成立不严谨,理由是
②写出NO2与水反应生成HNO2的化学方程式
③该组同学改进后设计了新的实验:
实验iii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。对比实验ii与实验iii,可推测Cu(NO3)2溶液为绿色的原因主要是
您最近一年使用:0次
2023-02-09更新
|
1335次组卷
|
3卷引用:广东省佛山市2023届普通高中教学质量检测(一)化学试题
名校
解题方法
8 . CuCl2是常见的化学试剂,某学习小组利用废铜屑“湿法”制备CuCl2·2H2O。

氯化铜在不同温度下结晶形成的结晶水合物
回答下列问题:
(1)仪器a的名称为_______ ,NaOH溶液的作用是_______ 。
(2)“湿法”制备CuCl2的离子方程式为_______ ,实验中,H2O2的实际用量要大于理论用量,原因是_______ 。
(3)为得到纯净的CuCl2·2H2O晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入HCl气体,加热蒸发浓缩,_______ ,过滤,洗涤,低温干燥,其中,持续通入HCl的作用是_______ 。
(4)查阅资料:[Cu(H2O)4]2+(蓝色)+4Cl- ⇌[CuCl4]2-(黄色)+4H2O,设计实验证明CuCl2溶液中存在上述平衡:取少量蓝色CuCl2稀溶液于试管中,_______ 。
(5)查阅资料:[CuCl4]2-比[Cu(H2O)4]2+更稳定:与Cu2+配位时,Cl-比H2O的配位能力更强,原因可能是_______ 。

氯化铜在不同温度下结晶形成的结晶水合物
| 温度 | 15℃以下 | 15~25.7℃ | 26~42℃ | 42℃以上 |
| 结晶水合物 | CuCl2·4H2O | CuCl2·3H2O | CuCl2·2H2O | CuCl2·H2O |
(1)仪器a的名称为
(2)“湿法”制备CuCl2的离子方程式为
(3)为得到纯净的CuCl2·2H2O晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入HCl气体,加热蒸发浓缩,
(4)查阅资料:[Cu(H2O)4]2+(蓝色)+4Cl- ⇌[CuCl4]2-(黄色)+4H2O,设计实验证明CuCl2溶液中存在上述平衡:取少量蓝色CuCl2稀溶液于试管中,
(5)查阅资料:[CuCl4]2-比[Cu(H2O)4]2+更稳定:与Cu2+配位时,Cl-比H2O的配位能力更强,原因可能是
您最近一年使用:0次
9 . 利用某一工业钴渣(主要成分为 ,含少量
,含少量 、
、 、MgO、CuO)制备金属钴的流程如图所示:
、MgO、CuO)制备金属钴的流程如图所示:
①沉淀1为黄钠铁矾,化学式为: 。
。
②当某离子浓度 时认为沉淀完全,
时认为沉淀完全, ,
, ,
, ,
, ,
,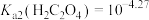
③氧化性:
(1)“浸出”过程中 元发生反应的离子方程式为
元发生反应的离子方程式为_______ ,用盐酸代替硫酸的缺点是_______ 。
(2)“浸出液”中加入 的作用是
的作用是_______ ,试剂a为_______ 。
(3)有机萃取剂用HR表示,发生萃取的反应可表示为 ,为回收
,为回收 ,可向有机相中加入一定浓度的
,可向有机相中加入一定浓度的 ,将其反萃取到水相,其原理是
,将其反萃取到水相,其原理是_______ 。
(4)沉淀2为 ,当
,当 恰好沉淀完全时,溶液中HF浓度为
恰好沉淀完全时,溶液中HF浓度为 ,则此时溶液的pH=
,则此时溶液的pH=_______ 。用 溶液沉钴,其水溶液中存在反应
溶液沉钴,其水溶液中存在反应 ,其平衡常数为K,则K=
,其平衡常数为K,则K=_______ 。
(5)已知氧化性: 。工业上采用惰性电极电解
。工业上采用惰性电极电解 溶液制取钴,不用
溶液制取钴,不用 溶液代替
溶液代替 溶液的原因是
溶液的原因是_______ 。
 ,含少量
,含少量 、
、 、MgO、CuO)制备金属钴的流程如图所示:
、MgO、CuO)制备金属钴的流程如图所示: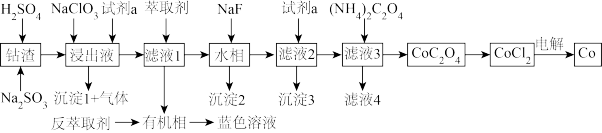
①沉淀1为黄钠铁矾,化学式为:
 。
。②当某离子浓度
 时认为沉淀完全,
时认为沉淀完全, ,
, ,
, ,
, ,
,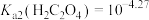
③氧化性:

(1)“浸出”过程中
 元发生反应的离子方程式为
元发生反应的离子方程式为(2)“浸出液”中加入
 的作用是
的作用是(3)有机萃取剂用HR表示,发生萃取的反应可表示为
 ,为回收
,为回收 ,可向有机相中加入一定浓度的
,可向有机相中加入一定浓度的 ,将其反萃取到水相,其原理是
,将其反萃取到水相,其原理是(4)沉淀2为
 ,当
,当 恰好沉淀完全时,溶液中HF浓度为
恰好沉淀完全时,溶液中HF浓度为 ,则此时溶液的pH=
,则此时溶液的pH= 溶液沉钴,其水溶液中存在反应
溶液沉钴,其水溶液中存在反应 ,其平衡常数为K,则K=
,其平衡常数为K,则K=(5)已知氧化性:
 。工业上采用惰性电极电解
。工业上采用惰性电极电解 溶液制取钴,不用
溶液制取钴,不用 溶液代替
溶液代替 溶液的原因是
溶液的原因是
您最近一年使用:0次
解题方法
10 . 铬与铝性质相似,但活泼性比铝弱、熔点比铝高。下列说法错误的是
| A.可用铝热反应制备铬 |
| B.常温下铬在浓硝酸中发生钝化 |
C.可直接蒸发 溶液制备无水 溶液制备无水 |
D.已知碱性条件下,Cr(Ⅲ)可被氧化为Cr(Ⅵ),则其氧化产物为 |
您最近一年使用:0次



