名校
解题方法
1 . 完成下列问题。
(1)氨基甲酸铵是合成尿素的一种中间产物。将体积比为2∶1的 和
和 混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:
混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡: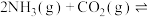
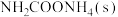
 ,反应过程中氨气质量与时间关系如图所示:
,反应过程中氨气质量与时间关系如图所示:
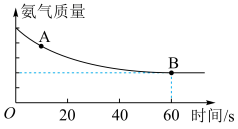
A点正反应速率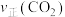
___________ B点逆反应速率 (填“>”、“<”或“=”),上述反应达平衡状态后降低体系温度,新平衡体系中
(填“>”、“<”或“=”),上述反应达平衡状态后降低体系温度,新平衡体系中 的体积分数与原平衡相比
的体积分数与原平衡相比___________ (填“下降”、“不变”或“升高”)
(2)温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1mol ,发生反应:
,发生反应: ,反应相同时间,测得各容器中
,反应相同时间,测得各容器中 的转化率与容器体积的关系如下图所示。
的转化率与容器体积的关系如下图所示。
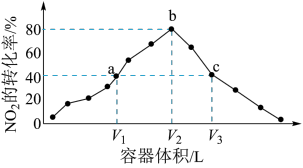
下列说法正确的是___________ 。
A.容器内的压强: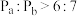
B.图中c点所示条件下,
C.向a点平衡体系中充入一定量的 ,达到平衡时,
,达到平衡时, 的转化率比原平衡大
的转化率比原平衡大
(3)电解法制取 ,同时可获得氢气:
,同时可获得氢气: ,工作原理如图1所示。已知:若NaOH溶液浓度过高,铁电极区会产生红褐色物质:
,工作原理如图1所示。已知:若NaOH溶液浓度过高,铁电极区会产生红褐色物质: 只在强碱性条件下稳定。
只在强碱性条件下稳定。
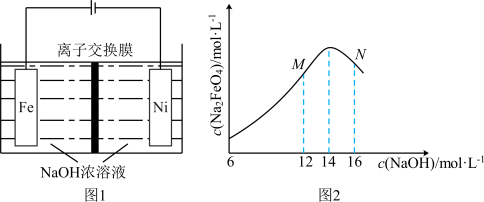
①电解时,Fe电极发生的电极反应式为___________ 。
②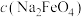 随初始
随初始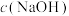 的变化如图2,则分别分析M、N点
的变化如图2,则分别分析M、N点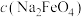 均低于最高值的可能的原因:M点
均低于最高值的可能的原因:M点___________ ;N点___________ 。
(4)甲醚( )是重要的化工原料,制取原理如下:
)是重要的化工原料,制取原理如下:
主反应①: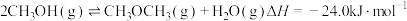 。
。
副反应②: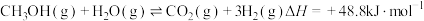 。
。
选择合适的催化剂。在不同温度和5MPa压强下,测得甲醚的选择性如下图所示。 的选择性=(2×
的选择性=(2× 的物质的量/反应的
的物质的量/反应的 的物质的量)×100%
的物质的量)×100%
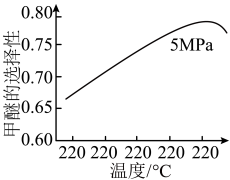
图中,温度高于265℃后甲醚选择性降低,从平衡的角度分析,其可能的原因是___________ 。
(1)氨基甲酸铵是合成尿素的一种中间产物。将体积比为2∶1的
 和
和 混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:
混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡: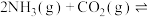
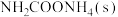
 ,反应过程中氨气质量与时间关系如图所示:
,反应过程中氨气质量与时间关系如图所示:
A点正反应速率
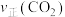
 (填“>”、“<”或“=”),上述反应达平衡状态后降低体系温度,新平衡体系中
(填“>”、“<”或“=”),上述反应达平衡状态后降低体系温度,新平衡体系中 的体积分数与原平衡相比
的体积分数与原平衡相比(2)温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1mol
 ,发生反应:
,发生反应: ,反应相同时间,测得各容器中
,反应相同时间,测得各容器中 的转化率与容器体积的关系如下图所示。
的转化率与容器体积的关系如下图所示。
下列说法正确的是
A.容器内的压强:
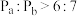
B.图中c点所示条件下,

C.向a点平衡体系中充入一定量的
 ,达到平衡时,
,达到平衡时, 的转化率比原平衡大
的转化率比原平衡大(3)电解法制取
 ,同时可获得氢气:
,同时可获得氢气: ,工作原理如图1所示。已知:若NaOH溶液浓度过高,铁电极区会产生红褐色物质:
,工作原理如图1所示。已知:若NaOH溶液浓度过高,铁电极区会产生红褐色物质: 只在强碱性条件下稳定。
只在强碱性条件下稳定。
①电解时,Fe电极发生的电极反应式为
②
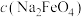 随初始
随初始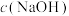 的变化如图2,则分别分析M、N点
的变化如图2,则分别分析M、N点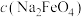 均低于最高值的可能的原因:M点
均低于最高值的可能的原因:M点(4)甲醚(
 )是重要的化工原料,制取原理如下:
)是重要的化工原料,制取原理如下:主反应①:
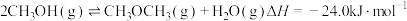 。
。副反应②:
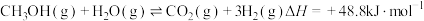 。
。选择合适的催化剂。在不同温度和5MPa压强下,测得甲醚的选择性如下图所示。
 的选择性=(2×
的选择性=(2× 的物质的量/反应的
的物质的量/反应的 的物质的量)×100%
的物质的量)×100%
图中,温度高于265℃后甲醚选择性降低,从平衡的角度分析,其可能的原因是
您最近一年使用:0次
解题方法
2 . 化学固定、催化活化循环利用 的研究,备受重视。铜基催化剂上
的研究,备受重视。铜基催化剂上 加氢合成甲醇是重要的利用途径。该工艺主要发生合成甲醇的反应Ⅰ和逆水汽变换反应Ⅱ。
加氢合成甲醇是重要的利用途径。该工艺主要发生合成甲醇的反应Ⅰ和逆水汽变换反应Ⅱ。
I.
II.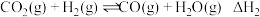
已知甲醇的选择性
(1)反应I能自发进行的条件是___________ 。(填“低温”或“高温”或“任意温度”)
(2)根据下表中的键能数据,计算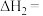
___________ 。
(3)恒温恒容条件下,原料气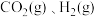 以物质的量浓度1∶3投料,甲醇的选择性为50%。已知初始
以物质的量浓度1∶3投料,甲醇的选择性为50%。已知初始 ,
, 平衡转化率为50%,则该条件下反应I的平衡常数
平衡转化率为50%,则该条件下反应I的平衡常数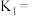
_______ 。
(4)已知催化剂表面金属能吸附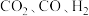 分子,反应I和II发生在催化剂表面的不同活性位点。在
分子,反应I和II发生在催化剂表面的不同活性位点。在 、
、 条件下,将原料气按照a、b、c、d四种方式以相同流速通过催化剂,测得各组分转化率(X)和选择性(S)如下表所示。
条件下,将原料气按照a、b、c、d四种方式以相同流速通过催化剂,测得各组分转化率(X)和选择性(S)如下表所示。
原料气组成与转化率和选择性的关系
①由上表数据可知,其他条件一定时,原料气中 体积分数越大,生成的甲醇
体积分数越大,生成的甲醇___________ 越多(填“一定”或“不一定”)
②根据上表数据,推测随着原料气中掺杂 体积分数的增大,
体积分数的增大, 转化率迅速降低的原因是
转化率迅速降低的原因是___________ 。
③在催化剂作用下发生上述反应I、II,达平衡时 的转化率随温度和压强的变化如右图所示,则
的转化率随温度和压强的变化如右图所示,则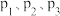 由大到小的顺序为
由大到小的顺序为___________ ,当压强一定时, 的平衡转化率呈现如图变化的原因是
的平衡转化率呈现如图变化的原因是___________ 。
 的研究,备受重视。铜基催化剂上
的研究,备受重视。铜基催化剂上 加氢合成甲醇是重要的利用途径。该工艺主要发生合成甲醇的反应Ⅰ和逆水汽变换反应Ⅱ。
加氢合成甲醇是重要的利用途径。该工艺主要发生合成甲醇的反应Ⅰ和逆水汽变换反应Ⅱ。I.

II.
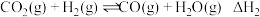
已知甲醇的选择性

(1)反应I能自发进行的条件是
(2)根据下表中的键能数据,计算
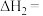
| 化学键 |  |  |  |  |
键能/ | 436 | 1071 | 464 | 803 |
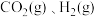 以物质的量浓度1∶3投料,甲醇的选择性为50%。已知初始
以物质的量浓度1∶3投料,甲醇的选择性为50%。已知初始 ,
, 平衡转化率为50%,则该条件下反应I的平衡常数
平衡转化率为50%,则该条件下反应I的平衡常数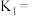
(4)已知催化剂表面金属能吸附
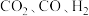 分子,反应I和II发生在催化剂表面的不同活性位点。在
分子,反应I和II发生在催化剂表面的不同活性位点。在 、
、 条件下,将原料气按照a、b、c、d四种方式以相同流速通过催化剂,测得各组分转化率(X)和选择性(S)如下表所示。
条件下,将原料气按照a、b、c、d四种方式以相同流速通过催化剂,测得各组分转化率(X)和选择性(S)如下表所示。原料气组成与转化率和选择性的关系
原料气(体积分数)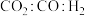 (%) (%) | 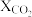 | 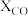 | 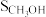 | 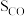 |
| (a)16∶0∶84 | 18 | 0 | 43 | 56 |
| (b)16∶0.6∶83.4 | 12 | 0 | 61 | 38 |
| (c)16∶2∶82 | 11 | 0 | 89 | 11 |
| (d)16∶4∶80 | 9 | 6.0 | 99 | 0 |
 体积分数越大,生成的甲醇
体积分数越大,生成的甲醇②根据上表数据,推测随着原料气中掺杂
 体积分数的增大,
体积分数的增大, 转化率迅速降低的原因是
转化率迅速降低的原因是③在催化剂作用下发生上述反应I、II,达平衡时
 的转化率随温度和压强的变化如右图所示,则
的转化率随温度和压强的变化如右图所示,则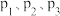 由大到小的顺序为
由大到小的顺序为 的平衡转化率呈现如图变化的原因是
的平衡转化率呈现如图变化的原因是
您最近一年使用:0次
解题方法
3 . 含碳化合物的合成与转化具有重要的研究价值和现实意义。由合成气(主要成分为 ,
, 和
和 )制甲醇,涉及的原理为:
)制甲醇,涉及的原理为:
①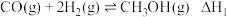
②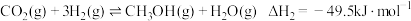
③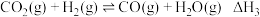
(1)反应①的
___________  ,该反应自发进行的条件为
,该反应自发进行的条件为___________ 。(填“高温”或“低温”)
(2)在 的恒压反应器中,按照
的恒压反应器中,按照 投料,测得体系中平衡时
投料,测得体系中平衡时 和
和 的选择性[
的选择性[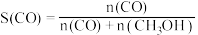 ,
, ]及
]及 的平衡转化率随温度的变化如图a所示。
的平衡转化率随温度的变化如图a所示。
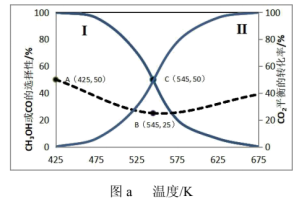
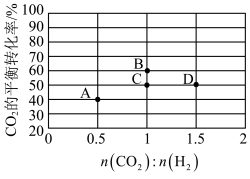
①曲线Ⅰ代表___________ 的选择性随温度变化曲线。
②反应③在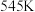 时的平衡常数
时的平衡常数
___________ 。(用分数表示)
(3)不同压强下,按照 投料,实验测得
投料,实验测得 的平衡转化率和
的平衡转化率和 的平衡产率随温度变化如图所示:
的平衡产率随温度变化如图所示:

已知: 的平衡产率
的平衡产率
①其中纵坐标表示 的平衡产率的是图
的平衡产率的是图___________ (填“b”或“c”),该图中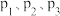 由大到小的顺序是
由大到小的顺序是___________ 。
②图c中, 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是___________ 。
 ,
, 和
和 )制甲醇,涉及的原理为:
)制甲醇,涉及的原理为:①
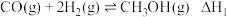
②
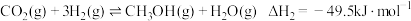
③
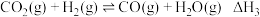
| 化学键 |  |  |  |  |  |
 | 436 | 343 | 1076 | 465 | 413 |

 ,该反应自发进行的条件为
,该反应自发进行的条件为(2)在
 的恒压反应器中,按照
的恒压反应器中,按照 投料,测得体系中平衡时
投料,测得体系中平衡时 和
和 的选择性[
的选择性[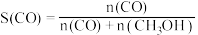 ,
, ]及
]及 的平衡转化率随温度的变化如图a所示。
的平衡转化率随温度的变化如图a所示。
①曲线Ⅰ代表
②反应③在
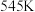 时的平衡常数
时的平衡常数
(3)不同压强下,按照
 投料,实验测得
投料,实验测得 的平衡转化率和
的平衡转化率和 的平衡产率随温度变化如图所示:
的平衡产率随温度变化如图所示:
已知:
 的平衡产率
的平衡产率
①其中纵坐标表示
 的平衡产率的是图
的平衡产率的是图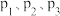 由大到小的顺序是
由大到小的顺序是②图c中,
 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是
您最近一年使用:0次
名校
解题方法
4 . 为实现碳中和,将 在一定条件下转化为化工原料,其中
在一定条件下转化为化工原料,其中 和
和 可发生如下两个平行反应:
可发生如下两个平行反应:
①

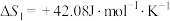
②

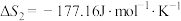
(1)根据所给信息,若要反应②自发进行,需要控制温度范围为_______ K(保留一位小数)。
(2)为了提高 的产率,理论上可采用的措施是
的产率,理论上可采用的措施是_______ (填标号)。
A.低温低压 B.高温低压 C.合适的催化剂 D.高温高压 E.低温高压
(3)将 和
和 按物质的量之比
按物质的量之比 通入刚性密闭容器中,在催化剂作用下发生反应①和反应②,在相同的时间内
通入刚性密闭容器中,在催化剂作用下发生反应①和反应②,在相同的时间内 的选择性和产率随温度的变化如下表所示。已知:X代表
的选择性和产率随温度的变化如下表所示。已知:X代表 的选择性
的选择性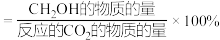 Y代表甲醇的产率%
Y代表甲醇的产率%
①在上述条件下合成甲醇的工业条件是_______ 。
A.483K B.503K C.催化剂 D.催化剂
D.催化剂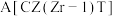
②503K以上,升高温度导致 的转化率增大,甲醇的产率降低。可能的原因是
的转化率增大,甲醇的产率降低。可能的原因是_______ 。
(4)在容器体积不变的条件下,下列说法中,能判断反应②达到平衡状态的有_______ (填标号)。
A.混合气体总压强不再变化
B.断裂3molH—H键的同时断裂2molO—H键
C. 和
和 的物质的量之比不再变化
的物质的量之比不再变化
D.混合气体的平均相对分子质量不再变化
E.混合气体的密度不再变化
F.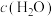 保持不变
保持不变
(5)若体积不变的密闭容器中只发生上述反应①,在进气比 不同、温度不同时,测得相应的
不同、温度不同时,测得相应的 平衡转化率如图所示。则B和D两点的温度
平衡转化率如图所示。则B和D两点的温度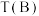
_______ 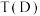 (选填“<”,“>”,或“=”),其原因是
(选填“<”,“>”,或“=”),其原因是_______ 。
 在一定条件下转化为化工原料,其中
在一定条件下转化为化工原料,其中 和
和 可发生如下两个平行反应:
可发生如下两个平行反应:①


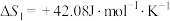
②


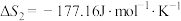
(1)根据所给信息,若要反应②自发进行,需要控制温度范围为
(2)为了提高
 的产率,理论上可采用的措施是
的产率,理论上可采用的措施是A.低温低压 B.高温低压 C.合适的催化剂 D.高温高压 E.低温高压
(3)将
 和
和 按物质的量之比
按物质的量之比 通入刚性密闭容器中,在催化剂作用下发生反应①和反应②,在相同的时间内
通入刚性密闭容器中,在催化剂作用下发生反应①和反应②,在相同的时间内 的选择性和产率随温度的变化如下表所示。已知:X代表
的选择性和产率随温度的变化如下表所示。已知:X代表 的选择性
的选择性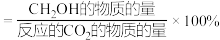 Y代表甲醇的产率%
Y代表甲醇的产率%| 温度/K | 催化剂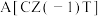 | 催化剂 | ||
| X(甲醇选择性) | Y(甲醇产率) | X(甲醇选择性) | Y(甲醇产率) | |
| 483 | 38 | 2 | 19 | 0.9 |
| 503 | 26 | 4.5 | 33 | 2.2 |
| 523 | 23 | 3.9 | 30 | 1.9 |
| 543 | 18 | 3 | 25 | 1.8 |
| 563 | 16 | 3 | 25 | 1.6 |
A.483K B.503K C.催化剂
 D.催化剂
D.催化剂
②503K以上,升高温度导致
 的转化率增大,甲醇的产率降低。可能的原因是
的转化率增大,甲醇的产率降低。可能的原因是(4)在容器体积不变的条件下,下列说法中,能判断反应②达到平衡状态的有
A.混合气体总压强不再变化
B.断裂3molH—H键的同时断裂2molO—H键
C.
 和
和 的物质的量之比不再变化
的物质的量之比不再变化D.混合气体的平均相对分子质量不再变化
E.混合气体的密度不再变化
F.
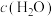 保持不变
保持不变(5)若体积不变的密闭容器中只发生上述反应①,在进气比
 不同、温度不同时,测得相应的
不同、温度不同时,测得相应的 平衡转化率如图所示。则B和D两点的温度
平衡转化率如图所示。则B和D两点的温度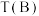
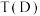 (选填“<”,“>”,或“=”),其原因是
(选填“<”,“>”,或“=”),其原因是
您最近一年使用:0次
2023-05-06更新
|
556次组卷
|
2卷引用:辽宁省2023届高三第二次全省统考化学试题
名校
5 . 在一定温度下的密闭容器中发生反应: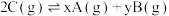 ,平衡时测得A的浓度为0.50mol/L。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断不正确的是
,平衡时测得A的浓度为0.50mol/L。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断不正确的是
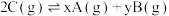 ,平衡时测得A的浓度为0.50mol/L。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断不正确的是
,平衡时测得A的浓度为0.50mol/L。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断不正确的是A.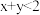 | B.平衡向正反应方向移动 |
| C.C的转化率增大 | D.B的体积分数增大 |
您最近一年使用:0次
2022-10-29更新
|
284次组卷
|
3卷引用:辽宁省沈阳市外国语学校2023-2024学年高二10月月考化学试题
名校
6 . 如图所示,三个烧瓶中分别充满NO2气体并分别装在盛有水的三个烧杯中,在①烧杯中加入CaO,在②烧杯中不加其他任何物质,在③烧杯中加入NH4Cl晶体,发现①中红棕色变深,③中红棕色变浅。已知:2NO2(红棕色) N2O4(无色),下列叙述正确的是
N2O4(无色),下列叙述正确的是
 N2O4(无色),下列叙述正确的是
N2O4(无色),下列叙述正确的是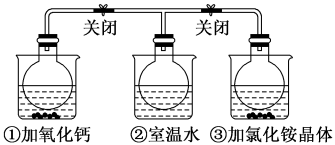
A.2NO2 N2O4是吸热反应 N2O4是吸热反应 |
| B.NH4Cl溶于水时吸收热量 |
| C.①烧瓶中平衡时混合气体的平均相对分子质量增大 |
| D.③烧瓶中气体的压强增大 |
您最近一年使用:0次
2022-08-28更新
|
1134次组卷
|
23卷引用:【全国百强校】辽宁省鞍山市第一中学2018-2019学年高二下学期开学考试化学试题
【全国百强校】辽宁省鞍山市第一中学2018-2019学年高二下学期开学考试化学试题(已下线)2010年北京市八一中学高二第二学期期末考试化学试卷2018版化学(苏教版)高考总复习专题七课时跟踪训练--化学平衡的移动新疆生产建设兵团第二中学2017-2018学年高二上学期第四次月考(期末)化学试题新疆自治区生产建设兵团第二中学2018-2019学年高二第一次月考化学试题陕西省延安市第一中学2019-2020学年高二上学期期中考试化学试题(已下线)专题7.2 化学平衡状态 化学平衡移动(练)-《2020年高考一轮复习讲练测》云南省普洱市江城县第一中学2019—2020学年高二上学期期末考试化学试题四川省泸州市泸县第二中学2019-2020学年高二下学期第一次在线月考化学试题黑龙江省大庆市第四中学2019-2020学年高二上学期第一次检测化学试题(已下线)2.3.2+影响化学平衡状态的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)安徽省蚌埠田家炳中学2020-2021学年高二10月月考化学试题江西省上饶市2020-2021学年高二上学期期末教学质量测试化学试题江西省赣州市第一中学2020-2021学年高二下学期开学测试化学试题河南省信阳高级中学2020-2021学年高二下学期回顾测试化学试题福建省三明第一中学2021-2022学年高二上学期第一次月考化学试题福建省莆田市擢英中学2021-2022学年高二上学期第一次月考化学试卷(已下线)2.2.2 浓度商、温度对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题广东省深圳市宝安区宝安中学2022-2023学年高一上学期期中考试化学试题新疆奇台县第一中学2022-2023学年高二上学期期中考试化学试题山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题(已下线)选择题11-15
名校
解题方法
7 . 以CO和CO2为原料合成乙烯、二甲醚(CH3OCH3)等有机物,一直是当前化学领域研究的热点。回答下列问题:
(1)已知相关物质能量变化示意图如下:
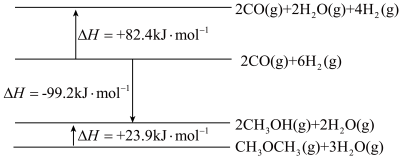
①写出由CO(g)和H2(g)反应生成CH3OCH3(g)和H2O(g)的热化学方程式:_______ 。
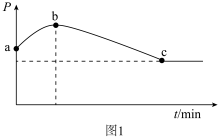
②在一绝热的恒容密闭容器中,通入CO和H2(物质的量之比1 :2)发生反应2CO(g)+4H2(g) C2H4(g) +2H2O(g) ΔH<0,反应过程中容器内压强(p)与时间(t)变化如图1所示,随着反应进行,a~b段压强增大的原因是
C2H4(g) +2H2O(g) ΔH<0,反应过程中容器内压强(p)与时间(t)变化如图1所示,随着反应进行,a~b段压强增大的原因是_______ 。
③CO2与H2催化重整制备CH3OCH3的过程中存在反应:
Ⅰ.2CO2(g) + 6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
Ⅱ.CO2(g) +H2(g) CO(g) + H2O(g)。
CO(g) + H2O(g)。
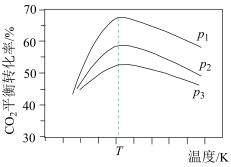
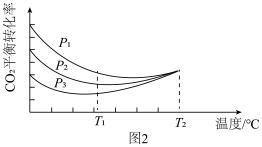
向密闭容器中以物质的量之比为1:3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图2所示。p1、p2、p3由大小的顺序为_______ ;T2℃时主要发生反应_______ (填“Ⅰ”或“Ⅱ”),平衡转化率随温度变化先降后升的原因为_______ 。
(2)一定温度和压强为3. 3p MPa条件下,将CO和H2按物质的量之比为2: 3通入密闭弹性容器中发生催化反应,假设只发生反应:3CO(g) + 3H2 (g) CH3OCH3(g)+CO2(g) 、2CO(g) + 4H2(g)
CH3OCH3(g)+CO2(g) 、2CO(g) + 4H2(g)  C2H4(g) + 2H2O(g)。平衡时,CO平衡转化率为60%,C2H4选择性为50%(C2H4的选择性=
C2H4(g) + 2H2O(g)。平衡时,CO平衡转化率为60%,C2H4选择性为50%(C2H4的选择性=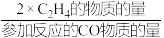 )。该温度下。反应C2H4(g)+ 2H2O(g)
)。该温度下。反应C2H4(g)+ 2H2O(g)  2CO(g) +4H2(g)的Kp=
2CO(g) +4H2(g)的Kp=_______ MPa3(用含字母p的代数式表示,已知Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替),若要提高C2H4的选择性,则应考虑的因素是_______ 。
(1)已知相关物质能量变化示意图如下:

①写出由CO(g)和H2(g)反应生成CH3OCH3(g)和H2O(g)的热化学方程式:
②在一绝热的恒容密闭容器中,通入CO和H2(物质的量之比1 :2)发生反应2CO(g)+4H2(g)
 C2H4(g) +2H2O(g) ΔH<0,反应过程中容器内压强(p)与时间(t)变化如图1所示,随着反应进行,a~b段压强增大的原因是
C2H4(g) +2H2O(g) ΔH<0,反应过程中容器内压强(p)与时间(t)变化如图1所示,随着反应进行,a~b段压强增大的原因是
③CO2与H2催化重整制备CH3OCH3的过程中存在反应:
Ⅰ.2CO2(g) + 6H2(g)
 CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);Ⅱ.CO2(g) +H2(g)
 CO(g) + H2O(g)。
CO(g) + H2O(g)。向密闭容器中以物质的量之比为1:3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图2所示。p1、p2、p3由大小的顺序为

(2)一定温度和压强为3. 3p MPa条件下,将CO和H2按物质的量之比为2: 3通入密闭弹性容器中发生催化反应,假设只发生反应:3CO(g) + 3H2 (g)
 CH3OCH3(g)+CO2(g) 、2CO(g) + 4H2(g)
CH3OCH3(g)+CO2(g) 、2CO(g) + 4H2(g)  C2H4(g) + 2H2O(g)。平衡时,CO平衡转化率为60%,C2H4选择性为50%(C2H4的选择性=
C2H4(g) + 2H2O(g)。平衡时,CO平衡转化率为60%,C2H4选择性为50%(C2H4的选择性=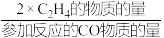 )。该温度下。反应C2H4(g)+ 2H2O(g)
)。该温度下。反应C2H4(g)+ 2H2O(g)  2CO(g) +4H2(g)的Kp=
2CO(g) +4H2(g)的Kp=
您最近一年使用:0次
2022-07-29更新
|
289次组卷
|
3卷引用:辽宁省朝阳市凌源市实验中学2022-2023学年高二上学期12月月考化学试题
解题方法
8 . 研发二氧化碳利用技术,已成为世界科学领域研究的热点。请回答下列问题:
Ⅰ.二氧化碳催化加氢制甲醇,不仅有利于降低空气中二氧化碳含量,同时可以制备清洁能源,其总反应可表示为: 。
。
(1)一定温度下,此反应的反应历程与体系能量变化关系如图1所示,则第二步反应的热化学方程式为_______ 。

(2)第一步反应的正反应速率方程为 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中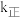 、
、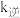 分别为正、逆反应的速率常数,只受温度影响。
分别为正、逆反应的速率常数,只受温度影响。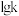 与
与 (温度的倒数)的关系如图2所示,①、②、③、④四条斜线中,表示
(温度的倒数)的关系如图2所示,①、②、③、④四条斜线中,表示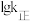 的是
的是_______ 。图中A、B、C、D点的纵坐标分别为a+2、a+1、a-1、a-2,则温度为 时,第一步反应的化学平衡常数
时,第一步反应的化学平衡常数
_______ 。

(3)总反应在起始物质的量 时,不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在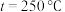 时
时 随压强(P)的变化及在
随压强(P)的变化及在 时
时 随温度(t)的变化如图所示。
随温度(t)的变化如图所示。

①图中对应等温过程的曲线是_______ (填“a”或“b”),判断的理由是_______ 。
②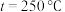 时,当
时,当 时,
时, 的平衡转化率为
的平衡转化率为_______  (保留小数点后一位)。
(保留小数点后一位)。
Ⅱ.我国科学家以Bi为电极,在酸性水溶液中实现电催化还原,两种途径的反应机理如图所示,其中 表示过渡态、数字表示微粒的相对总能量。
表示过渡态、数字表示微粒的相对总能量。

(4)途径一, 电还原经两步反应生成
电还原经两步反应生成 :第一步为
:第一步为 (*表示微粒与
(*表示微粒与 的接触位点):第二步为
的接触位点):第二步为_______ 。
(5) 电还原的选择性以途径一为主,理由是
电还原的选择性以途径一为主,理由是_______ 。
Ⅰ.二氧化碳催化加氢制甲醇,不仅有利于降低空气中二氧化碳含量,同时可以制备清洁能源,其总反应可表示为:
 。
。(1)一定温度下,此反应的反应历程与体系能量变化关系如图1所示,则第二步反应的热化学方程式为

(2)第一步反应的正反应速率方程为
 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中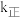 、
、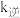 分别为正、逆反应的速率常数,只受温度影响。
分别为正、逆反应的速率常数,只受温度影响。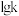 与
与 (温度的倒数)的关系如图2所示,①、②、③、④四条斜线中,表示
(温度的倒数)的关系如图2所示,①、②、③、④四条斜线中,表示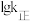 的是
的是 时,第一步反应的化学平衡常数
时,第一步反应的化学平衡常数

(3)总反应在起始物质的量
 时,不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在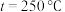 时
时 随压强(P)的变化及在
随压强(P)的变化及在 时
时 随温度(t)的变化如图所示。
随温度(t)的变化如图所示。
①图中对应等温过程的曲线是
②
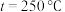 时,当
时,当 时,
时, 的平衡转化率为
的平衡转化率为 (保留小数点后一位)。
(保留小数点后一位)。Ⅱ.我国科学家以Bi为电极,在酸性水溶液中实现电催化还原,两种途径的反应机理如图所示,其中
 表示过渡态、数字表示微粒的相对总能量。
表示过渡态、数字表示微粒的相对总能量。
(4)途径一,
 电还原经两步反应生成
电还原经两步反应生成 :第一步为
:第一步为 (*表示微粒与
(*表示微粒与 的接触位点):第二步为
的接触位点):第二步为(5)
 电还原的选择性以途径一为主,理由是
电还原的选择性以途径一为主,理由是
您最近一年使用:0次
2022-04-22更新
|
711次组卷
|
3卷引用:辽宁省锦州市2022届高三第一次质量检测化学试题
名校
9 . 温度为T℃,向初始体积均为1L的两个密闭容器甲(恒容)、乙(恒压)中分别加入3molA和3molB发生反应:A(g)+B(g) xC(g),实验测得甲、乙两容器中A的转化率随时间变化如图所示。下列说法正确的是
xC(g),实验测得甲、乙两容器中A的转化率随时间变化如图所示。下列说法正确的是
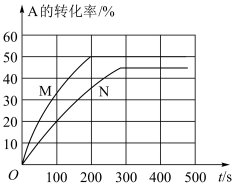
 xC(g),实验测得甲、乙两容器中A的转化率随时间变化如图所示。下列说法正确的是
xC(g),实验测得甲、乙两容器中A的转化率随时间变化如图所示。下列说法正确的是
| A.N为容器乙 |
| B.x等于或大于3 |
| C.平衡时,容器乙中C的浓度为2mol/L |
| D.N的平衡常数等于0.25 |
您最近一年使用:0次
10 . 在一密闭容器中,反应 aA(g) bB(g)+cC(s)达平衡后容器体积为 2L,保持温度不变,将容器的体积由2L 变为3L,当达到新的平衡时,B 的浓度是原来的 50%,下列说法正确的是
bB(g)+cC(s)达平衡后容器体积为 2L,保持温度不变,将容器的体积由2L 变为3L,当达到新的平衡时,B 的浓度是原来的 50%,下列说法正确的是
 bB(g)+cC(s)达平衡后容器体积为 2L,保持温度不变,将容器的体积由2L 变为3L,当达到新的平衡时,B 的浓度是原来的 50%,下列说法正确的是
bB(g)+cC(s)达平衡后容器体积为 2L,保持温度不变,将容器的体积由2L 变为3L,当达到新的平衡时,B 的浓度是原来的 50%,下列说法正确的是| A.平衡向正反应方向移动 | B.物质C 的浓度减小 |
| C.物质B 的质量分数增加 | D.体系的熵增大 |
您最近一年使用:0次



