名校
1 . 现有反应:mA(g)+nB(g)  pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_______ 热反应,且m+n ______ p (填“>”、“<”或“=”)。
(2)减压时,A 的质量分数_______ (填“增大”、“减小”或“不变”,下同)。
(3)若加入 B(体积不变),则A的转化率__________ 。
(4)若升高温度,则平衡时B、C的浓度之比[B]/[C]将_______ 。
(5)若加入催化剂,平衡时气体混合物的总物质的量_______ 。
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:(1)该反应的逆反应为
(2)减压时,A 的质量分数
(3)若加入 B(体积不变),则A的转化率
(4)若升高温度,则平衡时B、C的浓度之比[B]/[C]将
(5)若加入催化剂,平衡时气体混合物的总物质的量
您最近半年使用:0次
2023-02-07更新
|
240次组卷
|
7卷引用:吉林省吉化第一高级中学校2019-2020学年高二9月月考化学试题
名校
2 . 在一定体积的密闭容器中,进行如下化学反应: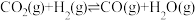 ,其化学平衡常数K和温度T的关系如表所示,回答下列问题:
,其化学平衡常数K和温度T的关系如表所示,回答下列问题:
(1)该反应的化学平衡常数表达式为K=___________ 。该反应为___________ (填“吸热”或“放热”)反应。下列说法能说明该反应已达到化学平衡状态的是___________
A. B.
B. 与CO的浓度相等
与CO的浓度相等
C.气体颜色不变 D. 的体积分数不再改变
的体积分数不再改变
(2)某温度下,平衡浓度符合下式: ,试判断此时的温度为
,试判断此时的温度为________ ℃。该温度下加入 和
和 ,充分反应,达到平衡时,
,充分反应,达到平衡时, 的转化率为
的转化率为________ 。反应平衡后,压缩容器体积, 的转化率
的转化率________ (填“增大”、“减小”或“不变”)。
(3)800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为 为2mol/L,
为2mol/L,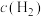 为1.5mo/L,c(CO)为1mol/L,
为1.5mo/L,c(CO)为1mol/L,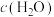 为3mol/L,则反应
为3mol/L,则反应_________ (填“正向进行”“逆向进行”或“处于平衡状态”)。
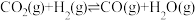 ,其化学平衡常数K和温度T的关系如表所示,回答下列问题:
,其化学平衡常数K和温度T的关系如表所示,回答下列问题:| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
A.
 B.
B. 与CO的浓度相等
与CO的浓度相等C.气体颜色不变 D.
 的体积分数不再改变
的体积分数不再改变(2)某温度下,平衡浓度符合下式:
 ,试判断此时的温度为
,试判断此时的温度为 和
和 ,充分反应,达到平衡时,
,充分反应,达到平衡时, 的转化率为
的转化率为 的转化率
的转化率(3)800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为
 为2mol/L,
为2mol/L,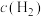 为1.5mo/L,c(CO)为1mol/L,
为1.5mo/L,c(CO)为1mol/L,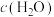 为3mol/L,则反应
为3mol/L,则反应
您最近半年使用:0次
名校
解题方法
3 . 合成氨工业对国民经济和社会发展具有重要的意义,其原理为: ,在不同温度、压强和相同催化剂条件下,初始
,在不同温度、压强和相同催化剂条件下,初始 分别为
分别为 、
、 时,平衡后混合物中氨的体积分数(α)如图所示:
时,平衡后混合物中氨的体积分数(α)如图所示:

回答以下问题:
(1)其中,p1、p2和p3由大到小的顺序是___________ ,其原因是___________ 。
(2)①若分别用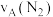 和
和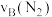 表示从反应开始至达平衡状态A、B时的化学反应速率,则
表示从反应开始至达平衡状态A、B时的化学反应速率,则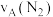
___________ 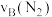 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②若在250℃、p1条件下,反应达到平衡时容器的体积为1L,则该条件下合成氨的平衡常数K=___________ 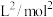 (列出计算式即可)。
(列出计算式即可)。
(3)合成氨反应在催化剂作用下的反应历程为(*表示吸附态):
第一步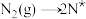 ;
; (慢反应)
(慢反应)
第二步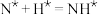 ;
; ;
;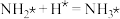 (快反应)
(快反应)
第三步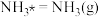 (快反应)
(快反应)
比较第一步反应的活化能E1与第二步反应的活化能E2的大小:E1___________ E2(填“>”“<”或“=”)。
(4)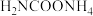 是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应:
是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应: ,能说明该反应达到平衡状态的是
,能说明该反应达到平衡状态的是___________ (填序号)。
①混合气体的压强不变
②混合气体的密度不变
③混合气体的总物质的量不变
④混合气体的平均相对分子质量不变
⑤ 的体积分数不变
的体积分数不变
 ,在不同温度、压强和相同催化剂条件下,初始
,在不同温度、压强和相同催化剂条件下,初始 分别为
分别为 、
、 时,平衡后混合物中氨的体积分数(α)如图所示:
时,平衡后混合物中氨的体积分数(α)如图所示:
回答以下问题:
(1)其中,p1、p2和p3由大到小的顺序是
(2)①若分别用
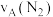 和
和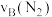 表示从反应开始至达平衡状态A、B时的化学反应速率,则
表示从反应开始至达平衡状态A、B时的化学反应速率,则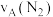
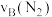 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②若在250℃、p1条件下,反应达到平衡时容器的体积为1L,则该条件下合成氨的平衡常数K=
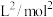 (列出计算式即可)。
(列出计算式即可)。(3)合成氨反应在催化剂作用下的反应历程为(*表示吸附态):
第一步
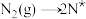 ;
; (慢反应)
(慢反应)第二步
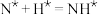 ;
; ;
;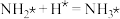 (快反应)
(快反应)第三步
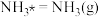 (快反应)
(快反应)比较第一步反应的活化能E1与第二步反应的活化能E2的大小:E1
(4)
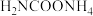 是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应:
是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应: ,能说明该反应达到平衡状态的是
,能说明该反应达到平衡状态的是①混合气体的压强不变
②混合气体的密度不变
③混合气体的总物质的量不变
④混合气体的平均相对分子质量不变
⑤
 的体积分数不变
的体积分数不变
您最近半年使用:0次
2022-01-14更新
|
568次组卷
|
3卷引用:贵州省黔西南顶效开发区顶兴学校2021-2022学年高二下学期入学考试化学试题
名校
4 . 工业上,裂解正丁烷可以获得乙烯、丙烯等化工原料。
反应1: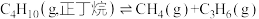

反应2: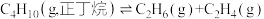

已知几种共价键的键能如下表:
(1)根据上述数据估算, =
=_______ kJ·mol-1。
(2)正丁烷和异丁烷之间转化的能量变化如图所示。
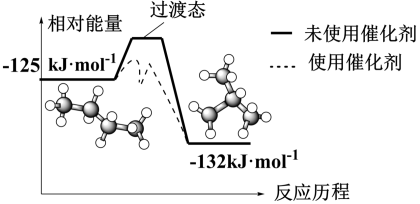
①正丁烷气体转化成异丁烷气体的热化学方程式为_______ 。
②下列有关催化剂的叙述错误的是_______ (填标号)。
A.能改变反应途径 B.能降低反应焓变
C.能加快反应速率 D.能增大平衡常数
(3)向密闭容器中投入一定量的正丁烷,发生反应1和反应2,测得正丁烷的平衡转化率(α)与压强(p)、温度(T)的关系如图所示。
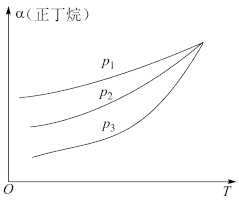
① 、
、 、
、 由小到大的顺序为
由小到大的顺序为_______ 。
②随着温度升高,三种不同压强下正丁烷的平衡转化率趋向相等,原因是_______ 。
(4)在一定温度下,向密闭容器中投入正丁烷,同时发生反应1和反应2。测得部分物质的浓度与时间的关系如图,平衡时压强为17akPa。
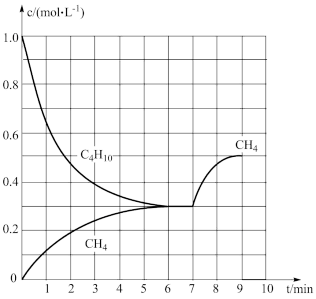
①7min时改变的条件可能是_______ (填标号)。
A.增大压强 B.增大正丁烷的浓度 C.加入催化剂
②该温度下,反应1的平衡常数
_______ kPa。(提示:组分分压=总压×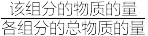 )
)
(5)以惰性材料为电极,正丁烷、空气在熔融盐(以MCO3为电解质)中构成的燃料电池的能量转化率高,通入空气的电极为_______ (填“正极”或“负极”)。
反应1:
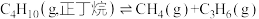

反应2:
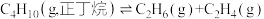

已知几种共价键的键能如下表:
| 共价键 | C—H |  | C—C |
| 键能/(kJ·mol-1) | 413 | 614 | 347 |
(1)根据上述数据估算,
 =
=(2)正丁烷和异丁烷之间转化的能量变化如图所示。

①正丁烷气体转化成异丁烷气体的热化学方程式为
②下列有关催化剂的叙述错误的是
A.能改变反应途径 B.能降低反应焓变
C.能加快反应速率 D.能增大平衡常数
(3)向密闭容器中投入一定量的正丁烷,发生反应1和反应2,测得正丁烷的平衡转化率(α)与压强(p)、温度(T)的关系如图所示。

①
 、
、 、
、 由小到大的顺序为
由小到大的顺序为②随着温度升高,三种不同压强下正丁烷的平衡转化率趋向相等,原因是
(4)在一定温度下,向密闭容器中投入正丁烷,同时发生反应1和反应2。测得部分物质的浓度与时间的关系如图,平衡时压强为17akPa。

①7min时改变的条件可能是
A.增大压强 B.增大正丁烷的浓度 C.加入催化剂
②该温度下,反应1的平衡常数

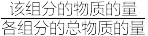 )
)(5)以惰性材料为电极,正丁烷、空气在熔融盐(以MCO3为电解质)中构成的燃料电池的能量转化率高,通入空气的电极为
您最近半年使用:0次
2021-12-03更新
|
884次组卷
|
10卷引用:浙江省舟山市普陀中学2023届高三返校考试化学试题
浙江省舟山市普陀中学2023届高三返校考试化学试题广东省2021-2022学年高三11月联考化学试题河南省名校联盟2021-2022学年高三上学期11月联考化学试题湖南省百所学校大联考2021-2022学年高三11月联考化学试题(已下线)第19周 晚练题-备战2022年高考化学周测与晚练(新高考专用)(已下线)押新高考卷17题 化学反应原理综合题-备战2022年高考化学临考题号押题(新高考通版)辽宁省抚顺市第二中学2022届高三下学期高考预测化学试题河北省保定市部分学校2021-2022学年高三上学期期中考试化学试题广东省韶关市2021-2022学年高三上学期期中考试化学试题(已下线)专题十 化学能与热能-实战高考·二轮复习核心突破
5 . 大气中二氧化碳浓度不断攀升,带来一系列全球性环境问题,如何实现二氧化碳的高效利用、最终实现碳中和,对人类未来的可持续发展至关重要。
(1)CO2可作为单体转化为烃进行二次利用。
已知:①CO2(g)+4H2(g) CH4(g)+2H2O(g) △H=-166.84kJ·mol-1
CH4(g)+2H2O(g) △H=-166.84kJ·mol-1
②2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H=-268.65kJ·mol-1
C2H4(g)+4H2O(g) △H=-268.65kJ·mol-1
③3CO2(g)+10H2(g) C3H8(g)+6H2O(g) △H=-131.505kJ·mol-1
C3H8(g)+6H2O(g) △H=-131.505kJ·mol-1
则丙烷裂解生成甲烷和乙烯的热化学方程式为___ 。
(2)催化CO2加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。某实验小组采用电导法测定乙酸的电离平衡常数Kc,已知电离度α=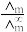 ,
, 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,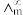 为无限稀释时溶液的摩尔电导率,
为无限稀释时溶液的摩尔电导率,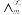 =0.045S·m2·mol-1(T=308.2K),实验测定T=308.2K时,0.01mol·L-1乙酸的
=0.045S·m2·mol-1(T=308.2K),实验测定T=308.2K时,0.01mol·L-1乙酸的 为0.002S·m2·mol-1,则该条件下测定的乙酸的电离平衡常数Kc为
为0.002S·m2·mol-1,则该条件下测定的乙酸的电离平衡常数Kc为___ (列出计算式)。
(3)碳酸二乙酯(DEC)为一种非常重要的有机化工原料,以乙醇和CO2为原料直接合成DEC有很大的经济和环保意义。2C2H5OH(g)+CO2(g) C2H5O(CO)OC2H5(DEC)(g)+H2O(g),恒压条件下向该容器中充入一定量的Ar气体,反应物平衡转化率
C2H5O(CO)OC2H5(DEC)(g)+H2O(g),恒压条件下向该容器中充入一定量的Ar气体,反应物平衡转化率___ (填“增大”“减小”或“不变”),某温度下向恒容密闭容器中按照系数比投料时,平衡前后压强比为6∶5,平衡时压强为p0kPa,则平衡常数Kp=___ 。
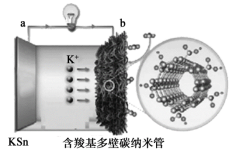
(4)某科研团队将K—CO2电池中活泼的钾金属电极材料替换成KSn合金开发了稳定高效的可遵循环电池,实现了CO2再利用。研究发现正极电极产物有碳酸盐和碳,则该CO2应在电池哪一侧充入___ (填“a”或“b”),正极电极反应式为___ 。
(5)在Zn或Zn—Cu催化作用下均可发生反应CO2(g)+H2(g) CO(g)+H2O(g);已知Zn作催化剂时,该反应的活化能大于Zn—Cu作催化剂时反应的活化能,则
CO(g)+H2O(g);已知Zn作催化剂时,该反应的活化能大于Zn—Cu作催化剂时反应的活化能,则___ (填“Zn”或“Zn—Cu”)作催化剂时,该反应的反应速率更快。
(1)CO2可作为单体转化为烃进行二次利用。
已知:①CO2(g)+4H2(g)
 CH4(g)+2H2O(g) △H=-166.84kJ·mol-1
CH4(g)+2H2O(g) △H=-166.84kJ·mol-1②2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) △H=-268.65kJ·mol-1
C2H4(g)+4H2O(g) △H=-268.65kJ·mol-1③3CO2(g)+10H2(g)
 C3H8(g)+6H2O(g) △H=-131.505kJ·mol-1
C3H8(g)+6H2O(g) △H=-131.505kJ·mol-1则丙烷裂解生成甲烷和乙烯的热化学方程式为
(2)催化CO2加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。某实验小组采用电导法测定乙酸的电离平衡常数Kc,已知电离度α=
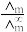 ,
, 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,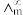 为无限稀释时溶液的摩尔电导率,
为无限稀释时溶液的摩尔电导率,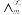 =0.045S·m2·mol-1(T=308.2K),实验测定T=308.2K时,0.01mol·L-1乙酸的
=0.045S·m2·mol-1(T=308.2K),实验测定T=308.2K时,0.01mol·L-1乙酸的 为0.002S·m2·mol-1,则该条件下测定的乙酸的电离平衡常数Kc为
为0.002S·m2·mol-1,则该条件下测定的乙酸的电离平衡常数Kc为(3)碳酸二乙酯(DEC)为一种非常重要的有机化工原料,以乙醇和CO2为原料直接合成DEC有很大的经济和环保意义。2C2H5OH(g)+CO2(g)
 C2H5O(CO)OC2H5(DEC)(g)+H2O(g),恒压条件下向该容器中充入一定量的Ar气体,反应物平衡转化率
C2H5O(CO)OC2H5(DEC)(g)+H2O(g),恒压条件下向该容器中充入一定量的Ar气体,反应物平衡转化率(4)某科研团队将K—CO2电池中活泼的钾金属电极材料替换成KSn合金开发了稳定高效的可遵循环电池,实现了CO2再利用。研究发现正极电极产物有碳酸盐和碳,则该CO2应在电池哪一侧充入

(5)在Zn或Zn—Cu催化作用下均可发生反应CO2(g)+H2(g)
 CO(g)+H2O(g);已知Zn作催化剂时,该反应的活化能大于Zn—Cu作催化剂时反应的活化能,则
CO(g)+H2O(g);已知Zn作催化剂时,该反应的活化能大于Zn—Cu作催化剂时反应的活化能,则
您最近半年使用:0次
名校
解题方法
6 . 现有反应:mA(g)+nB(g)⇌pC(g),达到平衡后,当升高温度时,B的转化率变小;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_______ 热反应,(填“吸”或“放”)且m+n_______ p(填“>”“=”“<”)。
(2)减压时,A的质量分数_______ 。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_______ ,B的转化率_______ 。
(4)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______ ;而维持容器内压强不变,充入氖气时,混合物颜色_______ (填“变深”“变浅”或“不变”)。
(1)该反应的逆反应为
(2)减压时,A的质量分数
(3)若加入B(体积不变),则A的转化率
(4)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色
您最近半年使用:0次
2021-06-23更新
|
278次组卷
|
3卷引用:江西省赣州市信丰中学2020-2021学年高二上学期入学考试化学试题
江西省赣州市信丰中学2020-2021学年高二上学期入学考试化学试题(已下线)第二章 第三节化学平衡(第2课时 化学平衡的影响因素)(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(原卷版)吉林省长春市希望高中2021-2022学年高二上学期期中考试化学试题
7 . 化学平衡移动原理:
(1)增大反应物浓度或减少生成物浓度,平衡___________ 移动;
(2)升高温度,平衡_________ 移动;
(3)增大压强,平衡______ 移动;
(4)使用催化剂,平衡_________ 移动。
(1)增大反应物浓度或减少生成物浓度,平衡
(2)升高温度,平衡
(3)增大压强,平衡
(4)使用催化剂,平衡
您最近半年使用:0次
8 . 在密闭容器内使3molH2和1molN2混合发生下列反应:3H2+N2 2NH3 △H<0(下列空格选填“向正反应方向”“向逆反应方向”“不”)
2NH3 △H<0(下列空格选填“向正反应方向”“向逆反应方向”“不”)
(1)当达到平衡时,保持体积不变,升高温度,平衡将_______ 移动。
(2)当达到平衡时,充入Ar气,并保持体积不变,平衡将_______ 移动。
(3)当达到平衡时,充入Ar气,并保持压强不变,平衡将______ 移动。
(4)当达到平衡时,充入N2并保持体积不变,平衡将________ 移动。
 2NH3 △H<0(下列空格选填“向正反应方向”“向逆反应方向”“不”)
2NH3 △H<0(下列空格选填“向正反应方向”“向逆反应方向”“不”)(1)当达到平衡时,保持体积不变,升高温度,平衡将
(2)当达到平衡时,充入Ar气,并保持体积不变,平衡将
(3)当达到平衡时,充入Ar气,并保持压强不变,平衡将
(4)当达到平衡时,充入N2并保持体积不变,平衡将
您最近半年使用:0次
名校
解题方法
9 . 恒温、恒压下,在一个容积可变的容器中发生如下反应:A(g)+B(g)⇌C(g)
(1)若开始时放入1 mol A和1 mol B,达到平衡后,生成amol C,这时A的物质的量为__ mol。
(2)若开始时放入3 mol A和3 mol B,达到平衡后,生成C的物质的量为__ mol
(3)若开始时放入xmol A、2 mol B和1 mol C,达到平衡后,A和C的物质的量分别为ymol和3amol,则x=__ ,y=__ 。平衡时,B的物质的量__ (填编号)。
A.大于2 mol B.等于2 mol C.小于2 mol D.可能大于、等于或小于2 mol
(4)若在(3)的平衡混合物中再加入3 mol C,待再次达到平衡后,C的物质的量分数是__ 。
(5)若维持温度不变,在一个与反应前起始体积相同,且容积固定的容器中发生上述反应。开始时放入1 mol A和1 mol B到达平衡后生成bmol C。将b与(1)小题中的a进行比较__ (填编号)。作出此判断的理由是__ 。
A.a>b B.a<b C.a=b D.不能比较a和b的大小。
(1)若开始时放入1 mol A和1 mol B,达到平衡后,生成amol C,这时A的物质的量为
(2)若开始时放入3 mol A和3 mol B,达到平衡后,生成C的物质的量为
(3)若开始时放入xmol A、2 mol B和1 mol C,达到平衡后,A和C的物质的量分别为ymol和3amol,则x=
A.大于2 mol B.等于2 mol C.小于2 mol D.可能大于、等于或小于2 mol
(4)若在(3)的平衡混合物中再加入3 mol C,待再次达到平衡后,C的物质的量分数是
(5)若维持温度不变,在一个与反应前起始体积相同,且容积固定的容器中发生上述反应。开始时放入1 mol A和1 mol B到达平衡后生成bmol C。将b与(1)小题中的a进行比较
A.a>b B.a<b C.a=b D.不能比较a和b的大小。
您最近半年使用:0次
2020-03-05更新
|
282次组卷
|
4卷引用:云南省开远市第一中学校2021-2022学年高二下学期开学考试化学试题
云南省开远市第一中学校2021-2022学年高二下学期开学考试化学试题云南省昆明市寻甸县第三中学2019-2020学年高二上学期期末考试化学(已下线)专题26 “等效平衡”及其应用-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)陕西省西安市西航一中2021-2022学年高二上学期期中考试化学试题
名校
10 . 可逆反应3A(g) 3B(?)+C(?)△H>0,达到化学平衡后,进行下列操作。
3B(?)+C(?)△H>0,达到化学平衡后,进行下列操作。
(1)升高温度,用“变大”“变小”“不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量______ ;
②若B、C都不是气体,气体的平均相对分子质量______ ;
③若B是气体,C不是气体,气体的平均相对分子质量______ ;
(2)如果平衡后温度保持不变,将容器体积增大一倍,新平衡时A的浓度是原来的50%,判断B的状态是__________ 态,C的状态是__________ 态。
(3)某密闭容器中放入一定量的NO2,发生反应2NO2 N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是
N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是_________ 。
A.通入N2 B.通入NO2 C.通入N2O4 D.升高温度
 3B(?)+C(?)△H>0,达到化学平衡后,进行下列操作。
3B(?)+C(?)△H>0,达到化学平衡后,进行下列操作。(1)升高温度,用“变大”“变小”“不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量
②若B、C都不是气体,气体的平均相对分子质量
③若B是气体,C不是气体,气体的平均相对分子质量
(2)如果平衡后温度保持不变,将容器体积增大一倍,新平衡时A的浓度是原来的50%,判断B的状态是
(3)某密闭容器中放入一定量的NO2,发生反应2NO2
 N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是
N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是A.通入N2 B.通入NO2 C.通入N2O4 D.升高温度
您最近半年使用:0次
2019-09-02更新
|
357次组卷
|
3卷引用:【市级联考】安徽省池州市2019-2020学年高二第一学期九月份素质检测(开学考试)化学试题



