2023高三·全国·专题练习
1 . 可将炼铁产生的CO2与CH4反应得到气体燃料,其反应原理为:CO2(g)+CH4(g) 2CO(g)+2H2(g)。某小组向体积是1L的刚性密闭容器中充入物质的量均是1mol的CH4与CO2,反应过程中CO2的平衡转化率与温度、压强的关系如图所示。
2CO(g)+2H2(g)。某小组向体积是1L的刚性密闭容器中充入物质的量均是1mol的CH4与CO2,反应过程中CO2的平衡转化率与温度、压强的关系如图所示。
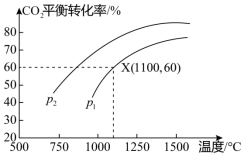
(1)压强:p1___________ p2(填“>”或“<”)。
(2)1100℃、p1条件下,反应的平衡常数Kp=___________ (用含p1的代数式表示,Kp为以分压表示的平衡常数,分压=总压×物质的量分数);若在平衡体系再充入0.6molCO2和0.8molH2,重新达平衡后,CH4的转化率___________ (选填“增大”、“减小”或“不变”)。
 2CO(g)+2H2(g)。某小组向体积是1L的刚性密闭容器中充入物质的量均是1mol的CH4与CO2,反应过程中CO2的平衡转化率与温度、压强的关系如图所示。
2CO(g)+2H2(g)。某小组向体积是1L的刚性密闭容器中充入物质的量均是1mol的CH4与CO2,反应过程中CO2的平衡转化率与温度、压强的关系如图所示。
(1)压强:p1
(2)1100℃、p1条件下,反应的平衡常数Kp=
您最近一年使用:0次
2023高三·全国·专题练习
2 . 在气体总压强分别为p1和p2时,反应2SO3(g)  2SO2(g)+O2(g)在不同温度下达到平衡,测得SO3(g)及SO2(g)的物质的量分数如图所示:
2SO2(g)+O2(g)在不同温度下达到平衡,测得SO3(g)及SO2(g)的物质的量分数如图所示:
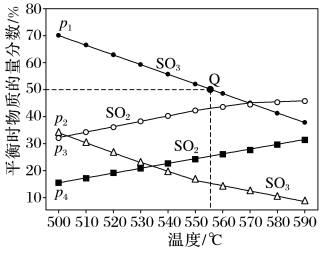
(1)压强:p1___________ (填“>”或“<”)p2
(2)若p1=0.81 MPa,起始时充入一定量的SO3(g)发生反应,计算Q点对应温度下该反应的平衡常数Kp=___________ MPa(用平衡分压代替平衡浓度计算。分压=总压×物质的量分数)
 2SO2(g)+O2(g)在不同温度下达到平衡,测得SO3(g)及SO2(g)的物质的量分数如图所示:
2SO2(g)+O2(g)在不同温度下达到平衡,测得SO3(g)及SO2(g)的物质的量分数如图所示:
(1)压强:p1
(2)若p1=0.81 MPa,起始时充入一定量的SO3(g)发生反应,计算Q点对应温度下该反应的平衡常数Kp=
您最近一年使用:0次
3 . 汽车尾气是城市主要空气污染物,利用反应2NO(g) +2CO(g) ⇌N2+2CO2(g)可实现汽车尾气的无害化处理。向甲、乙两个体积都为2.0 L的恒容密闭容器中分别充入2mol CO和2 mol NO,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(CO2)随时间(t)变化情况见下表:
(1)T1___________ T2(填“>”、“<”或“=”下同),该反应ΔH___________ 0。
(2)乙容器中,2~4s内N2的平均反应速率υ(N2)=___________ 。
(3)甲容器中NO平衡转化率为___________ ,T1温度下该反应的平衡常数为___________ 。
(4)该反应达到平衡后,为提高反应速率同时提高NO的转化率,可采取的措施有___________ (填字母序号)。
a.增大NO浓度 b.压缩容器体积 c.移去部分N2 d.改用高效催化剂
| 时间/s | 0 | 2 | 4 | 6 | 8 | 10 |
| 甲容器(T1)n(CO2)/mol | 0 | 0.72 | 1.20 | 1.60 | 1.60 | 1.60 |
| 乙容器(T2)n(CO2)/mol | 0 | 0.60 | 1.00 | 1.40 | 1.70 | 1.70 |
(1)T1
(2)乙容器中,2~4s内N2的平均反应速率υ(N2)=
(3)甲容器中NO平衡转化率为
(4)该反应达到平衡后,为提高反应速率同时提高NO的转化率,可采取的措施有
a.增大NO浓度 b.压缩容器体积 c.移去部分N2 d.改用高效催化剂
您最近一年使用:0次
名校
解题方法
4 . 在一定温度下的2 L的密闭容器中,加入3 mol A和1 mol B,发生如下反应:3A(g)+B(g)⇌2C(g)+3D(s),5 min达到平衡时,n(B):n(C)=1:3。
(1)0~5 min内用B表示的平均反应速率为_______ ;达到平衡时容器内气体压强与反应前容器内气体压强之比_______ 。
(2)维持容器的温度不变,若缩小容器的体积,则平衡将向_______ (填“正向移动”“逆向移动”或“不移动”)。
(3)达到平衡后,若保持温度不变,将C从容器中分离出一部分,则化学平衡常数_______ (填“增大”、“减小”或“不变”)。
(1)0~5 min内用B表示的平均反应速率为
(2)维持容器的温度不变,若缩小容器的体积,则平衡将向
(3)达到平衡后,若保持温度不变,将C从容器中分离出一部分,则化学平衡常数
您最近一年使用:0次
5 . 在100℃时,将0.40 mol二氧化氮气体充入一个2 L抽空的密闭容器中,发生反应:2NO2⇌ N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
(1)在上述条件下,从反应开始至20 s时,用NO2表示的平均反应速率为__________ mol·L−1·s−1。
(2)n3________ (填“>”“<”或“=”)n4;该反应的平衡常数K的数值为___________ (精确到0.1)。
(3)若在相同条件下最初向该容器中充入N2O4,要达到上述平衡状态,N2O4的起始浓度是______ mol·L−1。
(4)上述(3)达到平衡后N2O4的转化率为______________ ,混合气体的平均摩尔质量为______________ 。
(5)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2⇌N2O4的平衡常数将_______________ (填“增大”“减小”或“不变”)。
(6)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将______________ (填“向左移动”“向右移动”或“不移动”)。
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始至20 s时,用NO2表示的平均反应速率为
(2)n3
(3)若在相同条件下最初向该容器中充入N2O4,要达到上述平衡状态,N2O4的起始浓度是
(4)上述(3)达到平衡后N2O4的转化率为
(5)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2⇌N2O4的平衡常数将
(6)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将
您最近一年使用:0次
2019-12-09更新
|
354次组卷
|
5卷引用:山东省新泰市第二中学2019-2020学年高二上学期期中考试化学试题
山东省新泰市第二中学2019-2020学年高二上学期期中考试化学试题湖北省武汉市钢城第四中学2019-2020学年高二上学期期中考试化学试题重庆市南岸区2019-2020学年高二上学期期末学业质量调研抽测化学试题(已下线)第2章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)江西省景德镇市第一中学2021-2022学年高二上学期期中化学试题
解题方法
6 . 在一定温度下,将2mol A和2molB 两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.6mol D,并测得C的浓度为0.45mol/L,请填写下列空白:
xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.6mol D,并测得C的浓度为0.45mol/L,请填写下列空白:
(1)A的转化率为________
(2)2分钟内生成D的反应速率为______
(3)x值等于______
(4)如果增大反应体系的压强,则平衡体系中C的质量分数_______ (填“增大”“减小”或“不变”)
 xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.6mol D,并测得C的浓度为0.45mol/L,请填写下列空白:
xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.6mol D,并测得C的浓度为0.45mol/L,请填写下列空白:(1)A的转化率为
(2)2分钟内生成D的反应速率为
(3)x值等于
(4)如果增大反应体系的压强,则平衡体系中C的质量分数
您最近一年使用:0次
名校
7 . 以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g) + H2O(g) CO(g) + 3H2(g) △H=+206.0kJ·mol-1
CO(g) + 3H2(g) △H=+206.0kJ·mol-1
Ⅱ:CO(g) + 2H2(g) CH3OH(g) △H=-129.0kJ·mol-1
CH3OH(g) △H=-129.0kJ·mol-1
(1)一定温度下,在容积2L且固定的两个密闭容器中,按如下方式加入反应物发生反应I,一段时间后达到平衡。
经测定甲容器经过5min达到平衡,平衡后甲中气体的压强为开始的1.2倍,若要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则b的取值范围为__________ 。
(2)将1.0molCH4和2.0molH2O(g)通入容积为10L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图。
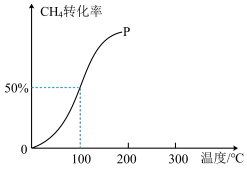
①假设100 ℃时达到平衡所需的时间为5min,则用H2表示该反应的反应速率为______ 。
②100℃时反应I的平衡常数为____________ 。
(3)若在恒温恒压容器内进行反应Ⅱ,下列能说明该反应达到平衡状态的有________ (填序号)。
A.有2个H—H键生成的同时有 3个C—H键断裂
B.CO百分含量保持不变
C.容器中混合气体的压强保持不变
D.容器中混合气体的密度保持不变
(4)在压强为0.1MPa、温度为300℃条件下,将amol CO与3amol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是__________ (填序号)。
A.c(H2) 减少 B.正反应速率加快,逆反应速率减慢
C.n(CH3OH) 增加 D.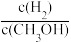 减小 E.平衡常数K增大
减小 E.平衡常数K增大
I:CH4(g) + H2O(g)
 CO(g) + 3H2(g) △H=+206.0kJ·mol-1
CO(g) + 3H2(g) △H=+206.0kJ·mol-1Ⅱ:CO(g) + 2H2(g)
 CH3OH(g) △H=-129.0kJ·mol-1
CH3OH(g) △H=-129.0kJ·mol-1(1)一定温度下,在容积2L且固定的两个密闭容器中,按如下方式加入反应物发生反应I,一段时间后达到平衡。
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCH4、1molH2O | a molCH4、a molH2O、b molCO、c molH2 |
经测定甲容器经过5min达到平衡,平衡后甲中气体的压强为开始的1.2倍,若要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则b的取值范围为
(2)将1.0molCH4和2.0molH2O(g)通入容积为10L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图。

①假设100 ℃时达到平衡所需的时间为5min,则用H2表示该反应的反应速率为
②100℃时反应I的平衡常数为
(3)若在恒温恒压容器内进行反应Ⅱ,下列能说明该反应达到平衡状态的有
A.有2个H—H键生成的同时有 3个C—H键断裂
B.CO百分含量保持不变
C.容器中混合气体的压强保持不变
D.容器中混合气体的密度保持不变
(4)在压强为0.1MPa、温度为300℃条件下,将amol CO与3amol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是
A.c(H2) 减少 B.正反应速率加快,逆反应速率减慢
C.n(CH3OH) 增加 D.
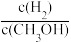 减小 E.平衡常数K增大
减小 E.平衡常数K增大
您最近一年使用:0次
2019-10-18更新
|
231次组卷
|
2卷引用:江苏省海安高级中学2019-2020学年高二10月月考化学试题
8 . 已知一定温度和压强下,在容积为VL的密闭容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g)+ B(g)⇌C(g) ∆H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
(1)升温时,C的反应速率_______ (填“加快”、“减慢”或“不变”);
(2)若平衡时,保持容器容积不变,使容器内压强增大,则平衡_______ ;
A.一定向正反应方向移动 B.一定向逆反应方向移动
C.一定不移动 D.不一定移动
(3)若使温度、压强都保持和题干中的一样不变,在密闭容器中充入2 mol A和2 mol B,则反应达到平衡时:A的转化率为_______ (精确到0.01%),容器的容积为_______ L。
(1)升温时,C的反应速率
(2)若平衡时,保持容器容积不变,使容器内压强增大,则平衡
A.一定向正反应方向移动 B.一定向逆反应方向移动
C.一定不移动 D.不一定移动
(3)若使温度、压强都保持和题干中的一样不变,在密闭容器中充入2 mol A和2 mol B,则反应达到平衡时:A的转化率为
您最近一年使用:0次
名校
9 . 某温度时,在一个容积为2 L 的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:

(1)该反应的化学方程式为:______________________ 。
(2)反应开始至2 min,气体Z的平均反应速率v(Z)=____________ 。
(3)1min时,正逆反应速率的大小关系为:v正____________ v逆(填“>”、“<”或“=”);4min时,v正____________ v逆(同前);若X、Y、Z均为气体,反应达到平衡时:若此时将容器的体积缩小为原来的1/2倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为________ 反应(填“放热”或“吸热”)。
(4)上述反应在t1~t6内反应速率与时间图象如图,在每一时刻均改变一个影响反应速率的因素,则下列说法正确的是____________ 。

A.在t1时增大了压强
B.在t3时加入了催化剂
C.在t4时降低了温度
D.t2~t3时X的转化率最高

(1)该反应的化学方程式为:
(2)反应开始至2 min,气体Z的平均反应速率v(Z)=
(3)1min时,正逆反应速率的大小关系为:v正
(4)上述反应在t1~t6内反应速率与时间图象如图,在每一时刻均改变一个影响反应速率的因素,则下列说法正确的是

A.在t1时增大了压强
B.在t3时加入了催化剂
C.在t4时降低了温度
D.t2~t3时X的转化率最高
您最近一年使用:0次
2018-12-22更新
|
322次组卷
|
3卷引用:内蒙古自治区包头市第六中学2018-2019学年高二上学期期中考试化学试题
2011高三·全国·竞赛
10 . NO2和N2O4混合气体的针管实验是高中化学的经典素材。理论估算和实测发现,混合气体体积由V压缩为V/2,温度由298K升至311K。已知这两个温度下N2O4(g) 2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
(1)通过计算回答,混合气体经上述压缩后,NO2的浓度比压缩前增加了_______ 倍。
(2)动力学实验证明,上述混合气体几微秒内即可达成化学平衡。压缩后的混合气体在室温下放置,颜色如何变化?____________ 为什么?_______________
 2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
2NO2(g)的压力平衡常数Kp分别为0.141和0.363。(1)通过计算回答,混合气体经上述压缩后,NO2的浓度比压缩前增加了
(2)动力学实验证明,上述混合气体几微秒内即可达成化学平衡。压缩后的混合气体在室温下放置,颜色如何变化?
您最近一年使用:0次



