2021高二·全国·专题练习
1 . 一定温度下,在密闭容器中发生反应:N2O4(g)⇌2NO2(g) ΔH>0,反应达到平衡时,下列说法不正确的是
| A.若缩小容器的体积,则容器中气体的颜色先变深后又变浅,且比原平衡颜色深 |
| B.若压强不变,向容器中再加入一定量的N2O4,再次达到平衡时各种物质的百分含量不变 |
| C.若体积不变,向容器中再加入一定量的N2O4,相对于原平衡,平衡向正反应方向移动,再次平衡时N2O4的转化率将升高 |
| D.若体积不变,升高温度,再次平衡时体系颜色加深 |
您最近一年使用:0次
名校
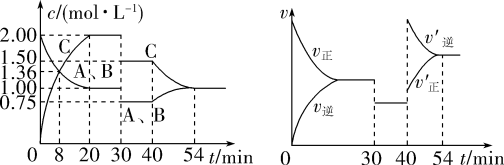
2 . 某密闭容器中充入等物质的量的A和B,一定温度下发生反应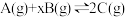 ,达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:
,达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:
下列说法中不正确 的是
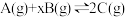 ,达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:
,达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:
下列说法中
| A.30min~40min间该反应使用了催化剂 |
| B.反应方程式中的x=1 |
| C.正反应为放热反应 |
| D.前8minA的平均反应速率为0.08mol·L-1·min-1 |
您最近一年使用:0次
名校
解题方法
3 . 如图,关闭活塞K,向A中充入1molX、1molY,向B中充入2molX、2molY,此时A的容积是aL,B的容积是2aL。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g) +Y(g)⇌2Z(g)+W(g) ΔH<0 。A保持恒压,B保持恒容。达平衡时,A的体积为1.4aL。下列说法错误的是
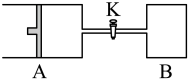

| A.反应速率v(B) > v(A) |
| B.A中X的转化率为80% |
| C.平衡时Y的体积分数:A<B |
| D.若打开K,则A的体积变为2.4aL |
您最近一年使用:0次
2021-11-06更新
|
197次组卷
|
2卷引用:湖北省沙市中学2021-2022学年高二上学期期中考试化学试题
4 . 在体积可变的密闭容器中投入0.5molE和1molF,在一定条件下发生反应: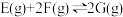
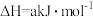 (a<0)。实验测得平衡时F的转化率随温度、压强的变化如图所示。下列说法错误的是
(a<0)。实验测得平衡时F的转化率随温度、压强的变化如图所示。下列说法错误的是

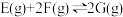
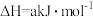 (a<0)。实验测得平衡时F的转化率随温度、压强的变化如图所示。下列说法错误的是
(a<0)。实验测得平衡时F的转化率随温度、压强的变化如图所示。下列说法错误的是
A.Y代表压强,且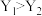 |
B.M、M两点对应的平衡常数: |
C.M、N两点对应的 |
| D.保持温度和压强不变,向平衡体系中再充入物质的量之比为1:2的E(g)和F(g),平衡时反应物的转化率增大 |
您最近一年使用:0次
名校
解题方法
5 . 向甲、乙两个容积均为1L的恒容密闭容器中分别充入2molA、2molB和1molA、1molB,相同条件下,发生反应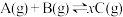 。测得两容器中c(A)随时间t的变化关系如图所示。下列说法不正确的是
。测得两容器中c(A)随时间t的变化关系如图所示。下列说法不正确的是
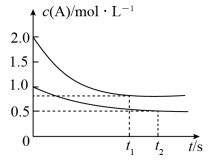
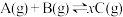 。测得两容器中c(A)随时间t的变化关系如图所示。下列说法不正确的是
。测得两容器中c(A)随时间t的变化关系如图所示。下列说法不正确的是
| A.x等于1 |
| B.向平衡后的乙容器中充入氦气,平衡不移动 |
| C.从平衡后的甲容器中移走1molC,重新达到平衡后各物质的体积分数与乙容器中的相同 |
D.若向乙容器中再充入1molA、1molB,则达到化学平衡时乙容器中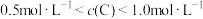 |
您最近一年使用:0次
21-22高三上·江苏·阶段练习
名校
6 . 根据流程图,下列有关硝酸工业制备说法不正确 的是
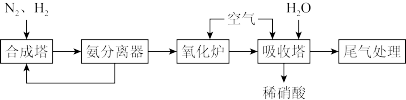

| A.合成塔中使用催化剂,可以提高单位时间内N2的转化率 |
| B.加压可以提高氧化炉中NH3的平衡转化率 |
| C.吸收塔中鼓入过量的空气可以提高硝酸的产率 |
| D.采用气-液逆流接触法是为了使尾气中的氮氧化物吸收更充分 |
您最近一年使用:0次
名校
7 . 氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,其热化学方程式为4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH=-904 kJ·mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。对于反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g)ΔH=-904 kJ·mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。对于反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g),下列有关说法
4NO(g)+6H2O(g),下列有关说法不 正确的是
 4NO(g)+6H2O(g)ΔH=-904 kJ·mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。对于反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g)ΔH=-904 kJ·mol-1。生产硝酸的尾气中主要含有NO、NO2等大气污染物,可用石灰浆等碱性溶液吸收处理,并得到Ca(NO3)2、Ca(NO2)2等化工产品。对于反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g),下列有关说法
4NO(g)+6H2O(g),下列有关说法| A.该反应一定能自发进行 |
| B.该反应的正反应的活化能小于逆反应的活化能 |
| C.断裂1mol N—H键的同时断裂1molO—H键,说明该反应达到平衡状态 |
| D.达到平衡时,增大容器的体积,v(正)增加、v(逆)减小 |
您最近一年使用:0次
2021-10-14更新
|
1430次组卷
|
8卷引用:江苏省如皋中学2021-2022学年高三上学期第一次阶段考试化学试题
解题方法
8 . 化学反应进行的方向和限度是化学反应原理所要研究的两个重要问题,下列有关化学反应进行的方向和限度的说法中不正确的是
A.恒温恒容的密闭容器中发生反应mA(g)+nB(g) pC(g),若B是有色物质,A,C均为无色物质,达到平衡后,加入一定量C,体系的颜色会变深 pC(g),若B是有色物质,A,C均为无色物质,达到平衡后,加入一定量C,体系的颜色会变深 |
| B.一定温度下两个体积相同密闭容器中,分别放有二氧化氮、气态溴,起始时两个容器中气体颜色相同,若将容器体积压缩至原来的一半,则CNO2>CBr2 |
| C.综合考虑反应速率和限度,以及催化剂活性,合成氨一般选择400℃~500℃ |
D.恒温时,对于反应A(g)+3B(g) 2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压为原来的两倍,则A体积分数仍为n% 2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压为原来的两倍,则A体积分数仍为n% |
您最近一年使用:0次
名校
9 . 回收利用CO是工业生产的一项新课题,新技术研究成果甲醇与CO反应可制备乙酸,其反应为CH3OH(g)+CO(g) CH3COOH(l),测得甲醇的转化率随温度变化如图所示
CH3COOH(l),测得甲醇的转化率随温度变化如图所示
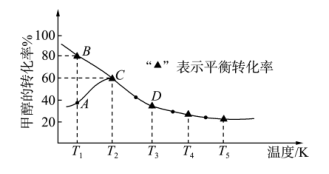
下列有关说法正确的是
 CH3COOH(l),测得甲醇的转化率随温度变化如图所示
CH3COOH(l),测得甲醇的转化率随温度变化如图所示
下列有关说法正确的是
| A.温度升高,平衡常数K增大 |
| B.温度为T1时,该反应的正反应速率:B点>A点 |
| C.缩小容器容积,既能加快反应速率,又能提高甲醇的转化率 |
| D.选择合适的催化剂可以降低反应活化能并提高平衡产率 |
您最近一年使用:0次
2021-12-03更新
|
339次组卷
|
3卷引用:河北省百师联盟2022届高三上学期一轮复习联考(三)化学试题
名校
10 . 联系生产生活实际,下列说法,不能根据平衡移动原理解释的是
| A.供热公司为了节能减排,将煤块粉碎燃烧 |
| B.可乐瓶开启后,马上泛起大量气泡,并可能将可乐冲出瓶口 |
| C.氯气在饱和食盐水中的溶解度比在水中小 |
| D.将一氧化碳中毒者放入高压氧舱,增大氧气浓度,缓解病情 |
您最近一年使用:0次
2021-12-02更新
|
148次组卷
|
2卷引用:福建省福州外国语学校2021-2022学年高二上学期期中考试化学试题



