名校
解题方法
1 . 利用熔融碱焙烧工艺可从铝热法生产金属铬所得铬渣(Al、Al2O3、 Cr2O3等)中浸出铬和铝,实现铬和铝的再生利用。其工作流程如下:
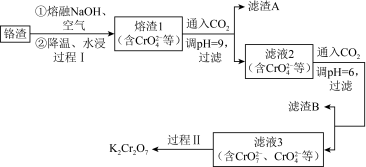
(1)铝热法冶炼金属铬,是利用了金属铝的_______ (填“氧化性”或“还原性”)。
(2)溶液1中的阴离子有 、
、_______ 。
(3)过程I,在Cr2O3参与的反应中,若生成0.4 mol ,消耗氧化剂的物质的量是
,消耗氧化剂的物质的量是_______ 。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是_______ 。
②滤渣B受热分解所得物质可以循环利用,B是_______ 。
③已知:2 +2H+
+2H+
 +H2O K=4.0×1014,滤液3中
+H2O K=4.0×1014,滤液3中 的浓度是0.04 mol/L,则
的浓度是0.04 mol/L,则 的浓度是
的浓度是_______ mol/L。
(5)过程II的目的是得到K2Cr2O7粗品,粗品再重结晶可制得纯净的K2Cr2O7,不同温度下化合物的溶解度(g/100gH2O)
结合表中数据分析,过程II得到K2Cr2O7粗品的操作是:_______ ,过滤得到K2Cr2O7粗品。

(1)铝热法冶炼金属铬,是利用了金属铝的
(2)溶液1中的阴离子有
 、
、(3)过程I,在Cr2O3参与的反应中,若生成0.4 mol
 ,消耗氧化剂的物质的量是
,消耗氧化剂的物质的量是(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是
②滤渣B受热分解所得物质可以循环利用,B是
③已知:2
 +2H+
+2H+
 +H2O K=4.0×1014,滤液3中
+H2O K=4.0×1014,滤液3中 的浓度是0.04 mol/L,则
的浓度是0.04 mol/L,则 的浓度是
的浓度是(5)过程II的目的是得到K2Cr2O7粗品,粗品再重结晶可制得纯净的K2Cr2O7,不同温度下化合物的溶解度(g/100gH2O)
| 化合物名称 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
| NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
| KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
| K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
| K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
| Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
您最近一年使用:0次
2022-05-25更新
|
132次组卷
|
5卷引用:甘肃省天水市第一中学2018届高三第二次模拟考试理综化学试题
2 . I.研究氮和碳的化合物对工业生产和防治污染有重要意义,回答下列问题:
(1)化学键键能数据如下:
合成氨反应 N2(g)+
N2(g)+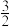 H2(g)
H2(g) NH3(g)的活化能Ea1=254 kJ·mol-1,由此计算氨分解反应NH3(g)
NH3(g)的活化能Ea1=254 kJ·mol-1,由此计算氨分解反应NH3(g) 
 N2(g)+
N2(g)+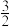 H2(g)的活化能Ea2=
H2(g)的活化能Ea2=___________ kJ·mol-1。
(2)利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H<0。某研究小组将2 mol NH3、3 mol NO和一定量的O2充入2 L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示:
5N2(g)+6H2O(g) △H<0。某研究小组将2 mol NH3、3 mol NO和一定量的O2充入2 L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示:
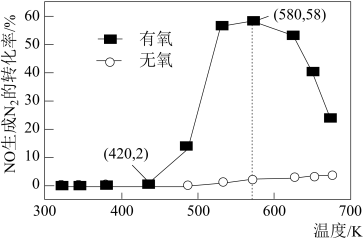
①温度从420K升高到580K用时4min,则此时段内NO的平均反应速率v(NO)=___________ ;
②在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是___________ 。
II.目前有一种新的循环利用方案处理航天员呼吸产生的CO2,是用Bosch反应CO2(g)+2H2(g) C(s)+2H2O(g) △H<0,再电解水实现O2的循环利用。
C(s)+2H2O(g) △H<0,再电解水实现O2的循环利用。
(3)若要此反应自发进行___________ (填“高温”或“低温”)更有利。
(4)350℃时,向体积为2 L的恒容密闭容器中通入8 mol H2和4 mol CO2发生以上反应,若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如表所示:
①350℃时Bosch反应的Kp=___________ (Kp为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)。
②Bosch反应的速率方程:v正=k正·c(CO2)·c2(H2),v逆=k逆·c2(H2O)(k是速率常数,只与温度有关)。20min时,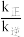
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(5)工业上常用氨水吸收二氧化硫,通过计算判断常温下(NH4)2SO3溶液的酸碱性并说明判断依据:___________ 。(已知:NH3·H2O的K=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8)
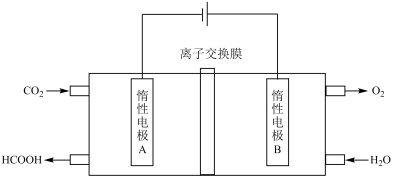
(6)通过电化学方法可有效实现以CO2和水为原料合成甲酸,其原理示意图图所示,则A极的电极反应式为___________ 。
(1)化学键键能数据如下:
| 化学键 | H-H | N≡N | N-H |
| E/(kJ/mol) | 436 | 946 | 391 |
 N2(g)+
N2(g)+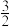 H2(g)
H2(g) NH3(g)的活化能Ea1=254 kJ·mol-1,由此计算氨分解反应NH3(g)
NH3(g)的活化能Ea1=254 kJ·mol-1,由此计算氨分解反应NH3(g) 
 N2(g)+
N2(g)+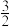 H2(g)的活化能Ea2=
H2(g)的活化能Ea2=(2)利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) △H<0。某研究小组将2 mol NH3、3 mol NO和一定量的O2充入2 L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示:
5N2(g)+6H2O(g) △H<0。某研究小组将2 mol NH3、3 mol NO和一定量的O2充入2 L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示:
①温度从420K升高到580K用时4min,则此时段内NO的平均反应速率v(NO)=
②在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是
II.目前有一种新的循环利用方案处理航天员呼吸产生的CO2,是用Bosch反应CO2(g)+2H2(g)
 C(s)+2H2O(g) △H<0,再电解水实现O2的循环利用。
C(s)+2H2O(g) △H<0,再电解水实现O2的循环利用。(3)若要此反应自发进行
(4)350℃时,向体积为2 L的恒容密闭容器中通入8 mol H2和4 mol CO2发生以上反应,若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 压强 | 6.00P0 | 5.60 P0 | 5.30 P0 | 5.15 P0 | 5.06 P0 | 5.00 P0 | 5.00 P0 |
②Bosch反应的速率方程:v正=k正·c(CO2)·c2(H2),v逆=k逆·c2(H2O)(k是速率常数,只与温度有关)。20min时,
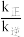
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(5)工业上常用氨水吸收二氧化硫,通过计算判断常温下(NH4)2SO3溶液的酸碱性并说明判断依据:
(6)通过电化学方法可有效实现以CO2和水为原料合成甲酸,其原理示意图图所示,则A极的电极反应式为

您最近一年使用:0次
名校
3 . “21世纪的清洁燃料”二甲醚具有含氢量高,廉价易得,无毒等优点。回答下列问题:
(1)以 、
、 为原料制备二甲醚(CH3OCH3)涉及的主要反应如下:
为原料制备二甲醚(CH3OCH3)涉及的主要反应如下:
i.
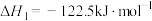 ;
;
ⅱ.
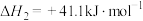 。
。
反应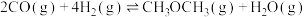 的
的 =
=______ 。
(2)二甲醚水蒸气重整制氢体系中会发生如下反应:
主反应: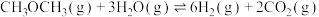
副反应: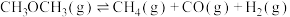

温度为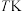 时,向压强为
时,向压强为 的恒压体系中按物质的量之比为1:3充入
的恒压体系中按物质的量之比为1:3充入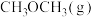 、
、 ,测得在催化剂HZSM-5催化下反应达到平衡时,二甲醚转化率为25%,且产物中
,测得在催化剂HZSM-5催化下反应达到平衡时,二甲醚转化率为25%,且产物中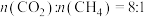 。
。
①能判断主反应达到平衡状态的标志为______ (填字母)。
A.混合气体中各物质分压保持不变 B.混合气体的密度保持不变
C.混合气体平均摩尔质量保持不变 D.消耗1mol 时,有2molCO2生成
时,有2molCO2生成
②反应达到平衡时, 的转化率为
的转化率为______ ,二甲醚水蒸气重整制氢主反应的 =
=______ (列出含 的计算式即可,用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数)。
的计算式即可,用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数)。
③已知主反应高温下可以自发进行,若升高反应温度,平衡时二甲醚的转化率______ (填“高于”或“低于”)25%。
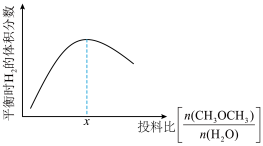
④温度压强不变,只改变反应物的投料比,平衡时 的体积分数变化趋势如图所示。投料比小于
的体积分数变化趋势如图所示。投料比小于 时,平衡时
时,平衡时 的体积分数变化趋势较投料比大于
的体积分数变化趋势较投料比大于 时更明显的原因是
时更明显的原因是____________ 。
(3)用惰性电极设计碱性二甲醚一氧气燃料电池,负极反应的电极反应式为____________ 。
(1)以
 、
、 为原料制备二甲醚(CH3OCH3)涉及的主要反应如下:
为原料制备二甲醚(CH3OCH3)涉及的主要反应如下:i.

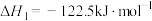 ;
;ⅱ.

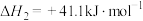 。
。反应
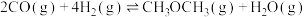 的
的 =
=(2)二甲醚水蒸气重整制氢体系中会发生如下反应:
主反应:
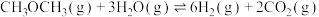
副反应:
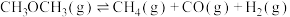

温度为
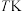 时,向压强为
时,向压强为 的恒压体系中按物质的量之比为1:3充入
的恒压体系中按物质的量之比为1:3充入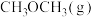 、
、 ,测得在催化剂HZSM-5催化下反应达到平衡时,二甲醚转化率为25%,且产物中
,测得在催化剂HZSM-5催化下反应达到平衡时,二甲醚转化率为25%,且产物中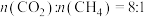 。
。①能判断主反应达到平衡状态的标志为
A.混合气体中各物质分压保持不变 B.混合气体的密度保持不变
C.混合气体平均摩尔质量保持不变 D.消耗1mol
 时,有2molCO2生成
时,有2molCO2生成②反应达到平衡时,
 的转化率为
的转化率为 =
= 的计算式即可,用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数)。
的计算式即可,用平衡分压代替平衡浓度,平衡分压=总压×物质的量分数)。③已知主反应高温下可以自发进行,若升高反应温度,平衡时二甲醚的转化率
④温度压强不变,只改变反应物的投料比,平衡时
 的体积分数变化趋势如图所示。投料比小于
的体积分数变化趋势如图所示。投料比小于 时,平衡时
时,平衡时 的体积分数变化趋势较投料比大于
的体积分数变化趋势较投料比大于 时更明显的原因是
时更明显的原因是
(3)用惰性电极设计碱性二甲醚一氧气燃料电池,负极反应的电极反应式为
您最近一年使用:0次
名校
解题方法
4 . 燃煤烟气中含有大量SO2和NO,某科研小组研究SO2和NO的吸收方法。
回答下列问题:
(1)已知SO2(g)+O3(g) SO3(g)+O2(g) △H1=-241.6 kJ· mol-1
SO3(g)+O2(g) △H1=-241.6 kJ· mol-1
NO(g)+O3(g) NO2(g)+O2(g) △H2=-199.8kJ· mol-1
NO2(g)+O2(g) △H2=-199.8kJ· mol-1
则反应SO3(g)+NO(g) SO2(g)+NO2(g)的△H=
SO2(g)+NO2(g)的△H=________ kJ· mol-1
(2)在恒温条件下,向2L恒容密闭容器中加入1 molNO和1molO3发生反应NO(g)+O3(g) NO2(g)+O2(g),2min时达到平衡状态。
NO2(g)+O2(g),2min时达到平衡状态。
①若测得2min内v(NO)=0.21 mol· L-1· min-1,则平衡时NO的转化率α1=________ ;若其它条件保持不变,在恒压条件下进行,则平衡时NO的转化率α2________ α1(填“>”“<”或“=”)
②保持温度不变,向2min后的平衡体系中再加入0.3 moNO2和0.04 molNO,此时平衡将向________ (填“正”或“逆”)方向移动
③该反应的逆反应速率与时间的关系如下图所示,反应在t1、t3、t5时刻均达到平衡状态。t2、t6时刻都只改变了某一个条件,则t2时刻改变的条件是________ ,t6时刻改变的条件是________ ,t4时刻改变条件后v(正) ________ v(逆)(填“>”“<”或“=”)

(3)处理烟气中SO2也可采用碱液吸收法。已知25℃时,K(NH3·H2O)=1.8×10-5;H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收SO2,并在空气中氧化;
第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42- CaSO4↓+2NH3·H2O。
CaSO4↓+2NH3·H2O。
①25℃时,0.1mol·L-1(NH4)2SO3溶液呈________ (填“酸性”“碱性”或“中性”)。
②计算第2步反应的平衡常数K=________ (列出计算式即可)。
回答下列问题:
(1)已知SO2(g)+O3(g)
 SO3(g)+O2(g) △H1=-241.6 kJ· mol-1
SO3(g)+O2(g) △H1=-241.6 kJ· mol-1NO(g)+O3(g)
 NO2(g)+O2(g) △H2=-199.8kJ· mol-1
NO2(g)+O2(g) △H2=-199.8kJ· mol-1 则反应SO3(g)+NO(g)
 SO2(g)+NO2(g)的△H=
SO2(g)+NO2(g)的△H=(2)在恒温条件下,向2L恒容密闭容器中加入1 molNO和1molO3发生反应NO(g)+O3(g)
 NO2(g)+O2(g),2min时达到平衡状态。
NO2(g)+O2(g),2min时达到平衡状态。①若测得2min内v(NO)=0.21 mol· L-1· min-1,则平衡时NO的转化率α1=
②保持温度不变,向2min后的平衡体系中再加入0.3 moNO2和0.04 molNO,此时平衡将向
③该反应的逆反应速率与时间的关系如下图所示,反应在t1、t3、t5时刻均达到平衡状态。t2、t6时刻都只改变了某一个条件,则t2时刻改变的条件是

(3)处理烟气中SO2也可采用碱液吸收法。已知25℃时,K(NH3·H2O)=1.8×10-5;H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收SO2,并在空气中氧化;
第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42-
 CaSO4↓+2NH3·H2O。
CaSO4↓+2NH3·H2O。①25℃时,0.1mol·L-1(NH4)2SO3溶液呈
②计算第2步反应的平衡常数K=
您最近一年使用:0次
2019-01-12更新
|
457次组卷
|
3卷引用:甘肃省武威市第六中学2019届高三下学期第一次诊断考试化学试题



