名校
解题方法
1 . 利用熔融碱焙烧工艺可从铝热法生产金属铬所得铬渣(Al、Al2O3、 Cr2O3等)中浸出铬和铝,实现铬和铝的再生利用。其工作流程如下:
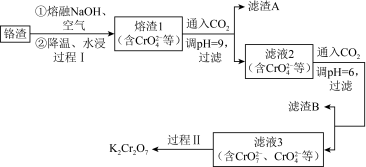
(1)铝热法冶炼金属铬,是利用了金属铝的_______ (填“氧化性”或“还原性”)。
(2)溶液1中的阴离子有 、
、_______ 。
(3)过程I,在Cr2O3参与的反应中,若生成0.4 mol ,消耗氧化剂的物质的量是
,消耗氧化剂的物质的量是_______ 。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是_______ 。
②滤渣B受热分解所得物质可以循环利用,B是_______ 。
③已知:2 +2H+
+2H+
 +H2O K=4.0×1014,滤液3中
+H2O K=4.0×1014,滤液3中 的浓度是0.04 mol/L,则
的浓度是0.04 mol/L,则 的浓度是
的浓度是_______ mol/L。
(5)过程II的目的是得到K2Cr2O7粗品,粗品再重结晶可制得纯净的K2Cr2O7,不同温度下化合物的溶解度(g/100gH2O)
结合表中数据分析,过程II得到K2Cr2O7粗品的操作是:_______ ,过滤得到K2Cr2O7粗品。

(1)铝热法冶炼金属铬,是利用了金属铝的
(2)溶液1中的阴离子有
 、
、(3)过程I,在Cr2O3参与的反应中,若生成0.4 mol
 ,消耗氧化剂的物质的量是
,消耗氧化剂的物质的量是(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是
②滤渣B受热分解所得物质可以循环利用,B是
③已知:2
 +2H+
+2H+
 +H2O K=4.0×1014,滤液3中
+H2O K=4.0×1014,滤液3中 的浓度是0.04 mol/L,则
的浓度是0.04 mol/L,则 的浓度是
的浓度是(5)过程II的目的是得到K2Cr2O7粗品,粗品再重结晶可制得纯净的K2Cr2O7,不同温度下化合物的溶解度(g/100gH2O)
| 化合物名称 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
| NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
| KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
| K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
| K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
| Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
您最近一年使用:0次
2022-05-25更新
|
132次组卷
|
5卷引用:云南省峨山彝族自治县第一中学2018届高三上学期期末考试仿真化学试题
2 . 草酸(H2C2O4)是生物体的一种代谢产物,广泛分布于植物、动物和真菌中,并在不同的生物体中发挥着不同的作用。
(Ⅰ)草酸是一种二元有机弱酸,具有还原性。
(1)已知:25℃时,草酸的电离平衡常数Ka1=5.0×10-2,Ka2=5.4×10-5;碳酸(H2CO3)的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11。
①向Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为___ 。
②常温下,用0.01mol•L-1的NaOH标准溶液滴定20mL0.01mol•L-1的草酸溶液,滴定曲线如图所示。

a点溶液呈___ (填“酸”“碱”或“中”)性;b点溶液中各离子浓度的大小关系为___ 。
(2)酸性KMnO4溶液可将草酸氧化为CO2,还原产物为Mn2+,该反应的离子方程式为___ 。
(Ⅱ)草酸分解生成CO和CO2,以CO或CO2,为原料均可制得甲醇。
(3)已知:i.2H2(g)+O2(g)=2H2O(l) ΔH1=-285.0kJ·mol-1;ii.CH3OH(l)+ O2(g)=CO2(g)+2H2O(l) ΔH2=-726.0kJ·mol-1。则二氧化碳与氢气反应生成液态甲醇和液态水(该反应为可逆反应)的热化学方程式为
O2(g)=CO2(g)+2H2O(l) ΔH2=-726.0kJ·mol-1。则二氧化碳与氢气反应生成液态甲醇和液态水(该反应为可逆反应)的热化学方程式为___ 。
(4)利用CO与H2合成甲醇的反应原理为CO(g)+2H2(g)⇌CH3OH(g)。现向一容积可变的密闭容器中充入10molCO(g)和20molH2(g)发生上述反应,CO的平衡转化率(α)与温度(T)、压强(p)的变化关系如图所示。

①该反应为___ (填“放热”或“吸热”)反应,A、B、C三点的平衡常数K(A)、K(B)、K(C)的大小关系为___ ,压强的大小关系为p1___ (填“大于”“小于”或“等于”)p2。
②若A点时,保持容器容积和温度不变,向容器中再充入2molCO(g)、4molH2(g)和2molCH3OH(g),则v正___ (填“>”或“<”)v逆。
(Ⅰ)草酸是一种二元有机弱酸,具有还原性。
(1)已知:25℃时,草酸的电离平衡常数Ka1=5.0×10-2,Ka2=5.4×10-5;碳酸(H2CO3)的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11。
①向Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为
②常温下,用0.01mol•L-1的NaOH标准溶液滴定20mL0.01mol•L-1的草酸溶液,滴定曲线如图所示。

a点溶液呈
(2)酸性KMnO4溶液可将草酸氧化为CO2,还原产物为Mn2+,该反应的离子方程式为
(Ⅱ)草酸分解生成CO和CO2,以CO或CO2,为原料均可制得甲醇。
(3)已知:i.2H2(g)+O2(g)=2H2O(l) ΔH1=-285.0kJ·mol-1;ii.CH3OH(l)+
 O2(g)=CO2(g)+2H2O(l) ΔH2=-726.0kJ·mol-1。则二氧化碳与氢气反应生成液态甲醇和液态水(该反应为可逆反应)的热化学方程式为
O2(g)=CO2(g)+2H2O(l) ΔH2=-726.0kJ·mol-1。则二氧化碳与氢气反应生成液态甲醇和液态水(该反应为可逆反应)的热化学方程式为(4)利用CO与H2合成甲醇的反应原理为CO(g)+2H2(g)⇌CH3OH(g)。现向一容积可变的密闭容器中充入10molCO(g)和20molH2(g)发生上述反应,CO的平衡转化率(α)与温度(T)、压强(p)的变化关系如图所示。

①该反应为
②若A点时,保持容器容积和温度不变,向容器中再充入2molCO(g)、4molH2(g)和2molCH3OH(g),则v正
您最近一年使用:0次
解题方法
3 . 丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如图。

(1)丙烷脱氢制丙烯为强吸热过程。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)__ (填“增大”“减小”或“不变”,下同),转化率α(C3H8)__ 。
②温度升高,副反应更容易发生的主要原因是__ 。
(2)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为104Pa和105Pa)。
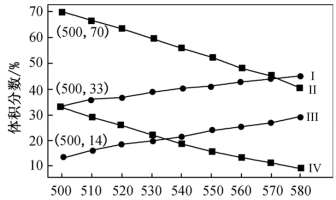
①104Pa时,图中表示丙烯的曲线是__ (填“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”)。
②104Pa、500℃时,主反应用平衡分压代替平衡浓度表示的化学平衡常数Kp=__ (已知:气体分压=气体总压×体积分数)。
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。
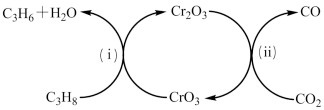
已知:CO和H2的燃烧热分别为-283.0kJ·mol-1、-285.8kJ·mol-1。
①图中催化剂为__ 。
②298K时,该工艺总反应的热化学方程式为__ 。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是__ 。

(1)丙烷脱氢制丙烯为强吸热过程。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)
②温度升高,副反应更容易发生的主要原因是
(2)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为104Pa和105Pa)。

①104Pa时,图中表示丙烯的曲线是
②104Pa、500℃时,主反应用平衡分压代替平衡浓度表示的化学平衡常数Kp=
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。

已知:CO和H2的燃烧热分别为-283.0kJ·mol-1、-285.8kJ·mol-1。
①图中催化剂为
②298K时,该工艺总反应的热化学方程式为
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是
您最近一年使用:0次
名校
解题方法
4 . 燃煤烟气中含有大量SO2和NO,某科研小组研究SO2和NO的吸收方法。
回答下列问题:
(1)已知SO2(g)+O3(g) SO3(g)+O2(g) △H1=-241.6 kJ· mol-1
SO3(g)+O2(g) △H1=-241.6 kJ· mol-1
NO(g)+O3(g) NO2(g)+O2(g) △H2=-199.8kJ· mol-1
NO2(g)+O2(g) △H2=-199.8kJ· mol-1
则反应SO3(g)+NO(g) SO2(g)+NO2(g)的△H=
SO2(g)+NO2(g)的△H=________ kJ· mol-1
(2)在恒温条件下,向2L恒容密闭容器中加入1 molNO和1molO3发生反应NO(g)+O3(g) NO2(g)+O2(g),2min时达到平衡状态。
NO2(g)+O2(g),2min时达到平衡状态。
①若测得2min内v(NO)=0.21 mol· L-1· min-1,则平衡时NO的转化率α1=________ ;若其它条件保持不变,在恒压条件下进行,则平衡时NO的转化率α2________ α1(填“>”“<”或“=”)
②保持温度不变,向2min后的平衡体系中再加入0.3 moNO2和0.04 molNO,此时平衡将向________ (填“正”或“逆”)方向移动
③该反应的逆反应速率与时间的关系如下图所示,反应在t1、t3、t5时刻均达到平衡状态。t2、t6时刻都只改变了某一个条件,则t2时刻改变的条件是________ ,t6时刻改变的条件是________ ,t4时刻改变条件后v(正) ________ v(逆)(填“>”“<”或“=”)

(3)处理烟气中SO2也可采用碱液吸收法。已知25℃时,K(NH3·H2O)=1.8×10-5;H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收SO2,并在空气中氧化;
第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42- CaSO4↓+2NH3·H2O。
CaSO4↓+2NH3·H2O。
①25℃时,0.1mol·L-1(NH4)2SO3溶液呈________ (填“酸性”“碱性”或“中性”)。
②计算第2步反应的平衡常数K=________ (列出计算式即可)。
回答下列问题:
(1)已知SO2(g)+O3(g)
 SO3(g)+O2(g) △H1=-241.6 kJ· mol-1
SO3(g)+O2(g) △H1=-241.6 kJ· mol-1NO(g)+O3(g)
 NO2(g)+O2(g) △H2=-199.8kJ· mol-1
NO2(g)+O2(g) △H2=-199.8kJ· mol-1 则反应SO3(g)+NO(g)
 SO2(g)+NO2(g)的△H=
SO2(g)+NO2(g)的△H=(2)在恒温条件下,向2L恒容密闭容器中加入1 molNO和1molO3发生反应NO(g)+O3(g)
 NO2(g)+O2(g),2min时达到平衡状态。
NO2(g)+O2(g),2min时达到平衡状态。①若测得2min内v(NO)=0.21 mol· L-1· min-1,则平衡时NO的转化率α1=
②保持温度不变,向2min后的平衡体系中再加入0.3 moNO2和0.04 molNO,此时平衡将向
③该反应的逆反应速率与时间的关系如下图所示,反应在t1、t3、t5时刻均达到平衡状态。t2、t6时刻都只改变了某一个条件,则t2时刻改变的条件是

(3)处理烟气中SO2也可采用碱液吸收法。已知25℃时,K(NH3·H2O)=1.8×10-5;H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收SO2,并在空气中氧化;
第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42-
 CaSO4↓+2NH3·H2O。
CaSO4↓+2NH3·H2O。①25℃时,0.1mol·L-1(NH4)2SO3溶液呈
②计算第2步反应的平衡常数K=
您最近一年使用:0次
2019-01-12更新
|
457次组卷
|
3卷引用:【市级联考】云南省昆明市2019届高三上学期1月复习诊断测试理科综合化学试题



