1 . 为了实现“碳达峰”和“碳中和”的目标,将CO2转化成可利用的化学能源的“负碳”技术是世界各国关注的焦点。
方法Ⅰ:CO2催化加氢制甲醇。
以CO2、H2为原料合成CH3OH涉及的反应如下:
反应i:CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH1=-49.0 kJ·mol-1
CH3OH(g) + H2O(g) ΔH1=-49.0 kJ·mol-1
反应ii:CO2(g) + H2(g) CO(g) + H2O(g) ΔH2= +41.0 kJ·mol-1
CO(g) + H2O(g) ΔH2= +41.0 kJ·mol-1
反应iii:CO(g) + 2H2(g) CH3OH(g) ΔH3=
CH3OH(g) ΔH3=
(1)计算反应iii的ΔH3=___________ 。
(2)一定温度和催化剂条件下,0.73mol H2、0.24mol CO2和0.03mol N2(已知N2不参与反应)在总压强为3.0MPa的密闭容器中进行上述反应,平衡时CO2的转化率、CH3OH和CO的选择性随温度的变化曲线如图所示。
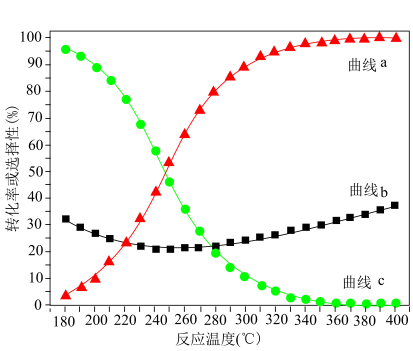
①图中曲线c表示物质___________ 的变化(填“CO2”“CH3OH”或“CO”)。
②上述反应体系在一定条件下建立平衡后,下列说法不正确 的有___________ (填字母)。
A.降低温度,反应i~iii的正、逆反应速率都减小
B.向容器中再通入少量N2,CO2的平衡转化率下降
C.移去部分H2O(g),反应iii向正反应方向衡移动
D.选择合适的催化剂能提高CO2的平衡转化率
③某温度下,t1 min反应到达平衡,测得容器中CH3OH的体积分数为12.5%。此时用CH3OH的分压表示0-t1时间内的反应速率v(CH3OH)=___________ MPa·min-1。设此时n(CO) = a mol,计算该温度下反应ii的平衡常数Kx=___________ (用含有a的代数式表示)。[已知:分压=总压 × 该组分物质的量分数;对于反应mA(g) + nB(g) pC(g) + qD(g),
pC(g) + qD(g),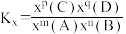 ,x为物质的量分数。]
,x为物质的量分数。]
方法Ⅱ:CO2电解法制甲醇
利用电解原理,可将CO2转化为CH3OH,其装置如图所示:
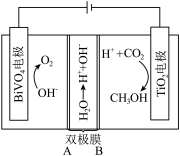
(3)双极膜B侧为___________ (填“阴离子”或“阳离子”)交换膜。
(4)TiO2电极上电极反应方程式:___________ 。
方法Ⅲ:CO2催化加氢制低碳烯烃(2~4个C的烯烃)
某研究小组使用Zn-Ga-O/SAPO-34双功能催化剂实现了CO2直接合成低碳烯烃,并给出了其可能的反应历程(如图所示)。H2首先在Zn-Ga-O表面解离成2个H*,随后参与到CO2的还原过程;SAPO-34则催化生成的甲醇转化为低碳烯烃。
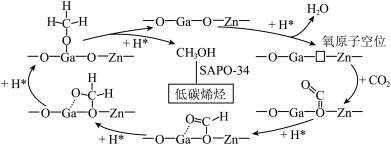
注:☐表示氧原子空位,*表示吸附在催化剂上的微粒。
(5)理论上,反应历程中消耗的H*与生成的甲醇的物质的量之比为___________ 。
方法Ⅰ:CO2催化加氢制甲醇。
以CO2、H2为原料合成CH3OH涉及的反应如下:
反应i:CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ΔH1=-49.0 kJ·mol-1
CH3OH(g) + H2O(g) ΔH1=-49.0 kJ·mol-1反应ii:CO2(g) + H2(g)
 CO(g) + H2O(g) ΔH2= +41.0 kJ·mol-1
CO(g) + H2O(g) ΔH2= +41.0 kJ·mol-1反应iii:CO(g) + 2H2(g)
 CH3OH(g) ΔH3=
CH3OH(g) ΔH3=(1)计算反应iii的ΔH3=
(2)一定温度和催化剂条件下,0.73mol H2、0.24mol CO2和0.03mol N2(已知N2不参与反应)在总压强为3.0MPa的密闭容器中进行上述反应,平衡时CO2的转化率、CH3OH和CO的选择性随温度的变化曲线如图所示。

①图中曲线c表示物质
②上述反应体系在一定条件下建立平衡后,下列说法
A.降低温度,反应i~iii的正、逆反应速率都减小
B.向容器中再通入少量N2,CO2的平衡转化率下降
C.移去部分H2O(g),反应iii向正反应方向衡移动
D.选择合适的催化剂能提高CO2的平衡转化率
③某温度下,t1 min反应到达平衡,测得容器中CH3OH的体积分数为12.5%。此时用CH3OH的分压表示0-t1时间内的反应速率v(CH3OH)=
 pC(g) + qD(g),
pC(g) + qD(g),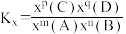 ,x为物质的量分数。]
,x为物质的量分数。] 方法Ⅱ:CO2电解法制甲醇
利用电解原理,可将CO2转化为CH3OH,其装置如图所示:

(3)双极膜B侧为
(4)TiO2电极上电极反应方程式:
方法Ⅲ:CO2催化加氢制低碳烯烃(2~4个C的烯烃)
某研究小组使用Zn-Ga-O/SAPO-34双功能催化剂实现了CO2直接合成低碳烯烃,并给出了其可能的反应历程(如图所示)。H2首先在Zn-Ga-O表面解离成2个H*,随后参与到CO2的还原过程;SAPO-34则催化生成的甲醇转化为低碳烯烃。

注:☐表示氧原子空位,*表示吸附在催化剂上的微粒。
(5)理论上,反应历程中消耗的H*与生成的甲醇的物质的量之比为
您最近一年使用:0次
2 . 在某一反应温度下,已知反应(1) 的标准平衡常数为
的标准平衡常数为 。在相同反应条件下,反应(2)
。在相同反应条件下,反应(2) 的标准平衡常数
的标准平衡常数 为
为
 的标准平衡常数为
的标准平衡常数为 。在相同反应条件下,反应(2)
。在相同反应条件下,反应(2) 的标准平衡常数
的标准平衡常数 为
为| A.4 | B.0.5 | C.2 | D.1 |
您最近一年使用:0次
名校
解题方法
3 . 含氮化合物在生产生活中有重要的应用。请回答:
(1) 与含硫化合物的热化学方程式如下:
与含硫化合物的热化学方程式如下:
反应I: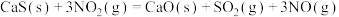
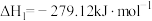

反应II:
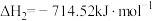

反应III:



_______  ,三个反应的平衡常数的
,三个反应的平衡常数的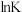 随温度变化关系如图所示,则表示
随温度变化关系如图所示,则表示 的曲线是
的曲线是_______ 。
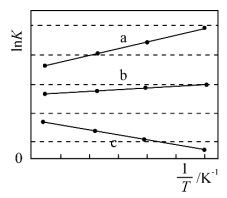
(2)合成氨工厂以“水煤气”和 为原料,采用两段间接换热式绝热反应器,由进气口充入一定量含CO、
为原料,采用两段间接换热式绝热反应器,由进气口充入一定量含CO、 、
、 、
、 的混合气体,在反应器A进行合成氨,其催化剂III铁触媒,在500℃活性最大,反应器B中主要发生的反应为:
的混合气体,在反应器A进行合成氨,其催化剂III铁触媒,在500℃活性最大,反应器B中主要发生的反应为:
 ,装置如图。
,装置如图。
①温度比较:气流a_______ 气流b(填“>”“<”或“=”)。
②气体流速一定,经由催化剂I到催化剂II,原料转化率有提升,其可能原因是:_______ 。
③下列说法正确的是_______ 。
A.焦炭与水蒸气制水煤气时,适当加快通入水蒸气的流速,有利于水煤气的生成
B.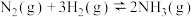
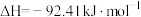 反应器温度越低,终端出口2收率越高
反应器温度越低,终端出口2收率越高
C.终端出口2得到的气体,通过水吸收,再加热水溶液,可分离出
D.反应原料气从进气口105℃到300℃出口1,已完成氨的合成
(3)已知水中存在电离平衡 ,称为自偶电离。-33℃液氨中也存在自偶电离,请写出液氨中的自偶电离方程式:
,称为自偶电离。-33℃液氨中也存在自偶电离,请写出液氨中的自偶电离方程式:_______ ,液氨自偶电离平衡常数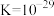 ,在100mL液氨中加入0.0001 mol
,在100mL液氨中加入0.0001 mol  固体,溶解,并完全电离(忽略体积变化),则
固体,溶解,并完全电离(忽略体积变化),则
_______  。金属钾能溶解于液氨中形成蓝色的液氨溶液,反应的化学方程式为
。金属钾能溶解于液氨中形成蓝色的液氨溶液,反应的化学方程式为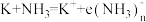 (电子的氨合物,显蓝色),加入
(电子的氨合物,显蓝色),加入 固体后生成氢气,请写出离子方程式
固体后生成氢气,请写出离子方程式_______ 。
(1)
 与含硫化合物的热化学方程式如下:
与含硫化合物的热化学方程式如下:反应I:
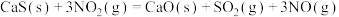
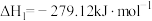

反应II:

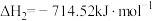

反应III:




 ,三个反应的平衡常数的
,三个反应的平衡常数的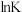 随温度变化关系如图所示,则表示
随温度变化关系如图所示,则表示 的曲线是
的曲线是
(2)合成氨工厂以“水煤气”和
 为原料,采用两段间接换热式绝热反应器,由进气口充入一定量含CO、
为原料,采用两段间接换热式绝热反应器,由进气口充入一定量含CO、 、
、 、
、 的混合气体,在反应器A进行合成氨,其催化剂III铁触媒,在500℃活性最大,反应器B中主要发生的反应为:
的混合气体,在反应器A进行合成氨,其催化剂III铁触媒,在500℃活性最大,反应器B中主要发生的反应为:
 ,装置如图。
,装置如图。
①温度比较:气流a
②气体流速一定,经由催化剂I到催化剂II,原料转化率有提升,其可能原因是:
③下列说法正确的是
A.焦炭与水蒸气制水煤气时,适当加快通入水蒸气的流速,有利于水煤气的生成
B.
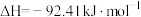 反应器温度越低,终端出口2收率越高
反应器温度越低,终端出口2收率越高C.终端出口2得到的气体,通过水吸收,再加热水溶液,可分离出

D.反应原料气从进气口105℃到300℃出口1,已完成氨的合成
(3)已知水中存在电离平衡
 ,称为自偶电离。-33℃液氨中也存在自偶电离,请写出液氨中的自偶电离方程式:
,称为自偶电离。-33℃液氨中也存在自偶电离,请写出液氨中的自偶电离方程式: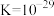 ,在100mL液氨中加入0.0001 mol
,在100mL液氨中加入0.0001 mol  固体,溶解,并完全电离(忽略体积变化),则
固体,溶解,并完全电离(忽略体积变化),则
 。金属钾能溶解于液氨中形成蓝色的液氨溶液,反应的化学方程式为
。金属钾能溶解于液氨中形成蓝色的液氨溶液,反应的化学方程式为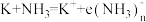 (电子的氨合物,显蓝色),加入
(电子的氨合物,显蓝色),加入 固体后生成氢气,请写出离子方程式
固体后生成氢气,请写出离子方程式
您最近一年使用:0次
解题方法
4 . 2021年11月2日,第四届世界顶尖科学家碳大会——通往“双碳目标”的科技之路论坛在上海召开。我国科学家刘科提到了绿色甲醇技术,将 转化为甲醇是实现碳达峰、碳命题:中和的一种非常重要的路径。发生的主要反应如下。
转化为甲醇是实现碳达峰、碳命题:中和的一种非常重要的路径。发生的主要反应如下。
Ⅰ.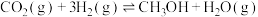

Ⅱ.

Ⅲ.

回答下列问题:
(1)已知上述反应Ⅰ、Ⅱ、Ⅲ的平衡常数K与温度T的关系为: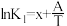 ,
,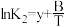 ,
,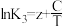 (x、y、z、A、B、C均为常数,A、C均大于零,B小于零)。则反应Ⅰ的活化能
(x、y、z、A、B、C均为常数,A、C均大于零,B小于零)。则反应Ⅰ的活化能 (正)
(正) _______ 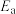 (逆),
(逆),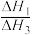 的数值范围是
的数值范围是_______ 。
(2)最近科学家采用真空封管法制备磷化硼纳米颗粒,可用 与
与 合成
合成 [
[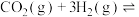
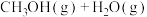 ],反应的催化剂,在发展非金属催化剂实现
],反应的催化剂,在发展非金属催化剂实现 电催化还原制备甲醇方向取得重要进展,该反应历程的相对能量差值如图所示(部分物质未画出)。反应历程如图所示:
电催化还原制备甲醇方向取得重要进展,该反应历程的相对能量差值如图所示(部分物质未画出)。反应历程如图所示: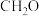 ,其中相对较少的副产物为
,其中相对较少的副产物为_______ 。
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_______ (填字母)的能量变化。
A.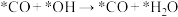 B.
B.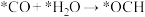
C. D.
D.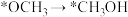
(3)向三个体积均为2 L的恒容密闭容器中分别充入1 mol 和3 mol
和3 mol  ,在不同催化剂作用下仅发生反应I,测得在不同催化剂催化作用下反应相同时间内反应1中
,在不同催化剂作用下仅发生反应I,测得在不同催化剂催化作用下反应相同时间内反应1中 的转化率随温度变化的数据如下表所示。(
的转化率随温度变化的数据如下表所示。( 时,
时, 的转化率为66.67%。即转化了
的转化率为66.67%。即转化了 )
)
①在温度为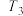 时,催化效果最好的催化剂是
时,催化效果最好的催化剂是_______ (填“催化剂a”、“催化剂b”或“催化剂c”)。
②温度为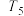 时,该反应的浓度平衡常数
时,该反应的浓度平衡常数
_______ 。
(4)当压强分别为 、
、 时,将
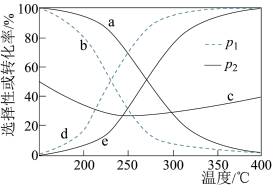
时,将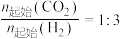 的混合气体置于某恒压密闭容器中同时发生反应Ⅰ和反应Ⅱ,不同温度下体系中
的混合气体置于某恒压密闭容器中同时发生反应Ⅰ和反应Ⅱ,不同温度下体系中 的平衡转化率和
的平衡转化率和 、
、 的选择性如下图所示。{
的选择性如下图所示。{ [或
[或 ]的选择性
]的选择性 }
}_______ (填“ ”或“CO”)的选择性,原因是
”或“CO”)的选择性,原因是_______ 。
②
_______ (填“>”或“<”) 。
。
 转化为甲醇是实现碳达峰、碳命题:中和的一种非常重要的路径。发生的主要反应如下。
转化为甲醇是实现碳达峰、碳命题:中和的一种非常重要的路径。发生的主要反应如下。Ⅰ.
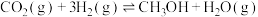

Ⅱ.


Ⅲ.


回答下列问题:
(1)已知上述反应Ⅰ、Ⅱ、Ⅲ的平衡常数K与温度T的关系为:
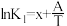 ,
,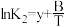 ,
,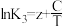 (x、y、z、A、B、C均为常数,A、C均大于零,B小于零)。则反应Ⅰ的活化能
(x、y、z、A、B、C均为常数,A、C均大于零,B小于零)。则反应Ⅰ的活化能 (正)
(正) 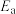 (逆),
(逆),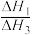 的数值范围是
的数值范围是(2)最近科学家采用真空封管法制备磷化硼纳米颗粒,可用
 与
与 合成
合成 [
[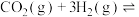
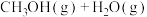 ],反应的催化剂,在发展非金属催化剂实现
],反应的催化剂,在发展非金属催化剂实现 电催化还原制备甲醇方向取得重要进展,该反应历程的相对能量差值如图所示(部分物质未画出)。反应历程如图所示:
电催化还原制备甲醇方向取得重要进展,该反应历程的相对能量差值如图所示(部分物质未画出)。反应历程如图所示: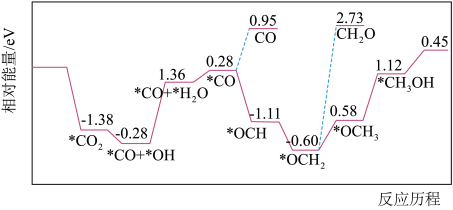
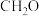 ,其中相对较少的副产物为
,其中相对较少的副产物为②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中
A.
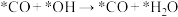 B.
B.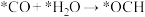
C.
 D.
D.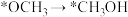
(3)向三个体积均为2 L的恒容密闭容器中分别充入1 mol
 和3 mol
和3 mol  ,在不同催化剂作用下仅发生反应I,测得在不同催化剂催化作用下反应相同时间内反应1中
,在不同催化剂作用下仅发生反应I,测得在不同催化剂催化作用下反应相同时间内反应1中 的转化率随温度变化的数据如下表所示。(
的转化率随温度变化的数据如下表所示。( 时,
时, 的转化率为66.67%。即转化了
的转化率为66.67%。即转化了 )
)温度 转化率 使用的催化剂 |  |  | 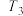 | 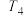 | 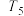 |
| 催化剂a | 65% | 77% | 80% | 80% | 66.67% |
| 催化剂b | 56% | 67% | 76% | 80% | 66.67% |
| 催化剂c | 48% | 62% | 72% | 80% | 66.67% |
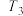 时,催化效果最好的催化剂是
时,催化效果最好的催化剂是②温度为
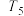 时,该反应的浓度平衡常数
时,该反应的浓度平衡常数
(4)当压强分别为
 、
、 时,将
时,将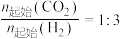 的混合气体置于某恒压密闭容器中同时发生反应Ⅰ和反应Ⅱ,不同温度下体系中
的混合气体置于某恒压密闭容器中同时发生反应Ⅰ和反应Ⅱ,不同温度下体系中 的平衡转化率和
的平衡转化率和 、
、 的选择性如下图所示。{
的选择性如下图所示。{ [或
[或 ]的选择性
]的选择性 }
}
 ”或“CO”)的选择性,原因是
”或“CO”)的选择性,原因是②

 。
。
您最近一年使用:0次
解题方法
5 . 甲醛是重要的化工原料之一,可作为制备酚醛树脂、维纶、染料、农药和消毒剂等的原料。
(1)工业制取甲醛的方法之一为甲醇氧化法。
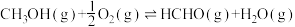

①已知: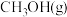 、
、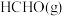 的燃烧热
的燃烧热 分别为
分别为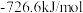 、
、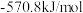 ;
;
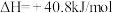 ;计算制备甲醛反应的反应热
;计算制备甲醛反应的反应热 =
=_______ 。
②在容积固定为 的密闭容器中通入
的密闭容器中通入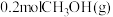
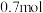 空气(设空气中氧气的体积分数为
空气(设空气中氧气的体积分数为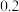 ),并加入
),并加入 催化剂,在
催化剂,在 、起始压强为
、起始压强为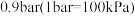 下进行反应。计算反应达到平衡时容器内
下进行反应。计算反应达到平衡时容器内 的分压
的分压_______ 。(所有气体均视作理想气体, 时反应的平衡常数
时反应的平衡常数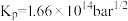 )
)
③与工业制备甲醛的方法类似,工业制备乙醛也可采用空气氧化法,还可采用乙醇脱氢法。已知: 时
时
反应Ⅰ:
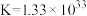
反应Ⅱ:
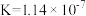
比较两种方法的优缺点______________ 。
(2)一种将电氧化法和电还原法联合处理含甲醛的废水的装置如图所示。
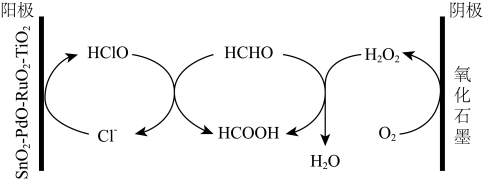
①写出阴极反应的电极反应式______________ ,阳极反应的电极反应式______________ 。
②若外电路通过 电子的电量,计算理论上能处理甲醛的质量
电子的电量,计算理论上能处理甲醛的质量______________ 。
(1)工业制取甲醛的方法之一为甲醇氧化法。
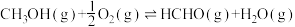

①已知:
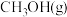 、
、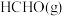 的燃烧热
的燃烧热 分别为
分别为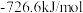 、
、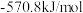 ;
;
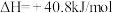 ;计算制备甲醛反应的反应热
;计算制备甲醛反应的反应热 =
=②在容积固定为
 的密闭容器中通入
的密闭容器中通入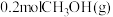
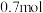 空气(设空气中氧气的体积分数为
空气(设空气中氧气的体积分数为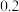 ),并加入
),并加入 催化剂,在
催化剂,在 、起始压强为
、起始压强为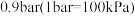 下进行反应。计算反应达到平衡时容器内
下进行反应。计算反应达到平衡时容器内 的分压
的分压 时反应的平衡常数
时反应的平衡常数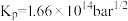 )
)③与工业制备甲醛的方法类似,工业制备乙醛也可采用空气氧化法,还可采用乙醇脱氢法。已知:
 时
时反应Ⅰ:

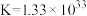
反应Ⅱ:

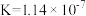
比较两种方法的优缺点
(2)一种将电氧化法和电还原法联合处理含甲醛的废水的装置如图所示。

①写出阴极反应的电极反应式
②若外电路通过
 电子的电量,计算理论上能处理甲醛的质量
电子的电量,计算理论上能处理甲醛的质量
您最近一年使用:0次
6 .  溶液中存在如下平衡:
溶液中存在如下平衡:
(i)

(ii)

 时,
时, 溶液中
溶液中 随pH的变化关系如图,下列有关
随pH的变化关系如图,下列有关 溶液的说法正确的是
溶液的说法正确的是

 溶液中存在如下平衡:
溶液中存在如下平衡:(i)


(ii)


 时,
时, 溶液中
溶液中 随pH的变化关系如图,下列有关
随pH的变化关系如图,下列有关 溶液的说法正确的是
溶液的说法正确的是
| A.通入足量氯化氢,溶液橙红色加深 |
B.向溶液中加入足量的硝酸银溶液, 、 、 、 、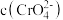 均减小 均减小 |
C.加入少量水稀释,平衡时 与 与 的比值减小 的比值减小 |
D.由于缺少数据,无法计算 时溶液中 时溶液中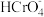 的浓度 的浓度 |
您最近一年使用:0次



