名校
解题方法
1 . 已知下列反应的平衡常数: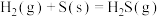 ,
, ;
; ,
, ;则反应
;则反应 的平衡常数是
的平衡常数是
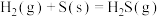 ,
, ;
; ,
, ;则反应
;则反应 的平衡常数是
的平衡常数是A. | B. | C. | D.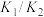 |
您最近一年使用:0次
2024-03-05更新
|
143次组卷
|
65卷引用:2.2.3化学平衡常数 课中
2.2.3化学平衡常数 课中(已下线)2.3.3+化学平衡常数-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)2.3.3化学平衡常数(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时1 化学平衡常数 平衡转化率人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时2 化学平衡常数及相关计算选择性必修1(SJ)专题2第二单元课时3 化学平衡常数平衡转化率(已下线)2.2.1 化学平衡状态 化学平衡常数 -2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)第二章 化学反应速率与化学平衡 第二节 化学平衡 第2课时 化学平衡常数河北省石家庄市第四十二中学2023-2024学年高二上学期第一次月考化学试题甘肃省兰州市教育局第四片区联考2023-2024学年高二上学期期中考试化学试题黑龙江省佳木斯市四校联考2023-2024学年高二上学期11月期中化学考试试题广东省台山市某校2023-2024学年高二上学期期中考试化学试题湖南省衡阳县第四中学2023-2024学年高二上学期11月期中化学试题2015-2016学年内蒙古巴彦淖尔高二上10月月考化学试卷2015-2016学年重庆市第一中学高二上期中测试化学试卷2016-2017学年四川省成都外国语学校高二上10月月考化学试卷陕西省渭南市尚德中学2017-2018学年高二第一次教学质量检测化学试题甘肃省兰州第一中学2017-2018学年高二上学期期中考试化学(理)试题湖南省娄底市第四中学2018-2019学年高二上学期10月月考化学试题江西省九江市同文中学2018-2019学年高二上学期期中考试化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高二上学期期末考试化学试题四川省遂宁市2018-2019学年高二下学期期末考试化学试题(已下线)2019年9月16日《每日一题》选修4—— 化学平衡常数甘肃省甘谷第一中学2019-2020学年高二上学期第一次月考化学试题山东省日照市第一中学2019-2020学年高二10月月考化学试题吉林省吉化第一高级中学校2019-2020学年高二9月月考化学试题新疆乌鲁木齐市第四中学2019-2020学年高二上学期期中考试化学试题广东省梅州市水寨中学2019-2020学年高二上学期期中考试化学试题湖南省长沙市长郡中学2019-2020学年高二上学期期中考试化学试题安徽省黄山市“八校联盟”2019-2020学年高二上学期期中考试化学试题四川省自贡市田家炳中学2019-2020学年高二下学期开学考试化学试题(已下线)【南昌新东方】江西省九江市同文中学2018-2019学年高二上学期期中考试化学试题福建省泰宁第一中学2019-2020学年高二上学期第一阶段考试化学(选考)试题安徽省舒城中学2020-2021学年高二上学期第二次月考化学试题河北省鸡泽县第一中学2020-2021学年高二上学期第一次月考化学试题河北省张家口市宣化区宣化第一中学2020-2021学年高二上学期10月月考化学试题黑龙江省伊春市伊美区第二中学2020-2021学年高二上学期第一次月考化学试题辽宁省大连市一〇三中学2020-2021学年高二10月月考化学试题(已下线)【浙江新东方】绍兴qw122湖南省武冈市第二中学2021-2022学年高二上学期开学摸底考试化学试题天津市武清区梅厂中学2021-2022学年高二上学期阶段性练习化学试题黑龙江省绥化市望奎县第一中学2021-2022学年高二上学期第一次月考化学试题江苏省盐城市实验高级中学(新洋高级中学)2020-2021学年高二下学期期中考试化学试题(已下线)2.2.3 化学平衡常数(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)重庆市清华中学校2021—2022学年上学期高二10月月考化学试题福建省福州黎明中学2021-2022学年高二上学期期中考试化学试题广东省揭阳华侨高级中学2021-2022学年高二上学期第一次阶段考试化学试题山东省济宁市泗水县2021-2022学年高二上学期期中考试化学试题广西柳州市第三中学2022-2023学年高二上学期10月月考化学试题陕西省宝鸡市千阳县中学2022-2023学年高二上学期第一次月考(理)化学试题福建省建瓯市芝华中学2021-2022学年高二上学期期中考试化学试题福建省建瓯市芝华中学2022-2023学年高二上学期期中考试化学试题福建省福州第十五中学2022-2023学年高二上学期11月线上限时训练化学试题(已下线)第3讲 化学平衡计算 平衡常数河南省焦作市博爱县第一中学2023-2024学年高三上学期9月月考化学试题甘肃省武威市民勤县第一中学2023-2024学高二下学期开学考试化学试题2016届湖南省衡阳县第四中学高三9月月考试化学试卷2015-2016学年吉林省松原市油田高中高一下期末化学试卷辽宁省庄河市高级中学2016-2017学年高一下学期期末考试化学试题安徽省亳州市涡阳县第九中学2019-2020学年高一7月月考化学试题广东省广州大学附属中学2019-2020学年高一下学期期末考试化学试题广东省广州大学附属中学等三校2019~2020学年高一下学期期末联考化学试题(已下线)第20讲 化学平衡常数及转化率的计算(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向23 化学平衡常数及其应用-备战2022年高考化学一轮复习考点微专题(已下线)第27练 化学平衡-2023年高考化学一轮复习小题多维练(全国通用)
解题方法
2 . 顺1,2二甲基环丙烷和反1,2二甲基环丙烷可发生如下转化:

该反应的速率方程可表示为:v(正)=k(正)·c(顺)和v(逆)=k(逆)·c(反),k(正)和k(逆)在一定温度时为常数,分别称作正、逆反应速率常数。已知:t1温度下,k(正)=0.006 s-1,k(逆)=0.002 s-1,该温度下反应的平衡常数值K=_______ 。

该反应的速率方程可表示为:v(正)=k(正)·c(顺)和v(逆)=k(逆)·c(反),k(正)和k(逆)在一定温度时为常数,分别称作正、逆反应速率常数。已知:t1温度下,k(正)=0.006 s-1,k(逆)=0.002 s-1,该温度下反应的平衡常数值K=
您最近一年使用:0次
解题方法
3 . 完成下列问题
(1)已知反应CO(g)+2H2(g) CH3OH(g),在恒容密闭容器中按
CH3OH(g),在恒容密闭容器中按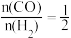 加入CO和H2合成甲醇,测得起始压强p0=102 kPa。CO的平衡转化率[α(CO)]随温度的变化曲线如图所示,R点时反应的平衡常数Kp=
加入CO和H2合成甲醇,测得起始压强p0=102 kPa。CO的平衡转化率[α(CO)]随温度的变化曲线如图所示,R点时反应的平衡常数Kp=___________ (kPa)-2(用平衡分压代替平衡浓度计算,p分=p总×物质的量分数),R、S两点平衡常数大小:Kp(R)___________ (填“>”“=”或“<”)Kp(S)。

(2)CO可用于合成甲醇,反应的化学方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应的ΔH
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应的ΔH___________ 0(填“>”或“<”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是___________ 。

(1)已知反应CO(g)+2H2(g)
 CH3OH(g),在恒容密闭容器中按
CH3OH(g),在恒容密闭容器中按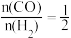 加入CO和H2合成甲醇,测得起始压强p0=102 kPa。CO的平衡转化率[α(CO)]随温度的变化曲线如图所示,R点时反应的平衡常数Kp=
加入CO和H2合成甲醇,测得起始压强p0=102 kPa。CO的平衡转化率[α(CO)]随温度的变化曲线如图所示,R点时反应的平衡常数Kp=
(2)CO可用于合成甲醇,反应的化学方程式为CO(g)+2H2(g)
 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应的ΔH
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应的ΔH
您最近一年使用:0次
4 . H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
(1)平衡时CO2的浓度为_______ 。
(2)H2S的平衡转化率α1=_______ %,反应平衡常数K=_______ 。
 COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。(1)平衡时CO2的浓度为
(2)H2S的平衡转化率α1=
您最近一年使用:0次
解题方法
5 . 已知25 ℃时,Ksp[Fe(OH)3]=8×10-39。
(1)该温度下反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数为
Fe3++3H2O的平衡常数为_________________ (列式并计算)。
(2)向0.001 mol·L-1 FeCl3溶液中通入氨气(体积变化忽略不计),开始沉淀时溶液的pH为___________ (lg 5=0.7)。
(1)该温度下反应Fe(OH)3+3H+
 Fe3++3H2O的平衡常数为
Fe3++3H2O的平衡常数为(2)向0.001 mol·L-1 FeCl3溶液中通入氨气(体积变化忽略不计),开始沉淀时溶液的pH为
您最近一年使用:0次
名校
解题方法
6 . 某温度下,反应2A(g)+B(g)  2C(g)的平衡常数K1=50,在同一温度下,反应2C(g)
2C(g)的平衡常数K1=50,在同一温度下,反应2C(g)  2A(g)+B(g)的平衡常数K2为
2A(g)+B(g)的平衡常数K2为
| A.2500 | B.50 | C.0.02 | D.0.002 |
您最近一年使用:0次
2023-08-27更新
|
810次组卷
|
11卷引用:作业(十) 化学平衡常数平衡转化率
作业(十) 化学平衡常数平衡转化率甘肃省天水市第一中学2023-2024学年高二上学期10月月考化学试题新疆生产建设兵团第二师八一中学2023-2024学年高二上学期第一次月考化学试题湖南省益阳市桃江县第四中学2023-2024学年高二上学期第一次月考化学试卷云南省曲靖市罗平县第三中学2020届高二下学期开学考试化学试题福建省三明第一中学2021-2022学年高二上学期第一次月考化学试题云南省玉溪市第二中学2021-2022学年高二上学期期中考试化学试题云南省玉溪市江川区第二中学2021-2022学年高二上学期期中考试化学试题新疆哈密市第八中学2022-2023学年高二上学期期中考试化学试题福建省泉州市南安市侨光中学2022-2023学年高二上学期10月月考化学试题吉林省长春市第二十九中学2019-2020学年高一下学期期中考试化学试题(理)
解题方法
7 . 无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)⇌2NO2(g) ΔH=+24.4 kJ·mol-1。上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则Kp为_______ (以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,v正=_______ kPa·s-1。
您最近一年使用:0次
8 . 在一定温度下的密闭容器中,加入1 mol CO和1 mol H2O发生反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),达到平衡时测得n(H2)=0.5 mol,下列说法不正确的是
| A.在该温度下,反应的平衡常数K=1 |
| B.平衡常数与反应温度无关 |
| C.CO的平衡转化率为50% |
| D.平衡时n(H2O)=0.5 mol |
您最近一年使用:0次
2023-08-26更新
|
629次组卷
|
9卷引用:第1课时 化学平衡常数 平衡转化率
第1课时 化学平衡常数 平衡转化率鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时1 化学平衡常数 平衡转化率(已下线)第04讲 化学平衡状态 化学平衡常数-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)新疆塔城地区第一高级中学2023-2024学年高二上学期9月月考化学试题陕西省渭南市蒲城县蒲城中学2023-2024学年高二上学期期中考试化学试题吉林省白城市洮南市第一中学2020-2021学年高二上学期第一次月考化学试题黑龙江省哈尔滨师范大学附属中学2021-2022学年高二上学期开学考试化学试题河南省内乡县第三高级中学2021-2022学年高二上学期第一次月考化学试卷吉林省吉林市2022-2023学年高二上学期期中调研测试化学试题
9 . 醇烃化新技术是近几年合成氨工业净化精炼原料气、除去少量CO的一种新方法。其原理可分为甲醇化和甲烷化两个部分。
甲醇化:CO(g)+2H2(g) CH3OH(g) ΔH1=-111 kJ·mol-1
CH3OH(g) ΔH1=-111 kJ·mol-1
甲烷化:CO(g)+3H2(g) CH4(g)+H2O(g) ΔH2=-203 kJ·mol-1
CH4(g)+H2O(g) ΔH2=-203 kJ·mol-1
(1)下列措施有利于提高醇烃化过程中CO转化率的是___________。
(2)甲醇化平衡常数可用Kα= 表示;α为平衡组分中各物质的物质的量分数。若CO与H2混合原料气中CO的体积分数为1%,经甲醇化后CO的平衡转化率为w,则Kα=
表示;α为平衡组分中各物质的物质的量分数。若CO与H2混合原料气中CO的体积分数为1%,经甲醇化后CO的平衡转化率为w,则Kα=___________ (用含w的表达式表示)。
(3)测试a、b两种催化剂在不同压强和温度条件下,甲醇化过程中催化效率如图:
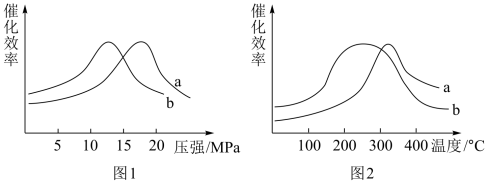
从上图可知选择哪种催化剂较好___________ (填a或b),理由是___________ 。
甲醇化:CO(g)+2H2(g)
 CH3OH(g) ΔH1=-111 kJ·mol-1
CH3OH(g) ΔH1=-111 kJ·mol-1甲烷化:CO(g)+3H2(g)
 CH4(g)+H2O(g) ΔH2=-203 kJ·mol-1
CH4(g)+H2O(g) ΔH2=-203 kJ·mol-1(1)下列措施有利于提高醇烃化过程中CO转化率的是___________。
| A.及时分离出CH3OH | B.适当升高反应温度 |
| C.使用高效的催化剂 | D.适当增大压强 |
 表示;α为平衡组分中各物质的物质的量分数。若CO与H2混合原料气中CO的体积分数为1%,经甲醇化后CO的平衡转化率为w,则Kα=
表示;α为平衡组分中各物质的物质的量分数。若CO与H2混合原料气中CO的体积分数为1%,经甲醇化后CO的平衡转化率为w,则Kα=(3)测试a、b两种催化剂在不同压强和温度条件下,甲醇化过程中催化效率如图:

从上图可知选择哪种催化剂较好
您最近一年使用:0次
10 . 氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面方法由氨气得到氢气。
方法:氨热分解法制氢气
反应2NH3(g) N2(g)+3H2(g) ΔH=+90.8 kJ·mol-1;
N2(g)+3H2(g) ΔH=+90.8 kJ·mol-1;
(1)已知该反应的ΔS=198.9 J·mol-1·K-1,在下列哪些温度下反应能自发进行?___________(填字母);
(2)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1mol NH3通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。

①若保持容器体积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=___________ mol·L-1·min-1(用含t1的代数式表示);
②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是___________ (用图中a、b、c、d表示),理由是___________ ;
③在该温度下,反应的标准平衡常数Kθ=___________ 。(已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g) gG(g)+hH(g),Kθ=
gG(g)+hH(g),Kθ= ,其中pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
,其中pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
方法:氨热分解法制氢气
反应2NH3(g)
 N2(g)+3H2(g) ΔH=+90.8 kJ·mol-1;
N2(g)+3H2(g) ΔH=+90.8 kJ·mol-1;(1)已知该反应的ΔS=198.9 J·mol-1·K-1,在下列哪些温度下反应能自发进行?___________(填字母);
| A.25 ℃ | B.125 ℃ | C.225 ℃ | D.325 ℃ |

①若保持容器体积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=
②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是
③在该温度下,反应的标准平衡常数Kθ=
 gG(g)+hH(g),Kθ=
gG(g)+hH(g),Kθ= ,其中pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
,其中pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
您最近一年使用:0次



