名校
解题方法
1 . 在密闭容器中进行反应: ,下列说法错误的是
,下列说法错误的是
 ,下列说法错误的是
,下列说法错误的是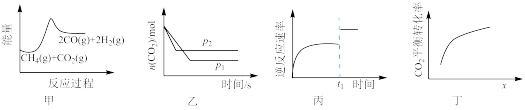
| A.由图甲可知,该反应为吸热反应 |
B.由图乙可知,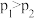 |
C.由图丙可知, 时刻改变的条件可能是加入了催化剂 时刻改变的条件可能是加入了催化剂 |
D.由图丁可知,横坐标 可能是指投料比 可能是指投料比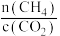 |
您最近一年使用:0次
2022-09-03更新
|
648次组卷
|
10卷引用:福建省莆田五中2023-2024学年高二上学期第三次月考化学试卷
福建省莆田五中2023-2024学年高二上学期第三次月考化学试卷 福建省泉州市2021-2022学年高二上学期期末教学质量监测化学试题河南省中原名校2022-2023学年高二上学期第二次联考化学试题广东省惠州市第一中学2022-2023学年高二上学期第一次月考化学试题陕西省榆林市绥德中学2022-2023学年高二上学期第二次阶段性考试化学试题福建省三明第一中学2022-2023学年高二上学期中考试化学试题山东省济南市莱钢高级中学2022-2023学年高二上学期期中考试化学试题福建省福州市外国语学校2022-2023学年高二上学期12月阶段性测试化学试题福建省厦门外国语学校石狮分校2022-2023学年高二上学期期中考试化学试题福建省福州第三中学2023-2024学年高二上学期1月期末考试化学试题
名校
解题方法
2 . 向真空密闭容器中充入物质A和B,发生反应aA(g)+bB(g) cC(g),经过相同时间,测得物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示,下列说法正确的是
cC(g),经过相同时间,测得物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示,下列说法正确的是
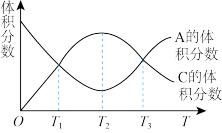
 cC(g),经过相同时间,测得物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示,下列说法正确的是
cC(g),经过相同时间,测得物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示,下列说法正确的是
| A.该反应的正反应是放热反应 |
| B.该反应只有T2温度时处于化学平衡状态 |
| C.该反应在T1、T3温度时均处于化学平衡状态 |
| D.升高温度,该反应化学平衡常数增大 |
您最近一年使用:0次
2020-11-27更新
|
210次组卷
|
2卷引用:福建省莆田第一中学2020-2021学年高二上学期期中考试化学试题
3 . 在某恒容的密闭容器中,可逆反应A(g)+B(g)⇌xC(g)有如图所示的关系曲线,下列说法正确的是


| A.温度:T1>T2 | B.压强:p1>p2 |
| C.正反应是吸热反应 | D.x的值是2 |
您最近一年使用:0次
2020-10-09更新
|
140次组卷
|
2卷引用:福建省仙游县第二中学2022-2023学年高二上学期期中考试(选考班)化学试题
解题方法
4 . 人类过多地使用化石燃料,造成了二氧化碳的大量排放,致使地球气温上升。二氧化碳是温室气体,也是一种重要的资源,如以CO2为基本原料可合成甲醇。回答下列问题:
(1)已知下列热化学方程式:
ⅰ.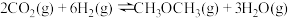

ⅱ.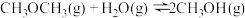

则ⅲ.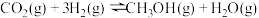
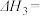
________ 
(2)Deluzarche等人在吸附有氢气的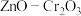 催化剂上通入CO2发生反应,该过程的反应机理如下:
催化剂上通入CO2发生反应,该过程的反应机理如下:
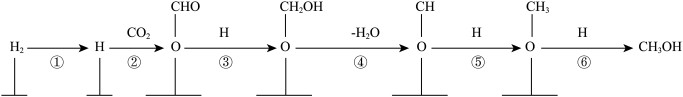
其中涉及非极性键变化的过程是______ (填上图中的数字序号),写出上述过程中总反应的化学方程式:_____ 。
(3)一定条件下,向某密闭容器中按照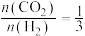 投料,发生反应ⅲ,反应达到平衡时,容器中甲醇的体积分数与压强、温度的关系如下图所示:
投料,发生反应ⅲ,反应达到平衡时,容器中甲醇的体积分数与压强、温度的关系如下图所示:
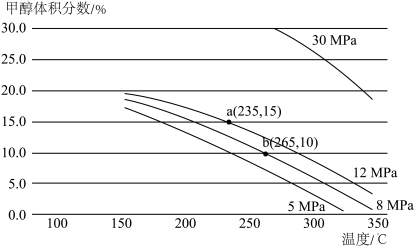
由上图可知,反应物的转化率与压强的关系是:压强增大,CO2的转化率________ (填“减小”“不变”或“增大”),温度为265℃时的平衡常数Kp=________ 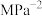 (Kp为用分压表示的平衡常数,分压=总压×体积分数)(保留小数点后四位)。
(Kp为用分压表示的平衡常数,分压=总压×体积分数)(保留小数点后四位)。
(4)将一定量的 、
、 混合气体通入某密闭容器中,在催化剂作用下生成
混合气体通入某密闭容器中,在催化剂作用下生成 ,不同压强下,平衡时混合气体中
,不同压强下,平衡时混合气体中 的体积分数随温度的变化如图所示。
的体积分数随温度的变化如图所示。

则A、B、C三点的平衡常数由大到小的顺序为____ (用 、
、 、
、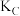 表示),E点变为D点的措施是
表示),E点变为D点的措施是____ 。
(5)以特殊的纳米材料为电极,一定浓度的硫酸作为电解质溶液, 为原料通过电化学方法可制得甲醇,则生成甲醇的电极反应式为
为原料通过电化学方法可制得甲醇,则生成甲醇的电极反应式为_____ 。
(1)已知下列热化学方程式:
ⅰ.
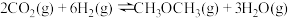

ⅱ.
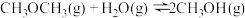

则ⅲ.
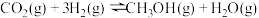
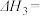

(2)Deluzarche等人在吸附有氢气的
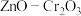 催化剂上通入CO2发生反应,该过程的反应机理如下:
催化剂上通入CO2发生反应,该过程的反应机理如下:
其中涉及非极性键变化的过程是
(3)一定条件下,向某密闭容器中按照
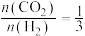 投料,发生反应ⅲ,反应达到平衡时,容器中甲醇的体积分数与压强、温度的关系如下图所示:
投料,发生反应ⅲ,反应达到平衡时,容器中甲醇的体积分数与压强、温度的关系如下图所示:
由上图可知,反应物的转化率与压强的关系是:压强增大,CO2的转化率
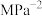 (Kp为用分压表示的平衡常数,分压=总压×体积分数)(保留小数点后四位)。
(Kp为用分压表示的平衡常数,分压=总压×体积分数)(保留小数点后四位)。(4)将一定量的
 、
、 混合气体通入某密闭容器中,在催化剂作用下生成
混合气体通入某密闭容器中,在催化剂作用下生成 ,不同压强下,平衡时混合气体中
,不同压强下,平衡时混合气体中 的体积分数随温度的变化如图所示。
的体积分数随温度的变化如图所示。
则A、B、C三点的平衡常数由大到小的顺序为
 、
、 、
、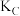 表示),E点变为D点的措施是
表示),E点变为D点的措施是(5)以特殊的纳米材料为电极,一定浓度的硫酸作为电解质溶液,
 为原料通过电化学方法可制得甲醇,则生成甲醇的电极反应式为
为原料通过电化学方法可制得甲醇,则生成甲醇的电极反应式为
您最近一年使用:0次
名校
5 . 下列有关化学反应速率和化学平衡影响的图像,其中图像和实验结论表达正确的是
A.a是其他条件一定时,反应速率随温度变化的图像,正反应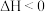 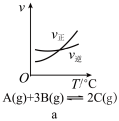 |
B.II是在有无催化剂存在下建立的平衡过程图像,Ⅰ是使用催化剂时的曲线 |
C.c是一定条件下,向含有一定量A的容器中逐渐加入B时的图像 纵坐标为C的物质的量分数 纵坐标为C的物质的量分数 ,压强 ,压强 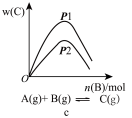 |
D.d是在平衡体系的溶液中加入少量FeCl3固体的化学反应速率随时间变化的图像 |
您最近一年使用:0次
2020-05-10更新
|
450次组卷
|
2卷引用:福建省莆田第一中学2019-2020学年高二上学期期末考试化学试题
名校
6 . 可逆反应aA(g)+bB(g) cC(g)+dD(s)ΔH=QkJ·mol-1,反应过程中,当其他条件不变时,化学平衡常数(K)与温度,C的百分含量与时间的关系如图所示。据图分析,以下说法错误的是
cC(g)+dD(s)ΔH=QkJ·mol-1,反应过程中,当其他条件不变时,化学平衡常数(K)与温度,C的百分含量与时间的关系如图所示。据图分析,以下说法错误的是
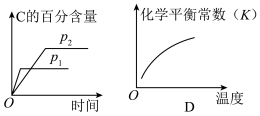
 cC(g)+dD(s)ΔH=QkJ·mol-1,反应过程中,当其他条件不变时,化学平衡常数(K)与温度,C的百分含量与时间的关系如图所示。据图分析,以下说法错误的是
cC(g)+dD(s)ΔH=QkJ·mol-1,反应过程中,当其他条件不变时,化学平衡常数(K)与温度,C的百分含量与时间的关系如图所示。据图分析,以下说法错误的是
| A.Q>0 |
| B.增大压强,B的转化率增大 |
| C.当反应达平衡时,混合气体的密度不再变化 |
| D.p1>p2,a+b<c |
您最近一年使用:0次
2020-05-10更新
|
105次组卷
|
2卷引用:福建省莆田第一中学2019-2020学年高二上学期期末考试化学试题
名校
解题方法
7 . 氢气既是一种优质的能源,又是一种重要化工原料,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式是:
CH2(g)+2H2O(g)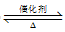 CO2(g)+4H2(g) △H=+165.0kJ·mol-1
CO2(g)+4H2(g) △H=+165.0kJ·mol-1
已知反应器中存在如下反应过程:
I.CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206.4kJ·mol-1
CO(g)+3H2(g) △H1=+206.4kJ·mol-1
II.CO(g)+H2O(g) CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2
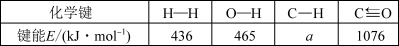
根据上述信息计算:a=___ 、△H2=___ 。
(2)某温度下,4molH2O和lmolCH4在体积为2L的刚性容器内同时发生I、II反应,达平衡时,体系中n(CO)=bmol、n(CO2)=dmol,则该温度下反应I的平衡常数K值为___ (用字母表示)。
(3)欲增大CH4转化为H2的平衡转化率,可采取的措施有___ (填标号)。
A.适当增大反应物投料比武n(H2O):n(CH4)
B.提高压强
C.分离出CO2
(4)H2用于工业合成氨:N2+3H2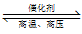 2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是
2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是___ 。

某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始气体总压为2×l07Pa,平衡时总压为开始的90%,则H2的转化率为___ ,气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),此温度下,该反应的化学平衡常数Kp=___ (分压列计算式、不化简)。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式是:
CH2(g)+2H2O(g)
 CO2(g)+4H2(g) △H=+165.0kJ·mol-1
CO2(g)+4H2(g) △H=+165.0kJ·mol-1已知反应器中存在如下反应过程:
I.CH4(g)+H2O(g)
 CO(g)+3H2(g) △H1=+206.4kJ·mol-1
CO(g)+3H2(g) △H1=+206.4kJ·mol-1II.CO(g)+H2O(g)
 CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2
根据上述信息计算:a=
(2)某温度下,4molH2O和lmolCH4在体积为2L的刚性容器内同时发生I、II反应,达平衡时,体系中n(CO)=bmol、n(CO2)=dmol,则该温度下反应I的平衡常数K值为
(3)欲增大CH4转化为H2的平衡转化率,可采取的措施有
A.适当增大反应物投料比武n(H2O):n(CH4)
B.提高压强
C.分离出CO2
(4)H2用于工业合成氨:N2+3H2
 2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是
2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是
某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始气体总压为2×l07Pa,平衡时总压为开始的90%,则H2的转化率为
您最近一年使用:0次
2020-01-02更新
|
607次组卷
|
7卷引用:福建省莆田二中2020-2021学年高三上学期期中检测化学试题
福建省莆田二中2020-2021学年高三上学期期中检测化学试题四省八校2020届高三上学期第一次教学质量检测理综化学试题2020届高三《新题速递·化学》1月第02期(考点11-13)【百强校】江西省南昌市第十中学2020届高三下学期综合模拟考试化学试题(已下线)考点06 化学能与热能-2020年高考化学命题预测与模拟试题分类精编广西壮族自治区桂林市第十八中学2021届高三上学期第一次月考理综化学试题(已下线)04 化学反应原理综合题型集训之多重平衡中的Kp计算(解析)-备战2023年高考化学大题逐空突破系列(全国通用)
名校
8 . 在一定条件下,密闭容器中进行反应CH4(g) + H2O(g)  CO(g) + 3H2(g) ,测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是
CO(g) + 3H2(g) ,测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是

 CO(g) + 3H2(g) ,测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是
CO(g) + 3H2(g) ,测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是
| A.p1>p2 |
| B.ΔH<0 |
| C.加入催化剂可以提高甲烷的转化率 |
| D.恒温下,缩小容器体积,平衡后CH4浓度减小 |
您最近一年使用:0次
2019-02-02更新
|
276次组卷
|
3卷引用:福建省莆田市仙游县枫亭中学2019-2020学年高二上学期期末考试化学试题
名校
解题方法
9 . 反应mX(g) +nY(g)  pZ(g) 在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间的关系如图所示。下述判断
pZ(g) 在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间的关系如图所示。下述判断
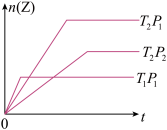
| A.T1<T2 ,P1>P2 |
| B.T1<T2 ,m+n<p |
| C.m+n>p ,正反应放热 |
| D.P1>P2,正反应吸热 |
您最近一年使用:0次
2018-10-31更新
|
212次组卷
|
4卷引用:【全国百强校】福建省仙游第一中学2018-2019学年高二上学期期中考试化学试题



