1 . 为实现“双碳”目标,某科研所研究二氧化碳制备甲醇技术可实现二氧化碳资源化利用、降低碳排放。回答下列问题:
(1)在一定条件下,合成甲醇的过程中主要发生以下反应:
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41kJ•mol-1
CO(g)+H2O(g) △H2=+41kJ•mol-1
Ⅲ.CO(g)+2H2(g) CH3OH(g) △H3=-90.5kJ•mol-1
CH3OH(g) △H3=-90.5kJ•mol-1
反应Ⅰ的△H1=_______ ;增大反应体系的压强(缩小容积),n(CH3OH)_______ (填“变大”“变小”或“不变”)。
(2)在3.0MPa和催化剂下,向1L密闭容器中充入1molCO2和3molH2,平衡时CO2的转化率与CH3OH、CO的选择性随温度的变化如图所示。
[CH3OH或CO的选择性=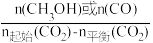 ×100%]
×100%]_______ (填化学式)的选择性;150~250℃之间,以反应______ (填“Ⅰ”或“Ⅱ”)为主。
(3)在上述条件下,反应在200℃时,反应Ⅲ的浓度平衡常数Kc=_______ L2•mol-2(用计算式表示);250℃时,反应达到平衡时测得H2的物质的量为2.0mol,CH3OH的物质的量为0.25mol,则反应Ⅱ的压强平衡常数Kp=_______ (以分压表示,分压=总压×物质的量分数)。
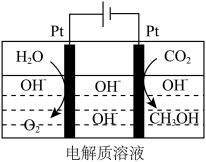
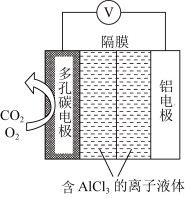
(4)该科研所除在催化剂下用氢气还原二氧化碳制取甲醇外,还研究用如图装置电解法制取甲醇。写出阴极上发生反应的电极反应式_______ 。
(1)在一定条件下,合成甲醇的过程中主要发生以下反应:
Ⅰ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41kJ•mol-1
CO(g)+H2O(g) △H2=+41kJ•mol-1Ⅲ.CO(g)+2H2(g)
 CH3OH(g) △H3=-90.5kJ•mol-1
CH3OH(g) △H3=-90.5kJ•mol-1反应Ⅰ的△H1=
(2)在3.0MPa和催化剂下,向1L密闭容器中充入1molCO2和3molH2,平衡时CO2的转化率与CH3OH、CO的选择性随温度的变化如图所示。
[CH3OH或CO的选择性=
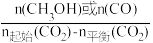 ×100%]
×100%]
(3)在上述条件下,反应在200℃时,反应Ⅲ的浓度平衡常数Kc=
(4)该科研所除在催化剂下用氢气还原二氧化碳制取甲醇外,还研究用如图装置电解法制取甲醇。写出阴极上发生反应的电极反应式
您最近一年使用:0次
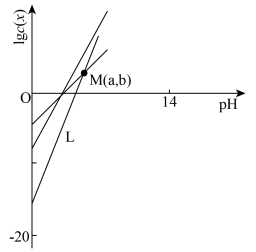
2 . 柠檬酸(H3Cit)是一种重要的三元有机中强酸。常温下,一定pH范围内,存在以下平衡: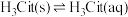 ;
; ;
; ;
;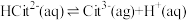 。平衡常数依次为K0、K1、K2、K3。已知lgc(H2Cit-)、1gc(HCit2-)、lgc(Cit3-)随pH变化关系如图所示。下列说法错误的是
。平衡常数依次为K0、K1、K2、K3。已知lgc(H2Cit-)、1gc(HCit2-)、lgc(Cit3-)随pH变化关系如图所示。下列说法错误的是
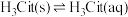 ;
; ;
; ;
;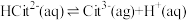 。平衡常数依次为K0、K1、K2、K3。已知lgc(H2Cit-)、1gc(HCit2-)、lgc(Cit3-)随pH变化关系如图所示。下列说法错误的是
。平衡常数依次为K0、K1、K2、K3。已知lgc(H2Cit-)、1gc(HCit2-)、lgc(Cit3-)随pH变化关系如图所示。下列说法错误的是
| A.随pH增大,H3Cit(aq)的浓度保持不变 |
| B.直线L表示lgc(H2Cit-)的变化情况 |
C.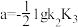 |
| D.pH<a时的某一pH范围内,存在c(HCit2-)>c(H2Cit-)>c(Cit3-) |
您最近一年使用:0次
名校
3 . "碳达峰”“碳中和”是我国社会发展重大战略之一
I.中国首次实现了利用二氧化碳人工合成淀粉,其中最关键的一步是以CO2为原料制CH3OH.在某CO2催化加氢制CH3OH的反应体系中,发生的主要反应有:
①CO2(g)+H2(g) CO(g)+H2O(g) △H1=+41.1kJmol-1
CO(g)+H2O(g) △H1=+41.1kJmol-1
②CO(g)+2H2(g) CH3OH(g) △H2=-90.0kJmol-1
CH3OH(g) △H2=-90.0kJmol-1
③CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3=-48.9kJmol-1
CH3OH(g)+H2O(g) △H3=-48.9kJmol-1
(1)5Mpa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
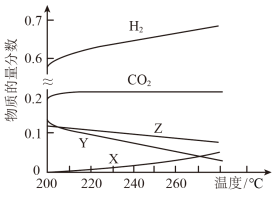
①图中Y代表___________ (填化学式)。
②体系中CO2的物质的量分数受温度影响不大,原因是___________ 。
II.CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
①CH4(g)+CO2(g) 2CO(g)+2H2(g) K1
2CO(g)+2H2(g) K1
②CO2(g)+H2(g) CO(g)+H2O(g) K2
CO(g)+H2O(g) K2
请回答:
(2)反应CH4(g)+3CO2(g) 4CO(g)+2H2O(g)的K=
4CO(g)+2H2O(g)的K=___________ (用K1,K2表示)。
(3)恒压,750°C时,CH4和CO2按物质的量之比1:3投料,经如下流程可实现CO2高效转化。
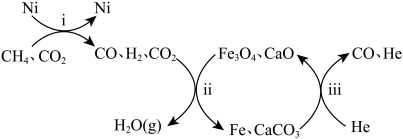
①写出过程ii产生H2O(g)的化学方程式___________ 。
②过程ii的催化剂是___________ ,若CH4和CO2按物质的量之比1:1投料,则会导致过程ii___________ 。
③过程ii平衡后通入稀有气体He,测得一段时间内CO物质的量上升,根据过程iii,结合平衡移动原理,解释CO物质的量上升的原因___________ 。
I.中国首次实现了利用二氧化碳人工合成淀粉,其中最关键的一步是以CO2为原料制CH3OH.在某CO2催化加氢制CH3OH的反应体系中,发生的主要反应有:
①CO2(g)+H2(g)
 CO(g)+H2O(g) △H1=+41.1kJmol-1
CO(g)+H2O(g) △H1=+41.1kJmol-1②CO(g)+2H2(g)
 CH3OH(g) △H2=-90.0kJmol-1
CH3OH(g) △H2=-90.0kJmol-1③CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3=-48.9kJmol-1
CH3OH(g)+H2O(g) △H3=-48.9kJmol-1(1)5Mpa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。

①图中Y代表
②体系中CO2的物质的量分数受温度影响不大,原因是
II.CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
①CH4(g)+CO2(g)
 2CO(g)+2H2(g) K1
2CO(g)+2H2(g) K1②CO2(g)+H2(g)
 CO(g)+H2O(g) K2
CO(g)+H2O(g) K2请回答:
(2)反应CH4(g)+3CO2(g)
 4CO(g)+2H2O(g)的K=
4CO(g)+2H2O(g)的K=(3)恒压,750°C时,CH4和CO2按物质的量之比1:3投料,经如下流程可实现CO2高效转化。

①写出过程ii产生H2O(g)的化学方程式
②过程ii的催化剂是
③过程ii平衡后通入稀有气体He,测得一段时间内CO物质的量上升,根据过程iii,结合平衡移动原理,解释CO物质的量上升的原因
您最近一年使用:0次
解题方法
4 . 甲醇合成丙烯有“一步法”和“两步法”两种合成方式,“一步法”是在催化剂的作用下由甲醇直接合成丙烯;“两步法”则分两步合成,其热化学方程式如下:
反应I:甲醇醚化反应(DME)


反应Ⅱ:含氧化合物制丙烯反应(OTP)


已知部分键能数据如下:
回答下列问题:
(1)“一步法”合成丙烯的热化学方程式为___________ 。合成丙烯时有乙烯等副产物,若选择 作载气时,保持总压不变,调控甲醇和
作载气时,保持总压不变,调控甲醇和 的不同分压,各产物的选择性如下表所示(其他产物略):
的不同分压,各产物的选择性如下表所示(其他产物略):
分析表中数据:要合成得到更多的丙烯,应控制甲醇的最佳分压为___________ MPa。
(2)已知: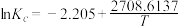 。温度为500K时,在密闭反应器中加入2mol
。温度为500K时,在密闭反应器中加入2mol  ,若只发生反应Ⅰ,达平衡状态时,体系中
,若只发生反应Ⅰ,达平衡状态时,体系中 的物质的量分数为___________(填序号)。
的物质的量分数为___________(填序号)。
(3)“两步法”中,在恒容密闭容器中通入甲醇,初始压强为 ,反应达到平衡时压强为
,反应达到平衡时压强为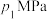 ,则平衡混合体系中,丙烯的体积分数为
,则平衡混合体系中,丙烯的体积分数为___________ (用含 、
、 的式子表示,下同),若平衡时甲醇的转化率为60%,则反应Ⅱ(OTP)的平衡常数
的式子表示,下同),若平衡时甲醇的转化率为60%,则反应Ⅱ(OTP)的平衡常数
___________ 。
(4)“两步法”中存在反应Ⅲ: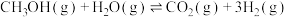 △H,同时也会有芳香烃等副产品,其中丙烯和芳香烃选择性与不同温度下反应I进行的程度的关系如图所示。要提高丙烯的选择性,可采取的措施是
△H,同时也会有芳香烃等副产品,其中丙烯和芳香烃选择性与不同温度下反应I进行的程度的关系如图所示。要提高丙烯的选择性,可采取的措施是___________ ,当温度高于285℃后,丙烯的选择性降低,其原因是___________ 。

反应I:甲醇醚化反应(DME)


反应Ⅱ:含氧化合物制丙烯反应(OTP)


已知部分键能数据如下:
| 化学键 | C-C | C=C | C-H | H-H | O-H | C=O | C-O |
键能/ | 356 | 615 | 413 | 436 | 462 | 745 | 360 |
(1)“一步法”合成丙烯的热化学方程式为
 作载气时,保持总压不变,调控甲醇和
作载气时,保持总压不变,调控甲醇和 的不同分压,各产物的选择性如下表所示(其他产物略):
的不同分压,各产物的选择性如下表所示(其他产物略): 分压/MPa 分压/MPa |  分压/MPa 分压/MPa | 丙烯选择性/% | 乙烯选择性/% |
| 0.10 | 0 | 30.9 | 7.51 |
| 0.08 | 0.02 | 32.0 | 7.42 |
| 0.04 | 0.06 | 34.8 | 7.03 |
| 0.02 | 0.08 | 36.7 | 6.48 |
| 0.01 | 0.09 | 39.4 | 5.43 |
(2)已知:
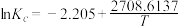 。温度为500K时,在密闭反应器中加入2mol
。温度为500K时,在密闭反应器中加入2mol  ,若只发生反应Ⅰ,达平衡状态时,体系中
,若只发生反应Ⅰ,达平衡状态时,体系中 的物质的量分数为___________(填序号)。
的物质的量分数为___________(填序号)。A.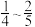 | B. | C. | D.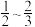 |
(3)“两步法”中,在恒容密闭容器中通入甲醇,初始压强为
 ,反应达到平衡时压强为
,反应达到平衡时压强为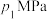 ,则平衡混合体系中,丙烯的体积分数为
,则平衡混合体系中,丙烯的体积分数为 、
、 的式子表示,下同),若平衡时甲醇的转化率为60%,则反应Ⅱ(OTP)的平衡常数
的式子表示,下同),若平衡时甲醇的转化率为60%,则反应Ⅱ(OTP)的平衡常数
(4)“两步法”中存在反应Ⅲ:
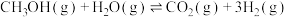 △H,同时也会有芳香烃等副产品,其中丙烯和芳香烃选择性与不同温度下反应I进行的程度的关系如图所示。要提高丙烯的选择性,可采取的措施是
△H,同时也会有芳香烃等副产品,其中丙烯和芳香烃选择性与不同温度下反应I进行的程度的关系如图所示。要提高丙烯的选择性,可采取的措施是
您最近一年使用:0次
名校
解题方法
5 . 工业上制备Ti,采用碳氯化法将 转化成
转化成 。在1000℃时发生如下:
。在1000℃时发生如下:
①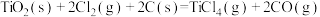
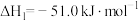
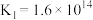
②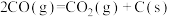
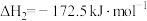
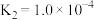
③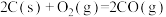
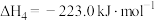
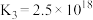 。
。
在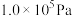 ,将
,将 、C、
、C、 以物质的量比1:2.2:2进行碳氯化,平衡时体系中
以物质的量比1:2.2:2进行碳氯化,平衡时体系中 、CO、
、CO、 和C的组成比(物质的量分数)随温度变化如下图所示。下列说法不正确的是
和C的组成比(物质的量分数)随温度变化如下图所示。下列说法不正确的是
 转化成
转化成 。在1000℃时发生如下:
。在1000℃时发生如下:①
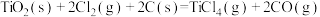
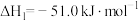
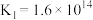
②
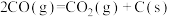
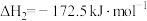
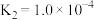
③
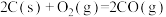
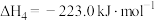
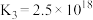 。
。在
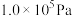 ,将
,将 、C、
、C、 以物质的量比1:2.2:2进行碳氯化,平衡时体系中
以物质的量比1:2.2:2进行碳氯化,平衡时体系中 、CO、
、CO、 和C的组成比(物质的量分数)随温度变化如下图所示。下列说法不正确的是
和C的组成比(物质的量分数)随温度变化如下图所示。下列说法不正确的是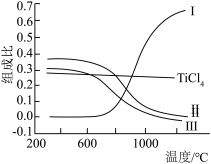
A.1000℃时,反应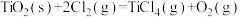 的平衡常数 的平衡常数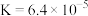 |
B.曲线III表示平衡时 的物质的量分数随温度的变化 的物质的量分数随温度的变化 |
| C.高于600℃,升高温度,主要对反应②的平衡产生影响 |
D.为保证 的平衡产率,选择反应温度应高于1000℃ 的平衡产率,选择反应温度应高于1000℃ |
您最近一年使用:0次
2023-03-23更新
|
1517次组卷
|
5卷引用:江苏省苏锡常镇四市2022-2023学年高三下学期教学情况调研(一)(3月)化学试题
江苏省苏锡常镇四市2022-2023学年高三下学期教学情况调研(一)(3月)化学试题(已下线)专题14 化学反应速率和化学平衡江苏省郑梁梅高级中学2022-2023学年高二下学期4月月考化学试题河北省衡水中学2023-2024学年高三上学期四调考试 化学试题(已下线)FHgkyldyjhx08
名校
解题方法
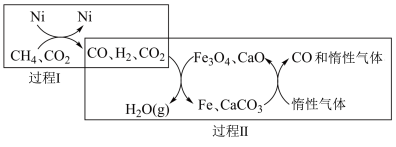
6 .  催化重整
催化重整 技术可得到富含CO的化工原料。回答下列问题:
技术可得到富含CO的化工原料。回答下列问题:
(1) 催化重整
催化重整 的催化转化如图所示:
的催化转化如图所示:
①已知相关反应的能量变化如图所示:
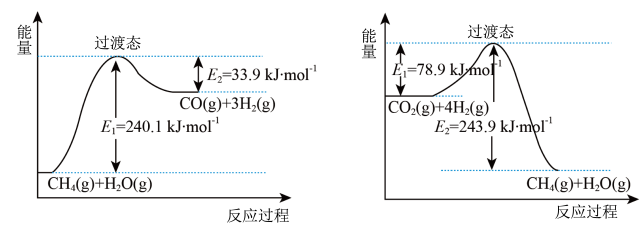
过程Ⅰ的热化学方程式为_______ 。
②关于上述过程Ⅰ、Ⅱ的说法不正确的是_______ (填序号)。
a.过程Ⅱ实现了含碳物质与含氢物质的分离
b.整个催化重整过程,消耗 理论上生成2molCO
理论上生成2molCO
c.过程Ⅰ中,Ni降低了反应的活化能
d. 、CaO为中间产物
、CaO为中间产物
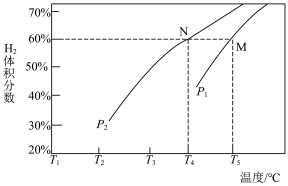
③在体积为3L的密闭容器中,加入甲烷和水蒸气各4mol,在一定条件下反应生成 、CO,测得平衡时
、CO,测得平衡时 的体积分数与温度、压强的关系如图所示。温度为
的体积分数与温度、压强的关系如图所示。温度为 ℃、压强为
℃、压强为 时,N点表示的体系状态
时,N点表示的体系状态
_______  (填“>”、“=”或“<”);M点表示的体系状态
(填“>”、“=”或“<”);M点表示的体系状态 的平衡转化率为
的平衡转化率为_______ %(结果保留一位小数)。
(2)在一刚性密闭容器中, 和
和 的分压分别为20kPa、30kPa,加入
的分压分别为20kPa、30kPa,加入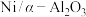 催化剂并加热至1123K使其发生反应
催化剂并加热至1123K使其发生反应 。
。
①研究表明CO的生成速率 ,某时刻测得
,某时刻测得 ,则
,则
_______ kPa,
_______  。
。
②达到平衡后测得体系压强是起始时的1.6倍,则该反应的平衡常数为:
_______  (用各物质的分压代替物质的量浓度计算)。
(用各物质的分压代替物质的量浓度计算)。
(3)一定条件下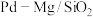 催化剂可使
催化剂可使 “甲烷化”从而变废为宝,其反应机理如图所示,该反应的化学方程式为
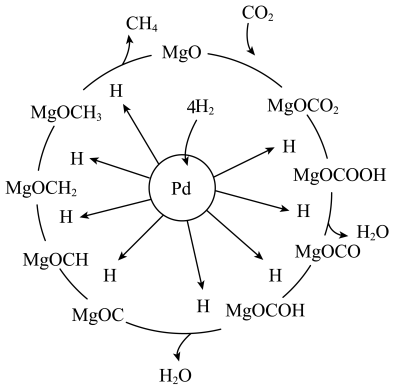
“甲烷化”从而变废为宝,其反应机理如图所示,该反应的化学方程式为_______ ,反应过程中碳元素的化合价为-3价的中间体是_______ 。
 催化重整
催化重整 技术可得到富含CO的化工原料。回答下列问题:
技术可得到富含CO的化工原料。回答下列问题:(1)
 催化重整
催化重整 的催化转化如图所示:
的催化转化如图所示:
①已知相关反应的能量变化如图所示:

过程Ⅰ的热化学方程式为
②关于上述过程Ⅰ、Ⅱ的说法不正确的是
a.过程Ⅱ实现了含碳物质与含氢物质的分离
b.整个催化重整过程,消耗
 理论上生成2molCO
理论上生成2molCOc.过程Ⅰ中,Ni降低了反应的活化能
d.
 、CaO为中间产物
、CaO为中间产物③在体积为3L的密闭容器中,加入甲烷和水蒸气各4mol,在一定条件下反应生成
 、CO,测得平衡时
、CO,测得平衡时 的体积分数与温度、压强的关系如图所示。温度为
的体积分数与温度、压强的关系如图所示。温度为 ℃、压强为
℃、压强为 时,N点表示的体系状态
时,N点表示的体系状态
 (填“>”、“=”或“<”);M点表示的体系状态
(填“>”、“=”或“<”);M点表示的体系状态 的平衡转化率为
的平衡转化率为
(2)在一刚性密闭容器中,
 和
和 的分压分别为20kPa、30kPa,加入
的分压分别为20kPa、30kPa,加入 催化剂并加热至1123K使其发生反应
催化剂并加热至1123K使其发生反应 。
。①研究表明CO的生成速率
 ,某时刻测得
,某时刻测得 ,则
,则

 。
。②达到平衡后测得体系压强是起始时的1.6倍,则该反应的平衡常数为:

 (用各物质的分压代替物质的量浓度计算)。
(用各物质的分压代替物质的量浓度计算)。(3)一定条件下
 催化剂可使
催化剂可使 “甲烷化”从而变废为宝,其反应机理如图所示,该反应的化学方程式为
“甲烷化”从而变废为宝,其反应机理如图所示,该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
7 . 甲烷在化学工业中应用广泛。回答下列问题:
(1)H2捕集CO2合成CH4涉及下列反应:
I.4H2(g)+CO2(g)⇌CH4(g)+2H2O(g) △H1平衡常数K1
II.H2(g)+CO2(g)⇌CO(g)+H2O(g) △H2平衡常数K2
①相关物质相对能量大小如图所示,则△H1=_______ kJ·mol-1,升高温度,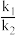
_______ (填“增大”或“减小”)。
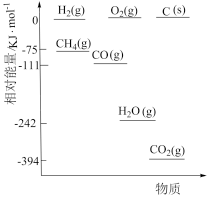
②起始物 =3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)
=3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)_______ vB(逆)(填“大于”、“小于”或“等于”);若C点CH4与CO的分压相同,则p(H2O)=_______ Pa,反应I以物质的量分数表示的平衡常数KxI=_______ 。

(2)CH4还原CO2是实现“双碳”经济的有效途径之一、恒压、750℃时,CH4和CO2反应经如下流程(主要产物已标出)可实现CO2高效转化。
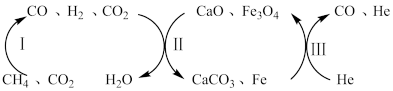
其中过程II主要发生如下反应:
i.CaO(s)+CO2(g)⇌CaCO3(s)
ii.2Fe3O4(s)+8H2(g)⇌6Fe(s)+8H2O(g)
iii.Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g)
过程II平衡后通入He,反应iii的化学平衡将_____ (填“正向移动”“逆向移动”或“不移动”),重新平衡时,n(CO2)_______ (填“增大”、“减小”或“不变”),p(CO)_____ (填“增大”、“减小”或“不变”)。
(1)H2捕集CO2合成CH4涉及下列反应:
I.4H2(g)+CO2(g)⇌CH4(g)+2H2O(g) △H1平衡常数K1
II.H2(g)+CO2(g)⇌CO(g)+H2O(g) △H2平衡常数K2
①相关物质相对能量大小如图所示,则△H1=
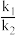

②起始物
 =3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)
=3时,反应在不同条件下达到平衡。240℃甲烷的物质的量分数x(CH4)与压强p的变化关系、5×105Pa时(CH4)与温度T的变化关系如图所示。图中对应A、B两点的速率:vA(正)
(2)CH4还原CO2是实现“双碳”经济的有效途径之一、恒压、750℃时,CH4和CO2反应经如下流程(主要产物已标出)可实现CO2高效转化。

其中过程II主要发生如下反应:
i.CaO(s)+CO2(g)⇌CaCO3(s)
ii.2Fe3O4(s)+8H2(g)⇌6Fe(s)+8H2O(g)
iii.Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g)
过程II平衡后通入He,反应iii的化学平衡将
您最近一年使用:0次
2023-03-19更新
|
958次组卷
|
3卷引用:山东省烟台市、德州市、滨州市2023届高三一模考试化学试题
山东省烟台市、德州市、滨州市2023届高三一模考试化学试题(已下线)山东省青岛市2023届高三下学期一模化学试题变式题(原理综合题)山东省日照实验高级中学2023-2024学年高二上学期第一次阶段考试化学试题
名校
解题方法
8 . 丙烯是重要的有机化工原料之一,丙烷直接脱氢制丙烯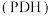 是一条绿色生产丙烯的途径。
是一条绿色生产丙烯的途径。
主反应: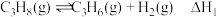
副反应: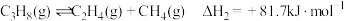
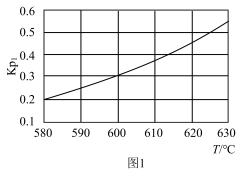
(1) 恒压下,主反应的
恒压下,主反应的 随温度变化如图1所示,
随温度变化如图1所示,
_______ 0(填”、“<”或=”),判断的理由是_______ 。
(2) 恒压下,
恒压下,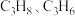 在不同温度下的平衡体积分数如图2所示,图中表示
在不同温度下的平衡体积分数如图2所示,图中表示 的体积分数的曲线为
的体积分数的曲线为_______ (填“a”或“b”), 时,
时, 的体积分数为
的体积分数为_______ 。

(3)下列关于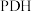 工艺说法正确的是
工艺说法正确的是
(4)丙烷氧化脱氢制丙烯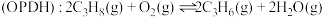
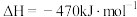 ,相比
,相比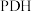 ,该途径生产丙烯的好处是
,该途径生产丙烯的好处是_______ 。
(5)用下图所示装置电解二氧化碳酸性溶液也可制得丙烯。
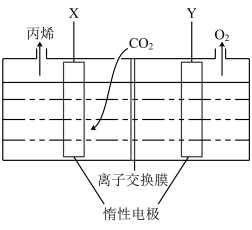
①Y极与电源_______ (填“正”或“负”)极相连。
②X极的电极反应式为_______ 。
③理论上,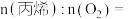
_______ 。
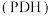 是一条绿色生产丙烯的途径。
是一条绿色生产丙烯的途径。主反应:
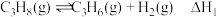
副反应:
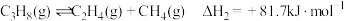
(1)
 恒压下,主反应的
恒压下,主反应的 随温度变化如图1所示,
随温度变化如图1所示,

(2)
 恒压下,
恒压下,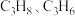 在不同温度下的平衡体积分数如图2所示,图中表示
在不同温度下的平衡体积分数如图2所示,图中表示 的体积分数的曲线为
的体积分数的曲线为 时,
时, 的体积分数为
的体积分数为
(3)下列关于
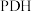 工艺说法正确的是
工艺说法正确的是A. 的物质的量分数不再改变,反应体系已达平衡 的物质的量分数不再改变,反应体系已达平衡 |
| B.采用合适的催化剂能提高主反应的平衡转化率,促使丙烯的产率提高 |
C.反应达到平衡后,增加压强,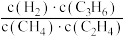 不变 不变 |
D.升高温度,生成 的速率加快,生成其他副产物的速率减慢 的速率加快,生成其他副产物的速率减慢 |
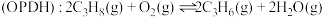
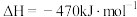 ,相比
,相比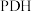 ,该途径生产丙烯的好处是
,该途径生产丙烯的好处是(5)用下图所示装置电解二氧化碳酸性溶液也可制得丙烯。

①Y极与电源
②X极的电极反应式为
③理论上,
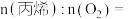
您最近一年使用:0次
2023-02-13更新
|
1184次组卷
|
3卷引用:广东省广州市天河区2023届高三二模化学试题
名校
解题方法
9 .  、
、 为重要化工原料,常用于合成重要化合物。
为重要化工原料,常用于合成重要化合物。
Ⅰ.以 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:
ⅰ
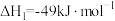
ⅱ
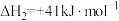
ⅲ

回答下列问题:
(1) 为分压平衡常数,各反应的
为分压平衡常数,各反应的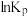 随
随 的变化如图所示。
的变化如图所示。
_______  ,其对应的曲线为
,其对应的曲线为_______ (填“a”或“c”)。
(2)在5MPa下,按照 投料,平衡时,CO和
投料,平衡时,CO和 在含碳产物中物质的量分数及
在含碳产物中物质的量分数及 的转化率随温度的变化如图:
的转化率随温度的变化如图: 的曲线为
的曲线为_______ (填“m”或“n”)。
②解释150~250℃范围内 转化率随温度升高而降低的原因
转化率随温度升高而降低的原因_______ 。
③下列说法错误的是_______ (填字母)。
A. 的平衡转化率始终低于
的平衡转化率始终低于 的
的
B.温度越低,越有利于工业生产
C.加入选择性高的催化剂,可提高 的平衡转化率
的平衡转化率
D.150-400℃范围内,温度升高, 的平衡产量先减小后增大
的平衡产量先减小后增大
④270℃时CO的分压为_______ ,反应ⅱ的平衡常数为_______ (列出算式)。
Ⅱ. 超干重整
超干重整 得到的CO经偶联反应可制得
得到的CO经偶联反应可制得 (草酸)。
(草酸)。
(3)在水溶液中 、
、 和
和 物质的量分数与pH关系如图所示,则c点溶液
物质的量分数与pH关系如图所示,则c点溶液
_______ 。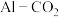 电池(工作原理如下图所示)能有效地将
电池(工作原理如下图所示)能有效地将 转化成化工原料草酸铝
转化成化工原料草酸铝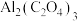
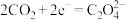 (草酸根)正极反应过程中,
(草酸根)正极反应过程中, 起催化作用,催化过程可表示为:①
起催化作用,催化过程可表示为:①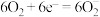 ②……
②……
(4)写出反应②的方程式_______ 。
 、
、 为重要化工原料,常用于合成重要化合物。
为重要化工原料,常用于合成重要化合物。Ⅰ.以
 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:ⅰ

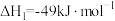
ⅱ

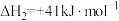
ⅲ


回答下列问题:
(1)
 为分压平衡常数,各反应的
为分压平衡常数,各反应的 随
随 的变化如图所示。
的变化如图所示。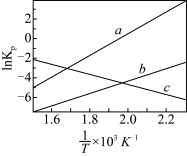

 ,其对应的曲线为
,其对应的曲线为(2)在5MPa下,按照
 投料,平衡时,CO和
投料,平衡时,CO和 在含碳产物中物质的量分数及
在含碳产物中物质的量分数及 的转化率随温度的变化如图:
的转化率随温度的变化如图: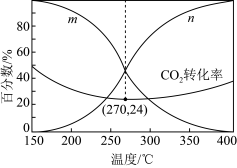
 的曲线为
的曲线为②解释150~250℃范围内
 转化率随温度升高而降低的原因
转化率随温度升高而降低的原因③下列说法错误的是
A.
 的平衡转化率始终低于
的平衡转化率始终低于 的
的B.温度越低,越有利于工业生产

C.加入选择性高的催化剂,可提高
 的平衡转化率
的平衡转化率D.150-400℃范围内,温度升高,
 的平衡产量先减小后增大
的平衡产量先减小后增大④270℃时CO的分压为
Ⅱ.
 超干重整
超干重整 得到的CO经偶联反应可制得
得到的CO经偶联反应可制得 (草酸)。
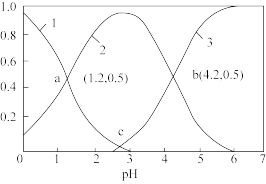
(草酸)。(3)在水溶液中
 、
、 和
和 物质的量分数与pH关系如图所示,则c点溶液
物质的量分数与pH关系如图所示,则c点溶液
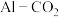 电池(工作原理如下图所示)能有效地将
电池(工作原理如下图所示)能有效地将 转化成化工原料草酸铝
转化成化工原料草酸铝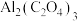
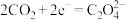 (草酸根)正极反应过程中,
(草酸根)正极反应过程中, 起催化作用,催化过程可表示为:①
起催化作用,催化过程可表示为:①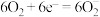 ②……
②……(4)写出反应②的方程式
您最近一年使用:0次
2022-12-04更新
|
886次组卷
|
5卷引用:浙江省东阳中学2023届高三浙江省普通高校招生选考科目考试仿真训练化学试题
名校
解题方法
10 . 利用丙烷(C3H8)在无氧条件下制备丙烯(C3H6)的反应方程式为:C3H8(g) C3H6(g)+H2(g) △H=+124kJ·mol-1。在一体积可变的容器中,不同起始压强下(0.1MPa、0.01MPa)进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法中正确的是
C3H6(g)+H2(g) △H=+124kJ·mol-1。在一体积可变的容器中,不同起始压强下(0.1MPa、0.01MPa)进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法中正确的是
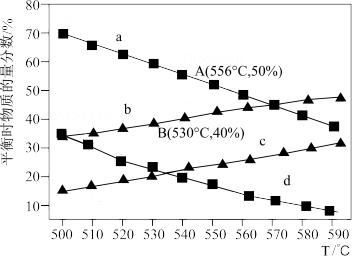
 C3H6(g)+H2(g) △H=+124kJ·mol-1。在一体积可变的容器中,不同起始压强下(0.1MPa、0.01MPa)进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法中正确的是
C3H6(g)+H2(g) △H=+124kJ·mol-1。在一体积可变的容器中,不同起始压强下(0.1MPa、0.01MPa)进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法中正确的是
| A.c曲线表示的是0.01MPa压强下丙烯随温度变化的物质的量分数 |
| B.A点对应的该反应平衡常数Kp=1.25MPa(Kp为以分压表示的平衡常数) |
| C.B点丙烷的平衡转化率为33.3% |
| D.实际生产过程中需通入一定量水蒸气,其目的是稀释原料气,增大丙烯的平衡产率 |
您最近一年使用:0次
2022-09-04更新
|
1510次组卷
|
5卷引用:重庆市南开中学2022-2023学年高三上学期第一次质检化学试题
重庆市南开中学2022-2023学年高三上学期第一次质检化学试题重庆市南开中学校2022-2023学年高三上学期第一次质量检测联考化学试题(已下线)2022年北京高考真题变式题1-14黑龙江省牡丹江市第一高级中学2022-2023学年高二10月月考化学试题(已下线)2022年北京高考真题化学试题变式题(选择题11-14)



