解题方法
1 . 二氧化碳加氢制备甲醇可以实现二氧化碳的转化利用,有利于二氧化碳的减排。
反应A:
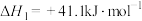 ;
;
反应B:
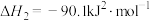 。
。
(1) 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为_______ 。
(2)500℃时,在2 L恒容密闭容器中充入
 和
和
 ,发生反应:
,发生反应:
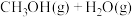 ,平衡时体系压强为
,平衡时体系压强为 ,测得
,测得 和
和 的浓度随时间的变化关系如图1所示。
的浓度随时间的变化关系如图1所示。
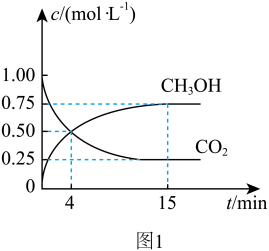
① 内平均反应速率
内平均反应速率
_______ 。
②平衡时 的转化率为
的转化率为_______ 。
③下列能说明该反应已达到平衡状态的是_______ (填标号)。
A.气体的密度不再变化
B.容器内气体的压强不再变化
C.
D. 、
、 、
、 和
和 的浓度之比为1:3:1:1
的浓度之比为1:3:1:1
④该温度下平衡常数
_______  (用含
(用含 的代数式表示,
的代数式表示, 为以分压表示的平衡常数,
为以分压表示的平衡常数,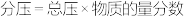 )。
)。
(3)一定物质的量之比的 和
和 在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图2所示。温度为470 K时,图2中P点
在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图2所示。温度为470 K时,图2中P点_______ (填“处于”或“不处于”)平衡状态。490 K之后,甲醇产率下降的原因是_______ 。
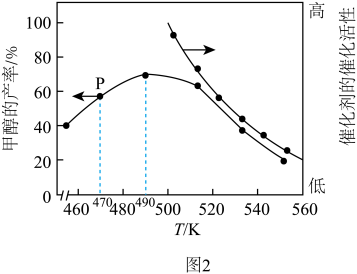
反应A:

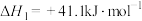 ;
;反应B:

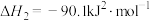 。
。(1)
 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为(2)500℃时,在2 L恒容密闭容器中充入

 和
和
 ,发生反应:
,发生反应:
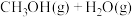 ,平衡时体系压强为
,平衡时体系压强为 ,测得
,测得 和
和 的浓度随时间的变化关系如图1所示。
的浓度随时间的变化关系如图1所示。
①
 内平均反应速率
内平均反应速率
②平衡时
 的转化率为
的转化率为③下列能说明该反应已达到平衡状态的是
A.气体的密度不再变化
B.容器内气体的压强不再变化
C.

D.
 、
、 、
、 和
和 的浓度之比为1:3:1:1
的浓度之比为1:3:1:1④该温度下平衡常数

 (用含
(用含 的代数式表示,
的代数式表示, 为以分压表示的平衡常数,
为以分压表示的平衡常数,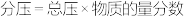 )。
)。(3)一定物质的量之比的
 和
和 在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图2所示。温度为470 K时,图2中P点
在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图2所示。温度为470 K时,图2中P点
您最近半年使用:0次
解题方法
2 . 完成下列填空
(1)将CoFe2O4负载在Al2O3上,产氧温度在1 200 ℃,产氢温度在1 000 ℃时,可顺利实现水的分解,氢气产量高且没有明显的烧结现象。循环机理如下,过程如图1所示,不考虑温度变化对反应ΔH的影响。
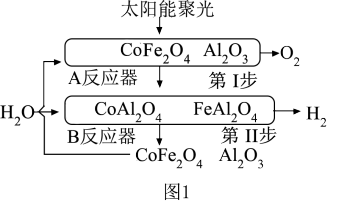
第Ⅰ步:CoFe2O4(s)+3Al2O3(s) CoAl2O4(s)+2FeAl2O4(s)+
CoAl2O4(s)+2FeAl2O4(s)+ O2(g) ΔH=a kJ·mol-1
O2(g) ΔH=a kJ·mol-1
第Ⅱ步:CoAl2O4(s)+2FeAl2O4(s)+H2O(g) CoFe2O4(s)+3Al2O3(s)+H2(g) ΔH=b kJ·mol-1
CoFe2O4(s)+3Al2O3(s)+H2(g) ΔH=b kJ·mol-1
第Ⅱ步反应的v正=k正·c(H2O),v逆=k逆·c(H2),k正、k逆分别为正、逆反应速率常数,仅与温度有关。1 000 ℃时,在体积为1 L的B反应器中加入2 mol H2O发生上述反应,测得H2O(g)和H2物质的量浓度随时间的变化如图2所示,则60 min内,v(CoFe2O4)=_______ g·min-1(保留2位小数)。a点时,v正∶v逆=_______ (填最简整数比)。

(2)在T2 K、1.0×104 kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g) CH3CHO(g)。反应速率v正-v逆=k正p(CO)·p(CH4)-k逆·p(CH3CHO),k正、k逆分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5,则CO转化率为20%时,
CH3CHO(g)。反应速率v正-v逆=k正p(CO)·p(CH4)-k逆·p(CH3CHO),k正、k逆分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5,则CO转化率为20%时, =
=_______ 。
(1)将CoFe2O4负载在Al2O3上,产氧温度在1 200 ℃,产氢温度在1 000 ℃时,可顺利实现水的分解,氢气产量高且没有明显的烧结现象。循环机理如下,过程如图1所示,不考虑温度变化对反应ΔH的影响。

第Ⅰ步:CoFe2O4(s)+3Al2O3(s)
 CoAl2O4(s)+2FeAl2O4(s)+
CoAl2O4(s)+2FeAl2O4(s)+ O2(g) ΔH=a kJ·mol-1
O2(g) ΔH=a kJ·mol-1第Ⅱ步:CoAl2O4(s)+2FeAl2O4(s)+H2O(g)
 CoFe2O4(s)+3Al2O3(s)+H2(g) ΔH=b kJ·mol-1
CoFe2O4(s)+3Al2O3(s)+H2(g) ΔH=b kJ·mol-1第Ⅱ步反应的v正=k正·c(H2O),v逆=k逆·c(H2),k正、k逆分别为正、逆反应速率常数,仅与温度有关。1 000 ℃时,在体积为1 L的B反应器中加入2 mol H2O发生上述反应,测得H2O(g)和H2物质的量浓度随时间的变化如图2所示,则60 min内,v(CoFe2O4)=

(2)在T2 K、1.0×104 kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)
 CH3CHO(g)。反应速率v正-v逆=k正p(CO)·p(CH4)-k逆·p(CH3CHO),k正、k逆分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5,则CO转化率为20%时,
CH3CHO(g)。反应速率v正-v逆=k正p(CO)·p(CH4)-k逆·p(CH3CHO),k正、k逆分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5,则CO转化率为20%时, =
=
您最近半年使用:0次
3 . 已知:N2O4(g)⇌2NO2(g) =+52.70 kJ/mol。
=+52.70 kJ/mol。
(1)在恒温、恒容的已达平衡的密闭容器中,再向容器内充入1 mol N2O4(g),并达新平衡,下列说法正确的______
a.N2O4(g)的转化率增大
b.平衡常数K减小
c.新平衡N2O4的百分含量比原平衡大
d.新平衡透明容器的气体颜色比原平衡还要深
(2)t℃恒温下,在固定容积为2 L的密闭容器中充入0.54 mol N2O4,2分钟时达到化学平衡,测得容器中含n(NO2)=0.6 mol,则在前2分钟的平均反应速率v(NO2)=_______ ,t℃时反应N2O4(g)⇌2NO2(g)的平衡常数K=________ 。
(3)现有两个体积均为2 L的恒容绝热(不与外界进行热交换)密闭容器甲和乙,若在甲容器中加入1 mol N2O4,在乙容器加入2 mol NO2,分别达平衡后,甲容器N2O4(g)⇌2NO2(g)的平衡常数_______ 乙容器N2O4(g)⇌2NO2(g)的平衡常数(填“大于”、“小于”或“等于”),甲容器中N2O4转化率与乙容器中NO2的转化率之和_________ 1(填“大于”、“小于”或“等于”)。
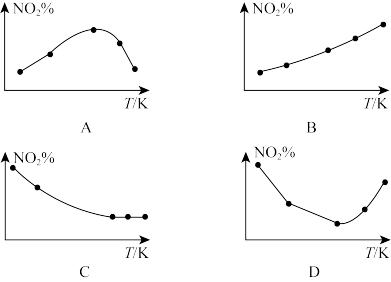
(4)取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应2NO2(g)⇌N2O4(g)。反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是__________
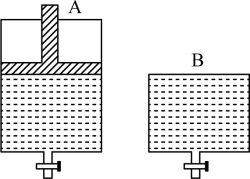
(5)一定温度下,若将3 mol N2O4气体置入开始体积为V但体积可变的等压密闭容器中(如图A),达平衡后容器体积增大至1.5V。若在另一个体积也为V但体积不变的密闭容器中(如图B)加入_______ mol NO2,达平衡后A、B两容器的NO2百分含量相等。
 =+52.70 kJ/mol。
=+52.70 kJ/mol。(1)在恒温、恒容的已达平衡的密闭容器中,再向容器内充入1 mol N2O4(g),并达新平衡,下列说法正确的
a.N2O4(g)的转化率增大
b.平衡常数K减小
c.新平衡N2O4的百分含量比原平衡大
d.新平衡透明容器的气体颜色比原平衡还要深
(2)t℃恒温下,在固定容积为2 L的密闭容器中充入0.54 mol N2O4,2分钟时达到化学平衡,测得容器中含n(NO2)=0.6 mol,则在前2分钟的平均反应速率v(NO2)=
(3)现有两个体积均为2 L的恒容绝热(不与外界进行热交换)密闭容器甲和乙,若在甲容器中加入1 mol N2O4,在乙容器加入2 mol NO2,分别达平衡后,甲容器N2O4(g)⇌2NO2(g)的平衡常数
(4)取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应2NO2(g)⇌N2O4(g)。反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是

(5)一定温度下,若将3 mol N2O4气体置入开始体积为V但体积可变的等压密闭容器中(如图A),达平衡后容器体积增大至1.5V。若在另一个体积也为V但体积不变的密闭容器中(如图B)加入

您最近半年使用:0次
4 . 根据如图填空:
(1)生成物是____ 。
(2)在2 min内用B表示的化学反应速率分别为_____ 。
(3)该反应的化学方程式是___ 。

(1)生成物是
(2)在2 min内用B表示的化学反应速率分别为
(3)该反应的化学方程式是
您最近半年使用:0次
名校
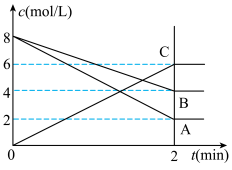
5 . 某温度时,在一个容积为2 L 的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:

(1)该反应的化学方程式为:______________________ 。
(2)反应开始至2 min,气体Z的平均反应速率v(Z)=____________ 。
(3)1min时,正逆反应速率的大小关系为:v正____________ v逆(填“>”、“<”或“=”);4min时,v正____________ v逆(同前);若X、Y、Z均为气体,反应达到平衡时:若此时将容器的体积缩小为原来的1/2倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为________ 反应(填“放热”或“吸热”)。
(4)上述反应在t1~t6内反应速率与时间图象如图,在每一时刻均改变一个影响反应速率的因素,则下列说法正确的是____________ 。

A.在t1时增大了压强
B.在t3时加入了催化剂
C.在t4时降低了温度
D.t2~t3时X的转化率最高

(1)该反应的化学方程式为:
(2)反应开始至2 min,气体Z的平均反应速率v(Z)=
(3)1min时,正逆反应速率的大小关系为:v正
(4)上述反应在t1~t6内反应速率与时间图象如图,在每一时刻均改变一个影响反应速率的因素,则下列说法正确的是

A.在t1时增大了压强
B.在t3时加入了催化剂
C.在t4时降低了温度
D.t2~t3时X的转化率最高
您最近半年使用:0次
2018-12-22更新
|
319次组卷
|
3卷引用:内蒙古自治区包头市第六中学2018-2019学年高二上学期期中考试化学试题



