名校
1 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含Ni2+、Co2+、Fe2+、Fe3+、Mg2+和Mn2+),实现镍、钴、镁元素的回收。
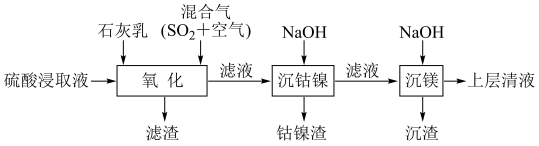
回答下列问题:
(1)在一定温度下,用硫酸浸取已粉碎的镍钴矿时,提高浸取速率的方法为___________ 。(答出一条即可)
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),写出H2SO5的结构式:___________ 。
(3)“氧化”中,用石灰乳调节pH=4,Mn2+被H2SO5氧化为MnO2,该反应的离子方程式为___________ 。(H2SO5的电离第一步完全,第二步微弱)
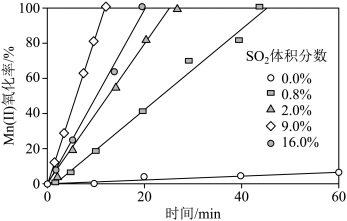
(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如图。SO2体积分数为9%时,Mn(Ⅱ)氧化速率最大;继续增大SO2体积分数时,Mn(Ⅱ)氧化速率减小的原因是___________ 。
(5)将“钴镍渣”酸溶后,进行如下流程:
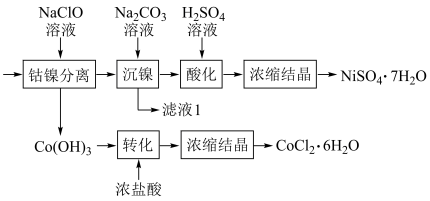
①写出“钴镍分离”时发生反应的离子方程式:___________ 。
②“镍钴分离”后溶液中c(Ni2+)=1.0mol·L-1,若“滤液1”中c(CO )=10-5mol·L-1,则沉镍率=
)=10-5mol·L-1,则沉镍率=___________ (要求写出计算过程)。[已知:Ksp(NiCO3)=1.0×10-7,沉镍率= ]
]

回答下列问题:
(1)在一定温度下,用硫酸浸取已粉碎的镍钴矿时,提高浸取速率的方法为
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),写出H2SO5的结构式:
(3)“氧化”中,用石灰乳调节pH=4,Mn2+被H2SO5氧化为MnO2,该反应的离子方程式为
(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如图。SO2体积分数为9%时,Mn(Ⅱ)氧化速率最大;继续增大SO2体积分数时,Mn(Ⅱ)氧化速率减小的原因是

(5)将“钴镍渣”酸溶后,进行如下流程:

①写出“钴镍分离”时发生反应的离子方程式:
②“镍钴分离”后溶液中c(Ni2+)=1.0mol·L-1,若“滤液1”中c(CO
 )=10-5mol·L-1,则沉镍率=
)=10-5mol·L-1,则沉镍率= ]
]
您最近一年使用:0次
2 . 下列设计的实验方案不能达到实验目的的是
| 选项 | 实验现象和操作 | 实验目的 |
| A | 向2mL0.1mol·L-1Na2S溶液中滴加0.1mol·L-1ZnSO4溶液至不再有沉淀产生,再滴加几滴0.1mol·L-1CuSO4溶液,出现黑色沉淀 | 验证Ksp(ZnS)>Ksp(CuS) |
| B | 向含有0.1mol的FeI2溶液中通入0.1molCl2,再加入淀粉溶液,溶液变蓝色 | 还原性:I->Fe2+ |
| C | 以Zn、Fe为电极,以酸化的3%NaCl溶液作电解质溶液,连接成原电池装置。过一段时间,从Fe电极区域取少量溶液于试管中,再向试管中滴入2滴K3[Fe(CN)6]溶液,观察现象 | 探究金属的牺牲阳极保护法 |
| D | 向盛有2mL0.1mol·L-1K2Cr2O7溶液的试管中滴加5~10滴NaOH溶液,再继续滴加5~10滴6mol·L-1H2SO4溶液,观察现象 | 探究浓度对化学平衡的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
3 . 下列化学反应过程中,相应的离子方程式正确的是
A.用饱和 溶液制备胶体: 溶液制备胶体: |
B.饱和氨盐水吸收 析出晶体: 析出晶体: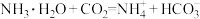 |
C.用碳酸钠溶液处理水垢中的硫酸钙: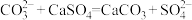 |
D.氯水中加入少量碳酸钠溶液增强漂白性: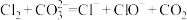 |
您最近一年使用:0次
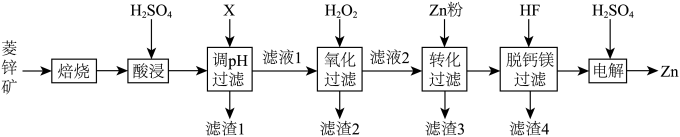
4 . 以菱锌矿(主要含有 ,另含有少量
,另含有少量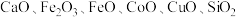 等)为原料电解制
等)为原料电解制 的流程如图:
的流程如图:
相关难溶物溶度积常数如下表:
(1)“酸浸”时为提高锌的浸出率,可采取的措施有_______ (写出一种即可)。
(2)“调 过滤”中,物质X最适宜选择
过滤”中,物质X最适宜选择_______ (填标号)。
A. B.
B. C.
C.
(3)“氧化过滤”中, 转化为
转化为 的离子方程式为
的离子方程式为_______ 。若反应结束时,溶液 为5,则残留的
为5,则残留的
_______  。
。
(4)“转化过滤”中,除去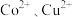 速率先慢后快的原因是
速率先慢后快的原因是_______ 。
(5)“脱钙镁过滤”后,溶液中
_______ 。
(6)“电解”装置示意如图。
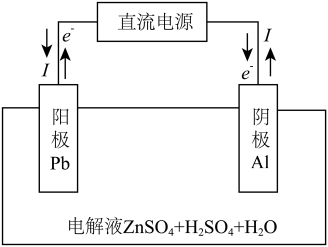
①开始通电时,阳极表面形成 ,保护阳极不被酸性电解液腐蚀,相应的电极反应式为
,保护阳极不被酸性电解液腐蚀,相应的电极反应式为_______ 。
②电解过程中,电解液中 含量应维持在
含量应维持在 ,
, 含量不宜过高的原因是
含量不宜过高的原因是_______ 。
 ,另含有少量
,另含有少量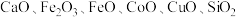 等)为原料电解制
等)为原料电解制 的流程如图:
的流程如图:
相关难溶物溶度积常数如下表:
| 物质 |  |  |  |  |
 | 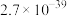 | 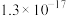 |  |  |
(1)“酸浸”时为提高锌的浸出率,可采取的措施有
(2)“调
 过滤”中,物质X最适宜选择
过滤”中,物质X最适宜选择A.
 B.
B. C.
C.
(3)“氧化过滤”中,
 转化为
转化为 的离子方程式为
的离子方程式为 为5,则残留的
为5,则残留的
 。
。(4)“转化过滤”中,除去
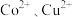 速率先慢后快的原因是
速率先慢后快的原因是(5)“脱钙镁过滤”后,溶液中

(6)“电解”装置示意如图。

①开始通电时,阳极表面形成
 ,保护阳极不被酸性电解液腐蚀,相应的电极反应式为
,保护阳极不被酸性电解液腐蚀,相应的电极反应式为②电解过程中,电解液中
 含量应维持在
含量应维持在 ,
, 含量不宜过高的原因是
含量不宜过高的原因是
您最近一年使用:0次
解题方法
5 . 下列实验装置或方案能达到实验目的的是
 |  |  |  |
| A.测定中和热 | B.电解饱和食盐水并检测产物 | C.铁制品镀铜 | D.比较 和 和 溶解度大小 溶解度大小 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 下列方程式书写正确的是
A.用硫酸铜溶液除去电石气中的 : : |
B.向硝酸银溶液中加滴加过量的氨水: |
C.向苯酚钠溶液中通入少量的 : :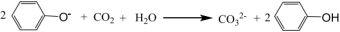 |
D.向含有少量氢氧化钙的溶液中加入过量的碳酸氢钠溶液: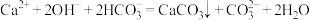 |
您最近一年使用:0次
7 . 下列说法正确的是
| A.除去苯中含有的少量苯酚,可向其中加入溴水,然后分液 |
| B.向丙烯醛中加入溴水,溴水褪色,证明丙烯醛中含有碳碳双键 |
C.将铁锈溶于浓盐酸,滴入 溶液,紫色褪去,证明铁锈中含有二价铁 溶液,紫色褪去,证明铁锈中含有二价铁 |
D.向盛有2mL0.1mol/LNaCl溶液的试管中,滴加2滴0.1mol/L 溶液,振荡,然后继续滴加4滴0.1mol/LKI溶液,观察到白色沉淀转化为黄色,说明 溶液,振荡,然后继续滴加4滴0.1mol/LKI溶液,观察到白色沉淀转化为黄色,说明 (AgCl)> (AgCl)> (AgI) (AgI) |
您最近一年使用:0次
8 . 下列图示实验方案能达到相应实验目的的是
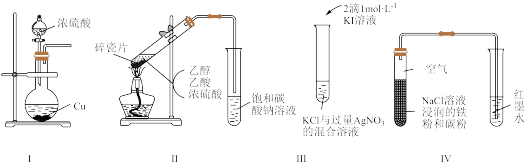

| A.用图I验证浓硫酸的强氧化性 |
| B.用图II制取乙酸乙酯 |
C.用图III证明AgI的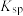 小于AgCl 小于AgCl |
| D.用图IV验证铁粉发生了析氢腐蚀 |
您最近一年使用:0次
9 . 水溶液中的离子平衡是以化学平衡理论为基础的进一步探究。
(1)常温下,等体积的0.10mol/L氨水与0.10mol/L烧碱溶液相比,c(OH-)的大小关系为前者_____ 后者(填“大于”“等于”或“小于”,下同);常温下,pH均为5的氯化铵溶液与盐酸相比,溶液中水的电离程度前者_____ 后者,两者均稀释10倍,pH的大小关系为前者_____ 后者。
(2)醋酸钠溶液呈碱性,其原因是_____ (用离子方程式表示)。
(3)常温下,Ksp(FeS)=6.3×10-18、Ksp(CuS)=1.3×10-36,则FeS的溶解度_____ CuS的溶解度(填“大于”“等于”或“小于”);在处理含有Cu2+的污水时,可向其中加入FeS固体作为沉淀剂,FeS逐渐溶解,Cu2+转化为CuS沉淀,用沉淀溶解平衡原理解释其原因为_____ 。
(1)常温下,等体积的0.10mol/L氨水与0.10mol/L烧碱溶液相比,c(OH-)的大小关系为前者
(2)醋酸钠溶液呈碱性,其原因是
(3)常温下,Ksp(FeS)=6.3×10-18、Ksp(CuS)=1.3×10-36,则FeS的溶解度
您最近一年使用:0次
2023-01-07更新
|
122次组卷
|
2卷引用:2021年河南省普通高中学生学业水平考试化学试题
解题方法
10 . 下列操作能达到目的的是
| 选项 | 操作 | 目的 |
| A | 向10 mL0.1 mol·L-1草酸溶液中先滴加1 mL0.1 mol·L-1KMnO4溶液,再滴加1 mL 0.2 mol·L-1KMnO4溶液 | 探究浓度对反应速率的影响 |
| B | 分别用pH计测定0.1 mol·L-1的HOCH2COOH溶液在25 °C、45 °C时的pH(浓度变化不考虑) | 探究温度对电离平衡的影响 |
| C | 将铁、铜片插入浓硝酸(常温)构成原电池,并连接电流计 | 验证原电池中较活泼金属为负极 |
| D | 向物质的量浓度均为1 mol·L-1的Na2CO3和Na2SO4混合液中加入等体积的过量AgNO3溶液 | 探究 Ag2CO3和Ag2SO4溶度积的大小 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-07-15更新
|
927次组卷
|
3卷引用:天津市2023届普通高中学业水平等级性考试模拟化学试题



