名校
解题方法
1 . 废钼催化剂中钼、钴、镍等有色金属作为二次资源可加以回收利用,一种从废钼催化剂(主要成分为 、
、 ,含少量CoO、CoS、NiO、
,含少量CoO、CoS、NiO、 等)中回收有色金属的一种工艺流程如图所示:
等)中回收有色金属的一种工艺流程如图所示: ;
;
②部分金属阳离子生成氢氧化物沉淀时溶液的pH如表所示:
回答下列问题:
(1)基态Mo原子的价电子排布式为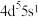 ,则Mo在元素周期表中的位置为
,则Mo在元素周期表中的位置为___________ 。
(2)“焙烧”时,采用“多层逆流焙烧”方法,即混合料与空气逆向而行,该方法的优点是___________ 。
(3)“焙烧”时 转化为
转化为 ,写出“碱浸”时
,写出“碱浸”时 参与反应的离子方程式:
参与反应的离子方程式:___________ 。
(4)“除铁”时,控制pH的范围为___________ 。
(5)“除铁”后所得滤液中 ,“沉镍”后所得滤液中
,“沉镍”后所得滤液中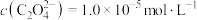 ,则沉镍率=
,则沉镍率=___________ [沉镍率=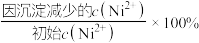 ,计算过程中不考虑溶液体积变化,保留三位有效数字]。
,计算过程中不考虑溶液体积变化,保留三位有效数字]。
(6)在空气中加热18.3g ,其残留固体质量与温度的关系如图所示。图中,a、c两点对应固体的成分分别是
,其残留固体质量与温度的关系如图所示。图中,a、c两点对应固体的成分分别是___________ 、___________ (填化学式,其中c为Co的氧化物)。 表示,则晶体的密度为
表示,则晶体的密度为___________  。
。
 、
、 ,含少量CoO、CoS、NiO、
,含少量CoO、CoS、NiO、 等)中回收有色金属的一种工艺流程如图所示:
等)中回收有色金属的一种工艺流程如图所示:
 ;
;②部分金属阳离子生成氢氧化物沉淀时溶液的pH如表所示:
| 金属阳离子 |  |  |  |
| 开始沉淀 | 7.0 | 2.3 | 7.1 |
| 沉淀完全 | 9.0 | 3.2 | 9.2 |
(1)基态Mo原子的价电子排布式为
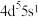 ,则Mo在元素周期表中的位置为
,则Mo在元素周期表中的位置为(2)“焙烧”时,采用“多层逆流焙烧”方法,即混合料与空气逆向而行,该方法的优点是
(3)“焙烧”时
 转化为
转化为 ,写出“碱浸”时
,写出“碱浸”时 参与反应的离子方程式:
参与反应的离子方程式:(4)“除铁”时,控制pH的范围为
(5)“除铁”后所得滤液中
 ,“沉镍”后所得滤液中
,“沉镍”后所得滤液中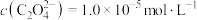 ,则沉镍率=
,则沉镍率=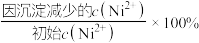 ,计算过程中不考虑溶液体积变化,保留三位有效数字]。
,计算过程中不考虑溶液体积变化,保留三位有效数字]。(6)在空气中加热18.3g
 ,其残留固体质量与温度的关系如图所示。图中,a、c两点对应固体的成分分别是
,其残留固体质量与温度的关系如图所示。图中,a、c两点对应固体的成分分别是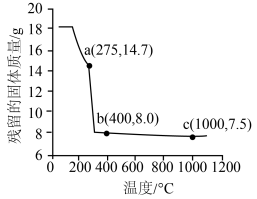
 表示,则晶体的密度为
表示,则晶体的密度为 。
。
您最近半年使用:0次
名校
2 . T℃下,将 固体加水配成1L悬浊液,然后向烧杯中加入
固体加水配成1L悬浊液,然后向烧杯中加入 固体并充分搅拌(忽略溶液体积的变化).加入
固体并充分搅拌(忽略溶液体积的变化).加入 固体的过程中溶液中
固体的过程中溶液中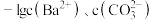 的变化曲线如图所示,下列说法正确的是
的变化曲线如图所示,下列说法正确的是
 固体加水配成1L悬浊液,然后向烧杯中加入
固体加水配成1L悬浊液,然后向烧杯中加入 固体并充分搅拌(忽略溶液体积的变化).加入
固体并充分搅拌(忽略溶液体积的变化).加入 固体的过程中溶液中
固体的过程中溶液中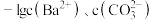 的变化曲线如图所示,下列说法正确的是
的变化曲线如图所示,下列说法正确的是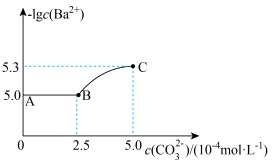
A.T℃时,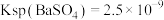 |
B. 恰好全部转化为 恰好全部转化为 时,离子浓度大小关系为 时,离子浓度大小关系为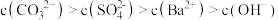 |
C.要使 全部转化为 全部转化为 ,至少需加入 ,至少需加入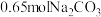 |
D.曲线BC段内,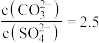 |
您最近半年使用:0次
3 . 室温下,已知 ,饱和
,饱和 溶液中
溶液中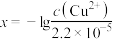 与pH的关系如图所示。向
与pH的关系如图所示。向 的Na2S溶液(pH=12.4)中加入一定量的CuSO4。下列说法正确的是
的Na2S溶液(pH=12.4)中加入一定量的CuSO4。下列说法正确的是
 ,饱和
,饱和 溶液中
溶液中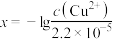 与pH的关系如图所示。向
与pH的关系如图所示。向 的Na2S溶液(pH=12.4)中加入一定量的CuSO4。下列说法正确的是
的Na2S溶液(pH=12.4)中加入一定量的CuSO4。下列说法正确的是
A.室温下 的 的 数量级为 数量级为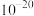 |
B.反应 的平衡常数为 的平衡常数为 |
C.室温下,CuS在等浓度的Na2S和H2S溶液中的 不相等 不相等 |
D.反应后的溶液中存在离子浓度关系: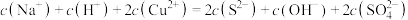 |
您最近半年使用:0次
4 . 下列实验操作、现象和解释或结论完全正确的是
| 选项 | 实验操作 | 解释或结论 |
| A | 将含有二氧化硫的气体通入酸性高锰酸钾中,然后加入足量氯化钡溶液。 | 通过测定白色沉淀的质量,可推算二氧化硫的物质的量 |
| B | 实验室用浓硫酸和乙醇制取乙烯,将产生的气体通入溴水中。 | 若溴水褪色,则证明混合气体中有乙烯 |
| C | 向盛有2 mL 0.1mol/L 溶液的试管中滴加2~4滴0.1mol/L NaOH溶液,产生白色沉淀,向上层清液中滴加4滴0.1mol/L 溶液的试管中滴加2~4滴0.1mol/L NaOH溶液,产生白色沉淀,向上层清液中滴加4滴0.1mol/L 溶液,生成红褐色沉淀。 溶液,生成红褐色沉淀。 | 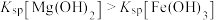 |
| D | 把 和 和 的混合气体通入两只连通的烧瓶,一只烧瓶浸泡在热水中,另一只浸泡在冰水中。浸泡在热水中的烧瓶内红棕色加深。 的混合气体通入两只连通的烧瓶,一只烧瓶浸泡在热水中,另一只浸泡在冰水中。浸泡在热水中的烧瓶内红棕色加深。 | 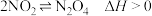 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
昨日更新
|
12次组卷
|
2卷引用:东北三省四市教研联合体2024届高三下学期高考模拟(二)化学试题
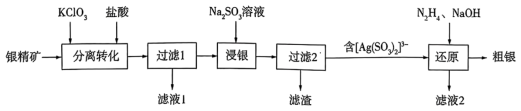
5 . 以银精矿(主要成分为Ag2S、FeS2、ZnS)为原料采用“预氧化湿法提银”工艺流程如下: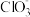 有较强的氧化性,被还原为Cl-。
有较强的氧化性,被还原为Cl-。
(1)“分离转化”时,为提高 的转化率可采取的措施是
的转化率可采取的措施是___________ ; 转化为AgCl和S的化学方程式为
转化为AgCl和S的化学方程式为___________ 。
(2)已知: ,
,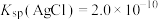 ,若不加KClO3,直接加氯化物,依据反应
,若不加KClO3,直接加氯化物,依据反应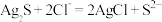 ,能否实现此反应较完全转化?并说明理由:
,能否实现此反应较完全转化?并说明理由:___________ 。
(3)滤液1中的金属阳离子有___________ 。在整个工艺中可循环利用的物质是___________ 。
(4)“浸银”时,发生反应的离子方程式为___________ 。
(5)“分离转化”时,除上述方法外也可以使用过量FeCl3、HCl和 的混合液作为浸出剂,将Ag2S中的银以
的混合液作为浸出剂,将Ag2S中的银以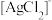 形式浸出,建立化学平衡状态。请解释浸出剂中
形式浸出,建立化学平衡状态。请解释浸出剂中 、H⁺的作用
、H⁺的作用___________ 。
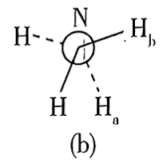
(6)还原过程中所用的N2H4,分子可能有两种不同的构象——顺式和反式,沿N—N键轴方向的投影如下图所示,其中(a)为反式,(b)为顺式。测得 分子极性很大,说明它具有
分子极性很大,说明它具有___________ 构象(填“反式”或“顺式”)。
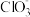 有较强的氧化性,被还原为Cl-。
有较强的氧化性,被还原为Cl-。(1)“分离转化”时,为提高
 的转化率可采取的措施是
的转化率可采取的措施是 转化为AgCl和S的化学方程式为
转化为AgCl和S的化学方程式为(2)已知:
 ,
,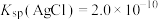 ,若不加KClO3,直接加氯化物,依据反应
,若不加KClO3,直接加氯化物,依据反应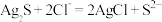 ,能否实现此反应较完全转化?并说明理由:
,能否实现此反应较完全转化?并说明理由:(3)滤液1中的金属阳离子有
(4)“浸银”时,发生反应的离子方程式为
(5)“分离转化”时,除上述方法外也可以使用过量FeCl3、HCl和
 的混合液作为浸出剂,将Ag2S中的银以
的混合液作为浸出剂,将Ag2S中的银以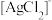 形式浸出,建立化学平衡状态。请解释浸出剂中
形式浸出,建立化学平衡状态。请解释浸出剂中 、H⁺的作用
、H⁺的作用(6)还原过程中所用的N2H4,分子可能有两种不同的构象——顺式和反式,沿N—N键轴方向的投影如下图所示,其中(a)为反式,(b)为顺式。测得
 分子极性很大,说明它具有
分子极性很大,说明它具有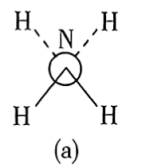
您最近半年使用:0次
昨日更新
|
10次组卷
|
2卷引用:东北三省四市教研联合体2024届高三下学期高考模拟(二)化学试题
6 .  是有机合成的重要催化剂,并可用于颜料、防腐等工业。工业上由废铜料(含
是有机合成的重要催化剂,并可用于颜料、防腐等工业。工业上由废铜料(含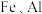 及其化合物、
及其化合物、 等杂质),生产
等杂质),生产 的工艺流程如下:
的工艺流程如下: )时的
)时的 如下表:
如下表:
② 溶液用水稀释后可生成
溶液用水稀释后可生成 沉淀。
沉淀。
(1)“酸浸”时提高浸取率的措施有___________ (写出两条)。
(2)滤渣I的主要成分是___________ (填化学式)。
(3)操作 为调节溶液的
为调节溶液的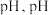 的最佳范围是
的最佳范围是___________ ,加入的物质X可以是___________ ( (填字母标号)。
A. B.
B.  C.
C.  D.
D.  溶液
溶液
(4)往滤液 中加入食盐并通入
中加入食盐并通入 可生成
可生成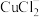 ,反应I的离子方程式为
,反应I的离子方程式为___________ ;在反应I中加入食盐并加热的目的是___________ 。
(5)实验室可以使用铜电极电解饱和食盐水得到 ,阳极的电极反应式为
,阳极的电极反应式为___________ 。
 是有机合成的重要催化剂,并可用于颜料、防腐等工业。工业上由废铜料(含
是有机合成的重要催化剂,并可用于颜料、防腐等工业。工业上由废铜料(含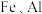 及其化合物、
及其化合物、 等杂质),生产
等杂质),生产 的工艺流程如下:
的工艺流程如下:
 )时的
)时的 如下表:
如下表:| 物质 |  |  |  |
开始沉淀时的 | 1.6 | 3.2 | 5.2 |
完全沉淀时的 | 3.1 | 4.7 | 6.7 |
 溶液用水稀释后可生成
溶液用水稀释后可生成 沉淀。
沉淀。(1)“酸浸”时提高浸取率的措施有
(2)滤渣I的主要成分是
(3)操作
 为调节溶液的
为调节溶液的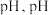 的最佳范围是
的最佳范围是A.
 B.
B.  C.
C.  D.
D.  溶液
溶液(4)往滤液
 中加入食盐并通入
中加入食盐并通入 可生成
可生成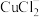 ,反应I的离子方程式为
,反应I的离子方程式为(5)实验室可以使用铜电极电解饱和食盐水得到
 ,阳极的电极反应式为
,阳极的电极反应式为
您最近半年使用:0次
解题方法
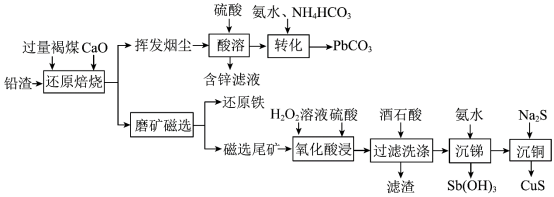
7 . 铅渣由多种氧化物及它们相互结合而形成的化合物、固溶体、共晶混合物所组成。对铅渣进行综合利用,回收其中的有价金属(Cu、Fe、Pb、Zn、Sb)的部分工艺流程如下: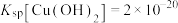 ,
, ,
, 。
。
②金属离子浓度等于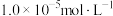 时,可认为其恰好沉淀完全。
时,可认为其恰好沉淀完全。
(1)Sb元素的原子序数为51,与氮元素同主族,其基态电子排布式为[Kr]___________ 。
(2)“还原焙烧”时, 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(3)挥发烟尘中的主要氧化物为 。“转化”过程中,发生反应的离子方程式为
。“转化”过程中,发生反应的离子方程式为___________ 。
(4)“氧化酸浸”过程中,若将物质的量为2mol的 合金(其中Cu与Sb物质的量之比为
合金(其中Cu与Sb物质的量之比为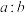 )氧化,至少需要
)氧化,至少需要 的物质的量为
的物质的量为___________ mol(用含a、b的式子表示)。
(5)“过滤洗涤”过程中,加入酒石酸(分子式为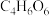 ,结构简式
,结构简式 )发生如下反应:
)发生如下反应: ;
;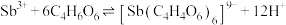 。
。
①上述两个配合物中,提供孤对电子的元素为___________ (填元素符号)。
②“过滤洗涤”时,用酒石酸稀溶液洗涤滤渣而不用水。用酒石酸稀溶液洗涤可减少金属离子的损失,原因为___________ 。
(6)“沉锑”过程中,锑恰好沉淀完全时,溶液中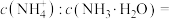
___________ 。
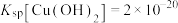 ,
, ,
, 。
。②金属离子浓度等于
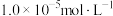 时,可认为其恰好沉淀完全。
时,可认为其恰好沉淀完全。(1)Sb元素的原子序数为51,与氮元素同主族,其基态电子排布式为[Kr]
(2)“还原焙烧”时,
 发生反应的化学方程式为
发生反应的化学方程式为(3)挥发烟尘中的主要氧化物为
 。“转化”过程中,发生反应的离子方程式为
。“转化”过程中,发生反应的离子方程式为(4)“氧化酸浸”过程中,若将物质的量为2mol的
 合金(其中Cu与Sb物质的量之比为
合金(其中Cu与Sb物质的量之比为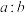 )氧化,至少需要
)氧化,至少需要 的物质的量为
的物质的量为(5)“过滤洗涤”过程中,加入酒石酸(分子式为
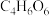 ,结构简式
,结构简式 )发生如下反应:
)发生如下反应: ;
;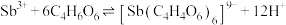 。
。①上述两个配合物中,提供孤对电子的元素为
②“过滤洗涤”时,用酒石酸稀溶液洗涤滤渣而不用水。用酒石酸稀溶液洗涤可减少金属离子的损失,原因为
(6)“沉锑”过程中,锑恰好沉淀完全时,溶液中
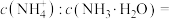
您最近半年使用:0次
8 . 回收利用废旧锂离子电池正极材料钴酸锂粗品来制备 产品,可实现资源的循环利用。其工艺流程如下。
产品,可实现资源的循环利用。其工艺流程如下。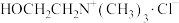 ]是铵盐,熔点较低,
]是铵盐,熔点较低, 熔点较高;
熔点较高;
② 在溶液中常以
在溶液中常以 (蓝色)和
(蓝色)和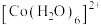 (粉红色)形式存在;
(粉红色)形式存在;
③常温下,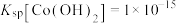 ;
;
下列说法错误的是
 产品,可实现资源的循环利用。其工艺流程如下。
产品,可实现资源的循环利用。其工艺流程如下。
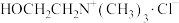 ]是铵盐,熔点较低,
]是铵盐,熔点较低, 熔点较高;
熔点较高;②
 在溶液中常以
在溶液中常以 (蓝色)和
(蓝色)和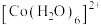 (粉红色)形式存在;
(粉红色)形式存在;③常温下,
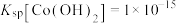 ;
;下列说法错误的是
| A.将废旧电池拆解并将其浸入NaCl溶液中,其目的是进行放电处理,使得锂离子从负极脱出,经过电解质溶液进入正极材料 |
B.“微波共熔”中氯化胆碱的作用是作为反应物提供 做助熔剂,降低熔融 做助熔剂,降低熔融 所需的温度 所需的温度 |
C.“沉钴”过程发生反应的离子方程式为 |
D.“水浸”过程中溶液由蓝色逐渐变为粉红色,则“微波共熔”后获得的含Li、Co的化合物为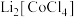 |
您最近半年使用:0次
名校
解题方法
9 . 下列离子方程式书写错误的是
A.向硫化钠溶液中通入足量二氧化硫: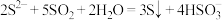 |
B.已知酸性: ,将少量 ,将少量 通入 通入 溶液中: 溶液中: |
C.用盐酸处理铜器表面的铜锈: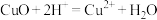 |
D.利用 与 与 制备 制备 沉淀: 沉淀: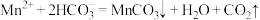 |
您最近半年使用:0次
解题方法
10 . 碳酸锌在工业上用途广泛。利用某种浸锌渣(主要含有 )制备
)制备 的一种流程如下:
的一种流程如下: ;
;
②室温下,部分离子浓度的对数 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体 中主要成分是
中主要成分是______ (填化学式)。
(2)“碱浸”后,浸出液中含有金属元素的离子主要是 和
和______ (填离子符号);欲使浸出液中的含锌微粒完全沉淀,应调节 的范围是
的范围是______ 。
(3)浸渣回收银的过程中有配合物 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为______ 。
(4)“除杂”时滤渣的主要成分是______ (填化学式)。
(5)“沉锌”时发生反应的离子方程式为______ ;此过程不宜用碳酸钠代替碳酸氢铵,原因是______ 。
 )制备
)制备 的一种流程如下:
的一种流程如下: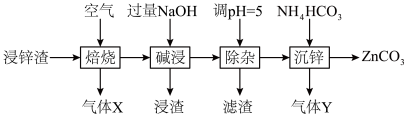
 ;
;②室温下,部分离子浓度的对数
 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):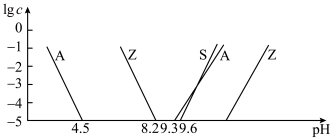
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体
 中主要成分是
中主要成分是(2)“碱浸”后,浸出液中含有金属元素的离子主要是
 和
和 的范围是
的范围是(3)浸渣回收银的过程中有配合物
 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为(4)“除杂”时滤渣的主要成分是
(5)“沉锌”时发生反应的离子方程式为
您最近半年使用:0次



