1 . 常温下,向含 、
、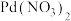 和
和 的溶液中滴加KSCN溶液,浊液中
的溶液中滴加KSCN溶液,浊液中 [
[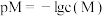 ,
,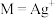 、
、 或
或 ]与
]与 的关系如图所示。已知:常温下,
的关系如图所示。已知:常温下,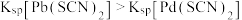 ,平衡常数K大于
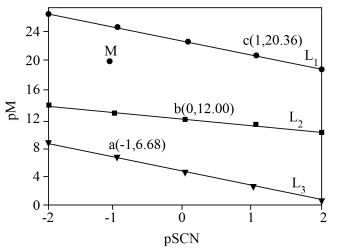
,平衡常数K大于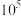 时认为该反应能完全进行。
时认为该反应能完全进行。
下列叙述错误的是
 、
、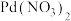 和
和 的溶液中滴加KSCN溶液,浊液中
的溶液中滴加KSCN溶液,浊液中 [
[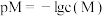 ,
,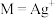 、
、 或
或 ]与
]与 的关系如图所示。已知:常温下,
的关系如图所示。已知:常温下,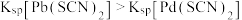 ,平衡常数K大于
,平衡常数K大于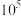 时认为该反应能完全进行。
时认为该反应能完全进行。
下列叙述错误的是
A.直线 代表pPd与pSCN的关系 代表pPd与pSCN的关系 |
B.饱和AgSCN溶液中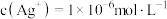 |
C.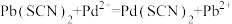 不可逆 不可逆 |
D.M点溶液可析出AgSCN和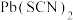 |
您最近一年使用:0次
2024-03-10更新
|
247次组卷
|
2卷引用:湖南省株洲市第一中学2021届高三第一次模拟检测化学试题
2 . 工业上常用 作沉淀剂除去废水中的
作沉淀剂除去废水中的 和
和 。通过调节溶液的
。通过调节溶液的 可使
可使 和
和 逐一沉降,处理过程中始终保持
逐一沉降,处理过程中始终保持 溶液为饱和状态即
溶液为饱和状态即 ,体系中
,体系中 、
、 、
、 、
、 浓度(mol/L)的负对数
浓度(mol/L)的负对数 与
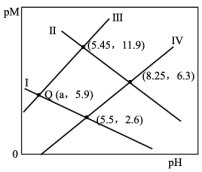
与 的关系如图所示。已知:
的关系如图所示。已知: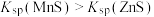 。下列说法错误的是
。下列说法错误的是
 作沉淀剂除去废水中的
作沉淀剂除去废水中的 和
和 。通过调节溶液的
。通过调节溶液的 可使
可使 和
和 逐一沉降,处理过程中始终保持
逐一沉降,处理过程中始终保持 溶液为饱和状态即
溶液为饱和状态即 ,体系中
,体系中 、
、 、
、 、
、 浓度(mol/L)的负对数
浓度(mol/L)的负对数 与
与 的关系如图所示。已知:
的关系如图所示。已知: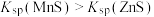 。下列说法错误的是
。下列说法错误的是
A.Ⅱ表示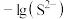 与 与 的关系曲线 的关系曲线 |
B. 点对应 点对应 的数量级为 的数量级为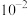 |
C.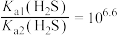 |
D.溶液中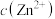 和 和 均为 均为 , , 完全沉淀时溶液的最小 完全沉淀时溶液的最小 为2(金属离子的浓度≤10-5mol/L可认为沉淀完全) 为2(金属离子的浓度≤10-5mol/L可认为沉淀完全) |
您最近一年使用:0次
2024-02-06更新
|
267次组卷
|
2卷引用:湖南省长沙市宁乡市第一高级中学2021届高三新高考第一次模拟考试化学试卷
名校
解题方法
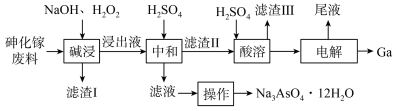
3 . 从砷化镓废料(主要成分为GaAs、 、
、 和
和 )中回收镓和砷的工艺流程如下图所示。下列说法
)中回收镓和砷的工艺流程如下图所示。下列说法不 正确的是
 、
、 和
和 )中回收镓和砷的工艺流程如下图所示。下列说法
)中回收镓和砷的工艺流程如下图所示。下列说法
| A.“碱浸”前,废料先浆化为悬浊液的目的是提高Ga、As元素浸出率 |
B.“碱浸”后,溶液中主要离子有 、 、 、 、 、 、 |
C.滤渣Ⅱ的成分为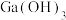 和 和 |
D.电解后的尾液中溶质主要成分为 ,可以循环利用 ,可以循环利用 |
您最近一年使用:0次
2023-11-20更新
|
642次组卷
|
4卷引用:湖南省株洲市第一中学2021届高三下学期第二次模拟检测化学试题
湖南省株洲市第一中学2021届高三下学期第二次模拟检测化学试题江苏省南通市海安市2023-2024学年高三上学期11月期中化学试题(已下线)江苏省南通市海安高级中学2023-2024学年高三上学期期中考试化学试题江苏省南京市金陵中学2023-2024学年高三上学期期中学业质量监测 化学试卷
4 . 第五届硒博会主题为“健康中国·硒引天下”。硒(Se)是第四周期第VI A族元素,是人体内不可或缺的微量元素,H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的重要原料。
(1)已知:①2H2Se(g)+O2(g) 2Se(s)+2H2O(l) △H =a kJ·mol-1
2Se(s)+2H2O(l) △H =a kJ·mol-1
②2H2(g)+O2(g) 2H2O(l) △H=b kJ·mol-1
2H2O(l) △H=b kJ·mol-1
反应H2(g)+Se(s) H2Se(g)的反应热△H=
H2Se(g)的反应热△H=___________ kJ·mol-1(用含a、b的代数式表示)。
(2)T℃时,向一恒容密闭容器中加入3molH2和1 mol Se,发生反应H2(g)+Se(s) H2Se(g),
H2Se(g),
①下列情况可判断反应达到平衡状态的是___________ (填字母代号)。
a.气体的密度不变 b.v(H2)=v(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
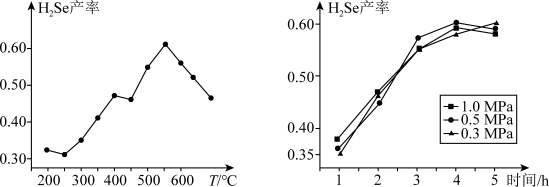
②以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图所示:___________ 。
(3)已知常温下H2Se的电离平衡常数K1=1.3×10-4、K2=5.0×10-11,则NaHSe溶液呈___________ (填“酸性”或“碱性”),该溶液中的物料守恒关系式为___________ 。
(4)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为___________ ,最后通入SO2析出硒单质。
(5)H2 Se在一定条件下可以制备出CuSe,已知常温时CuSe的Ksp=7.9×10-49,CuS的Ksp=1.3×10-36,则反应CuS(s)+Se2-(aq) CuSe(s)+S2-(aq)的化学平衡常数K=
CuSe(s)+S2-(aq)的化学平衡常数K=___________ (保留2位有效数字)。
(1)已知:①2H2Se(g)+O2(g)
 2Se(s)+2H2O(l) △H =a kJ·mol-1
2Se(s)+2H2O(l) △H =a kJ·mol-1②2H2(g)+O2(g)
 2H2O(l) △H=b kJ·mol-1
2H2O(l) △H=b kJ·mol-1反应H2(g)+Se(s)
 H2Se(g)的反应热△H=
H2Se(g)的反应热△H=(2)T℃时,向一恒容密闭容器中加入3molH2和1 mol Se,发生反应H2(g)+Se(s)
 H2Se(g),
H2Se(g),①下列情况可判断反应达到平衡状态的是
a.气体的密度不变 b.v(H2)=v(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
②以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图所示:
(3)已知常温下H2Se的电离平衡常数K1=1.3×10-4、K2=5.0×10-11,则NaHSe溶液呈
(4)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为
(5)H2 Se在一定条件下可以制备出CuSe,已知常温时CuSe的Ksp=7.9×10-49,CuS的Ksp=1.3×10-36,则反应CuS(s)+Se2-(aq)
 CuSe(s)+S2-(aq)的化学平衡常数K=
CuSe(s)+S2-(aq)的化学平衡常数K=
您最近一年使用:0次
解题方法
5 . 下列离子方程式书写正确的是
| A.Na与水反应:Na+2H2O=Na++2OH-+H2↑ |
B.过量NaOH溶液与NH4HCO3溶液反应:HC +OH-=H2O+C +OH-=H2O+C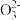 |
| C.FeO溶于稀硝酸:FeO+2H+=Fe2++H2O |
| D.向AgNO3溶液中滴加过量氨水:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O |
您最近一年使用:0次
名校
解题方法
6 . 高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含 等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下: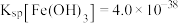 。
。
回答下列问题:
(1)浸出时,为了提高浸出效率可采取的措施有(写两种):___________ 。
(2)氧化时,加入 溶液是为了将浸出液中的
溶液是为了将浸出液中的 和
和 均转化为沉淀而除去,(溶液中
均转化为沉淀而除去,(溶液中 元素全部转化为
元素全部转化为 ),请分别写出
),请分别写出 除去
除去 和
和 的离子方程式
的离子方程式___________ ,___________ 。
(3)加入锌粉的目的是___________ 。
(4)已知 浸出液中,
浸出液中, 、
、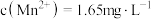 。
。
①若要除尽 上述浸出液中的
上述浸出液中的 和
和 ,需加入
,需加入___________ 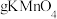 。
。
②加入 溶液反应一段时间后,溶液中
溶液反应一段时间后,溶液中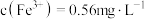 ,若溶液
,若溶液 ,则此时
,则此时
___________ (填“能”或“不能”)生成沉淀。
 等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下: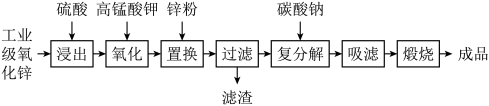
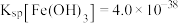 。
。回答下列问题:
(1)浸出时,为了提高浸出效率可采取的措施有(写两种):
(2)氧化时,加入
 溶液是为了将浸出液中的
溶液是为了将浸出液中的 和
和 均转化为沉淀而除去,(溶液中
均转化为沉淀而除去,(溶液中 元素全部转化为
元素全部转化为 ),请分别写出
),请分别写出 除去
除去 和
和 的离子方程式
的离子方程式(3)加入锌粉的目的是
(4)已知
 浸出液中,
浸出液中, 、
、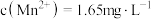 。
。①若要除尽
 上述浸出液中的
上述浸出液中的 和
和 ,需加入
,需加入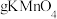 。
。②加入
 溶液反应一段时间后,溶液中
溶液反应一段时间后,溶液中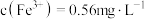 ,若溶液
,若溶液 ,则此时
,则此时
您最近一年使用:0次
2024-02-20更新
|
215次组卷
|
3卷引用:黑龙江省哈尔滨市第三中学校2020-2021学年高三上学期期末考试理科综合试卷-高中化学
黑龙江省哈尔滨市第三中学校2020-2021学年高三上学期期末考试理科综合试卷-高中化学(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)江西省南昌十九中2023-2024学年高三下学期第一次模拟考试化学试卷
7 . 含有 的废水毒性较大,某工厂废水中含5.0×10-3mol
的废水毒性较大,某工厂废水中含5.0×10-3mol L-1的
L-1的 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
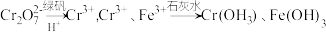
(1)若处理后的废水中残留的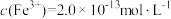 ,则残留的Cr3+的浓度为
,则残留的Cr3+的浓度为_________________ 。
(已知: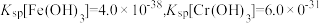 )。
)。
(2)已知室温时, 。在0.1mol/L的MgCl2溶液中,逐滴加入NaOH溶液,当Mg2+完全沉淀时,溶液的pH是
。在0.1mol/L的MgCl2溶液中,逐滴加入NaOH溶液,当Mg2+完全沉淀时,溶液的pH是_______________ (已知lg2=0.3)
 的废水毒性较大,某工厂废水中含5.0×10-3mol
的废水毒性较大,某工厂废水中含5.0×10-3mol L-1的
L-1的 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
(1)若处理后的废水中残留的
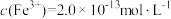 ,则残留的Cr3+的浓度为
,则残留的Cr3+的浓度为(已知:
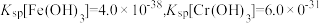 )。
)。(2)已知室温时,
 。在0.1mol/L的MgCl2溶液中,逐滴加入NaOH溶液,当Mg2+完全沉淀时,溶液的pH是
。在0.1mol/L的MgCl2溶液中,逐滴加入NaOH溶液,当Mg2+完全沉淀时,溶液的pH是
您最近一年使用:0次
名校
解题方法
8 . 软锰矿浆(主要成分MnO2)可吸收烟气中的SO2,同时可制备MnCO3,工艺流程如下:

资料:①吸收SO2后的软锰矿浆中含有Fe2+、Fe3+、Al3+、Zn2+等阳离子;
②金属离子沉淀的pH如下表
(1)脱硫的产物是MnSO4,软锰矿中MnO2所起的作用是___________ 。
(2)过程1向浆液中通入O2的目的是___________ 。
(3)滤渣1的成分是___________ ,过程2中发生反应的离子方程式为___________ 。
(4)制备MnCO3的过程中,一般控制溶液的pH范围为5-7,不宜过大或过小。原因是___________ 。
(5)已知:常温下,(NH4)2CO3溶液的pH约为9.3,NH4HCO3溶液的pH约为7.8.则物质A为___________ ,并写出制备MnCO3时发生反应的离子方程式___________ 。
(6)取mg碳酸锰样品,加适量硫酸加热溶解后,用cmol·L-1的KMnO4溶液滴定,至滴定终点时,消耗KMnO4溶液的体积为VmL。(已知:反应产物为MnO2,杂质不参与反应),则样品中MnCO3质量分数的计算式为___________ (用质量分数表示,无需化简)。

资料:①吸收SO2后的软锰矿浆中含有Fe2+、Fe3+、Al3+、Zn2+等阳离子;
②金属离子沉淀的pH如下表
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Zn2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 6.2 |
| 沉淀完全的pH | 10. 1 | 8.3 | 2.8 | 4.7 | 8.2 |
(1)脱硫的产物是MnSO4,软锰矿中MnO2所起的作用是
(2)过程1向浆液中通入O2的目的是
(3)滤渣1的成分是
(4)制备MnCO3的过程中,一般控制溶液的pH范围为5-7,不宜过大或过小。原因是
(5)已知:常温下,(NH4)2CO3溶液的pH约为9.3,NH4HCO3溶液的pH约为7.8.则物质A为
(6)取mg碳酸锰样品,加适量硫酸加热溶解后,用cmol·L-1的KMnO4溶液滴定,至滴定终点时,消耗KMnO4溶液的体积为VmL。(已知:反应产物为MnO2,杂质不参与反应),则样品中MnCO3质量分数的计算式为
您最近一年使用:0次
名校
解题方法
9 . 某萃铜余液主要含有 
 等离子,从萃铜余液中回收金属和制备
等离子,从萃铜余液中回收金属和制备  的工艺流程如图所示。
的工艺流程如图所示。

回答下列问题:
(1)过二硫酸钠(Na2S2O8)中S的化合价为+6,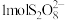 中过氧键的数目为
中过氧键的数目为___________ 。向pH=1的萃铜余液中加入Na2S2O8,进行“氧化除锰”,其反应的离子方程式为___________ 。“氧化除锰”过程中,Na2S2O8___________ (填“能”或“不能”)用绿色氧化剂H2O2来代替。
(2)向“氧化除锰”后的余液中加入试剂X调节pH=5.4使铁元素完全沉淀,试剂X的化学式为___________ 。
(3)“沉锌”时, 应保持溶液pH在6.8~7.0之间, pH 不能过低的原因是___________ 。
(4)“过滤”时,经常采用抽滤的方式加快过滤的速度。实验室用如图所示的装置,经过一系列操作完成抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(“洗涤”操作只需考虑一次):开抽气泵→a→b→d→___________ →d→c→关抽气泵。

a. 转移固液混合物 b. 关活塞 A c. 开活塞 A d. 确认抽干 e. 加洗涤剂洗涤
(5)高温煅烧碱式碳酸锌[ ]得到ZnO,取碱式碳酸锌3.41g,在高温下煅烧至恒重,得到固体2.43g和标准状况下CO2 0.224L, 则该碱式碳酸锌的化学式为
]得到ZnO,取碱式碳酸锌3.41g,在高温下煅烧至恒重,得到固体2.43g和标准状况下CO2 0.224L, 则该碱式碳酸锌的化学式为___________ 。

 等离子,从萃铜余液中回收金属和制备
等离子,从萃铜余液中回收金属和制备  的工艺流程如图所示。
的工艺流程如图所示。
回答下列问题:
(1)过二硫酸钠(Na2S2O8)中S的化合价为+6,
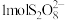 中过氧键的数目为
中过氧键的数目为(2)向“氧化除锰”后的余液中加入试剂X调节pH=5.4使铁元素完全沉淀,试剂X的化学式为
(3)“沉锌”时, 应保持溶液pH在6.8~7.0之间, pH 不能过低的原因是
(4)“过滤”时,经常采用抽滤的方式加快过滤的速度。实验室用如图所示的装置,经过一系列操作完成抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(“洗涤”操作只需考虑一次):开抽气泵→a→b→d→

a. 转移固液混合物 b. 关活塞 A c. 开活塞 A d. 确认抽干 e. 加洗涤剂洗涤
(5)高温煅烧碱式碳酸锌[
 ]得到ZnO,取碱式碳酸锌3.41g,在高温下煅烧至恒重,得到固体2.43g和标准状况下CO2 0.224L, 则该碱式碳酸锌的化学式为
]得到ZnO,取碱式碳酸锌3.41g,在高温下煅烧至恒重,得到固体2.43g和标准状况下CO2 0.224L, 则该碱式碳酸锌的化学式为
您最近一年使用:0次
10 . 25℃时,向2.5L蒸馏水中加入0.05molBaSO4固体粉末,再逐渐加入一定量的Na2CO3固体粉末,边加边搅拌(忽略溶液体积变化)。溶液中部分离子的浓度变化如图所示。下列说法正确的是
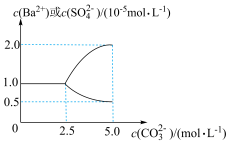

| A.25℃时,Ksp(BaCO3)<Ksp(BaSO4) |
| B.BaSO4在水中的Ksp大于其在BaCl2溶液中的Ksp |
| C.加入1.3molNa2CO3,即可使BaSO4全部转化为BaCO3 |
D.当BaSO4恰好全部转化为BaCO3时,c( )>c(Ba2+)>c( )>c(Ba2+)>c( )>c(OH-) )>c(OH-) |
您最近一年使用:0次
2023-12-16更新
|
342次组卷
|
4卷引用:山东省淄博市2021届高三三模考试化学试题



