1 . 以软锰矿浆(含 及少量
及少量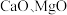 等)吸收烟气中
等)吸收烟气中 并制备高纯
并制备高纯 。
。
(1)吸收 。
。
①将烟气与软锰矿浆在吸收塔中逆流接触,烟气中的 被充分吸收,矿浆中的
被充分吸收,矿浆中的 转化为
转化为 。写出
。写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:_______ 。
②脱硫过程中软锰矿浆的 和
和 吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆
吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆 下降,但15小时前
下降,但15小时前 下降缓慢,其主要原因是
下降缓慢,其主要原因是_______ 。 吸收率急剧下降。此时加入菱锰矿
吸收率急剧下降。此时加入菱锰矿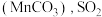 吸收率又可恢复至
吸收率又可恢复至 以上,其原因是
以上,其原因是_______ 。
(2)净化 。
。
①过滤脱硫后的软锰矿浆液,用 沉淀除去所得滤液中的
沉淀除去所得滤液中的 、Mg2+(浓度小于
、Mg2+(浓度小于 )。此时应控制溶液中
)。此时应控制溶液中 略大于
略大于_______  。(已知:
。(已知: 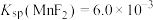 、
、 ,
, 、)
、)
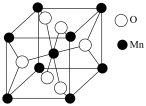
②净化时生成的 沉淀晶胞结构如图所示。在
沉淀晶胞结构如图所示。在 晶胞中
晶胞中 周围距离最近的
周围距离最近的 形成的空隙构型为
形成的空隙构型为_______ 。 。
。
①向反应器中加入 溶液,控制80℃恒温,搅拌下鼓入空气可制得
溶液,控制80℃恒温,搅拌下鼓入空气可制得 。写出生成
。写出生成 的离子方程式:
的离子方程式:_______ 。
②实际生产中,常将 溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入
溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入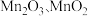 等,其原因是
等,其原因是_______ 。
 及少量
及少量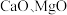 等)吸收烟气中
等)吸收烟气中 并制备高纯
并制备高纯 。
。(1)吸收
 。
。①将烟气与软锰矿浆在吸收塔中逆流接触,烟气中的
 被充分吸收,矿浆中的
被充分吸收,矿浆中的 转化为
转化为 。写出
。写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:②脱硫过程中软锰矿浆的
 和
和 吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆
吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆 下降,但15小时前
下降,但15小时前 下降缓慢,其主要原因是
下降缓慢,其主要原因是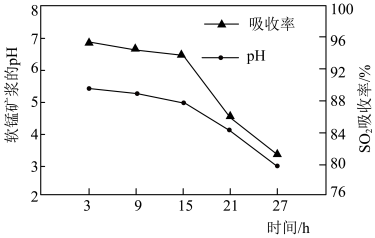
 吸收率急剧下降。此时加入菱锰矿
吸收率急剧下降。此时加入菱锰矿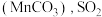 吸收率又可恢复至
吸收率又可恢复至 以上,其原因是
以上,其原因是(2)净化
 。
。①过滤脱硫后的软锰矿浆液,用
 沉淀除去所得滤液中的
沉淀除去所得滤液中的 、Mg2+(浓度小于
、Mg2+(浓度小于 )。此时应控制溶液中
)。此时应控制溶液中 略大于
略大于 。(已知:
。(已知: 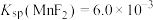 、
、 ,
, 、)
、)②净化时生成的
 沉淀晶胞结构如图所示。在
沉淀晶胞结构如图所示。在 晶胞中
晶胞中 周围距离最近的
周围距离最近的 形成的空隙构型为
形成的空隙构型为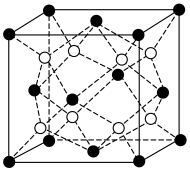
 。
。①向反应器中加入
 溶液,控制80℃恒温,搅拌下鼓入空气可制得
溶液,控制80℃恒温,搅拌下鼓入空气可制得 。写出生成
。写出生成 的离子方程式:
的离子方程式:②实际生产中,常将
 溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入
溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入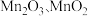 等,其原因是
等,其原因是
您最近一年使用:0次
7日内更新
|
184次组卷
|
2卷引用:福建省泉州中远学校2024届高三下学期5月模拟化学试题
2 . 以某四氯化钛精制厂的尾渣(主要含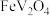 、
、 、NaCl及少量的
、NaCl及少量的 、
、 等)为原料制备
等)为原料制备 的工艺流程如下:
的工艺流程如下: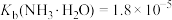 ;
; ;
;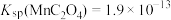
(1)“水洗”的目的为___________ 。“水洗”和“酸浸”后均采用减压过滤,与常压过滤相比,其优点为___________ 。
(2)“焙烧”的目的是将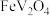 转化为
转化为 和可溶于水的
和可溶于水的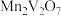 ,以利于“酸浸”时钒浸出。
,以利于“酸浸”时钒浸出。
①该反应的化学方程式为___________ 。
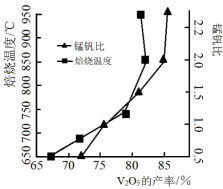
②钒浸出率与焙烧温度、锰钒比的关系如图所示。“焙烧”的最佳温度和锰钒比分别为___________ 、___________ 温度不宜过低的可能原因为___________ 。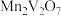 与
与 按物质的量比1:1进行反应的离子方程式为
按物质的量比1:1进行反应的离子方程式为___________
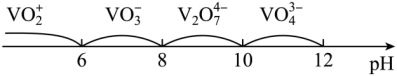
(4)“沉钒”时,在25℃下维持溶液pH=7,向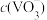 =0.2
=0.2 的酸浸液中加入等体积的
的酸浸液中加入等体积的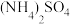 溶液进行反应(忽略溶液混合时体积的变化),反应后溶液中
溶液进行反应(忽略溶液混合时体积的变化),反应后溶液中 =0.005
=0.005 ,则沉钒率为
,则沉钒率为___________ %。
(5)“煅烧”所得 可制成铝钒合金(
可制成铝钒合金(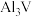 ),其晶胞结构如图所示。用原子的分数坐标可以表示晶胞中各原子的位置,如A点原子的分数坐标为
),其晶胞结构如图所示。用原子的分数坐标可以表示晶胞中各原子的位置,如A点原子的分数坐标为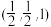 。
。___________ 。
②B点原子的分数坐标为(1, ,
,___________ )(用含b、c的代数式表示),V原子的配位数为___________ 。
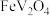 、
、 、NaCl及少量的
、NaCl及少量的 、
、 等)为原料制备
等)为原料制备 的工艺流程如下:
的工艺流程如下: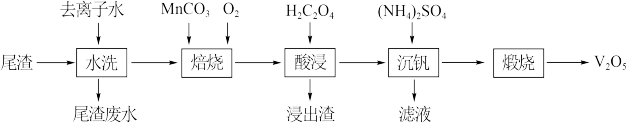
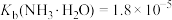 ;
; ;
;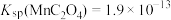
(1)“水洗”的目的为
(2)“焙烧”的目的是将
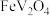 转化为
转化为 和可溶于水的
和可溶于水的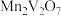 ,以利于“酸浸”时钒浸出。
,以利于“酸浸”时钒浸出。①该反应的化学方程式为
②钒浸出率与焙烧温度、锰钒比的关系如图所示。“焙烧”的最佳温度和锰钒比分别为
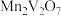 与
与 按物质的量比1:1进行反应的离子方程式为
按物质的量比1:1进行反应的离子方程式为(4)“沉钒”时,在25℃下维持溶液pH=7,向
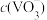 =0.2
=0.2 的酸浸液中加入等体积的
的酸浸液中加入等体积的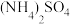 溶液进行反应(忽略溶液混合时体积的变化),反应后溶液中
溶液进行反应(忽略溶液混合时体积的变化),反应后溶液中 =0.005
=0.005 ,则沉钒率为
,则沉钒率为(5)“煅烧”所得
 可制成铝钒合金(
可制成铝钒合金(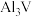 ),其晶胞结构如图所示。用原子的分数坐标可以表示晶胞中各原子的位置,如A点原子的分数坐标为
),其晶胞结构如图所示。用原子的分数坐标可以表示晶胞中各原子的位置,如A点原子的分数坐标为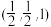 。
。
②B点原子的分数坐标为(1,
 ,
,
您最近一年使用:0次
名校
3 .  作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(
作为一种新型锂电池正极材料受到广泛关注。由菱锰矿( ,含有少量Si、Fe、Ni、Al等元素)制备
,含有少量Si、Fe、Ni、Al等元素)制备 的流程如下:
的流程如下: ,
,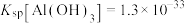 ,
, 。
。
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为___________ 。
(2)加入少量 的作用是
的作用是___________ 。
(3)溶矿反应完成后,反应器中溶液 ,此时
,此时
___________  ;用石灰乳调节至
;用石灰乳调节至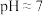 ,除去的金属离子是
,除去的金属离子是___________ 。
(4)加入少量 溶液除去
溶液除去 ,生成的沉淀有
,生成的沉淀有___________ 。
(5)在电解槽中,发生电解反应的离子方程式为___________ 。
(6)一种锰的氧化物晶胞结构如图所示。___________ 。
②已知该晶胞参数为a nm,阿伏加德罗常数为 ,则该锰氧化物的摩尔体积
,则该锰氧化物的摩尔体积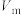 为
为___________  (列出计算式)。
(列出计算式)。
 作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(
作为一种新型锂电池正极材料受到广泛关注。由菱锰矿( ,含有少量Si、Fe、Ni、Al等元素)制备
,含有少量Si、Fe、Ni、Al等元素)制备 的流程如下:
的流程如下:
 ,
,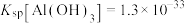 ,
, 。
。回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为
(2)加入少量
 的作用是
的作用是(3)溶矿反应完成后,反应器中溶液
 ,此时
,此时
 ;用石灰乳调节至
;用石灰乳调节至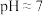 ,除去的金属离子是
,除去的金属离子是(4)加入少量
 溶液除去
溶液除去 ,生成的沉淀有
,生成的沉淀有(5)在电解槽中,发生电解反应的离子方程式为
(6)一种锰的氧化物晶胞结构如图所示。
②已知该晶胞参数为a nm,阿伏加德罗常数为
 ,则该锰氧化物的摩尔体积
,则该锰氧化物的摩尔体积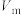 为
为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
4 . 中和渣是有色金属冶炼过程中产生的危险废渣。从中和渣(主要含有 和少量
和少量 、
、 、
、 、
、 的氢氧化物)中回收铜、锌等金属的工艺流程如下图:
的氢氧化物)中回收铜、锌等金属的工艺流程如下图: ,几种物质的
,几种物质的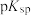 如下表
如下表
②当金属离子浓度小于 时,视为沉淀完全
时,视为沉淀完全
回答下列问题:
(1)“中性浸出”时,采用“中性”的目的是________ 。
(2)“高温高酸浸出”时,“浸渣2”的主要成分为________ 。
(3)“萃铜”时发生反应 ,
,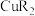 的结构简式如图所示:
的结构简式如图所示: 的价层电子排布图
的价层电子排布图________ 。
②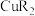 水溶性差的原因是
水溶性差的原因是________ (选填序号)。
a.形成分子内氢键 b.分子结构较稳定 c.亲油基团起主导作用
③萃取剂HR的结构简式为________ 。
(4)“氧化沉淀”时,试剂X用以调节溶液的pH。
①加入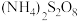 溶液时生成
溶液时生成 沉淀,反应的离子方程式为
沉淀,反应的离子方程式为________ 。
②沉淀后溶液的pH需不低于________ 。
(5)该流程中,可以循环使用的物质有________ 。
(6)某黄铜合金晶胞结构如图,其中A、B的原子坐标均可为 。与Zn原子距离最近且相等的Cu原子有
。与Zn原子距离最近且相等的Cu原子有________ 个,C的原子坐标为________ 。
 和少量
和少量 、
、 、
、 、
、 的氢氧化物)中回收铜、锌等金属的工艺流程如下图:
的氢氧化物)中回收铜、锌等金属的工艺流程如下图: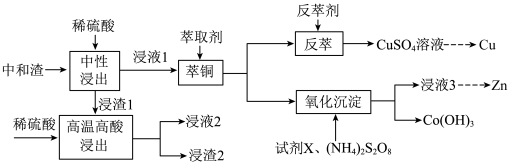
 ,几种物质的
,几种物质的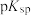 如下表
如下表物质 |
|
|
|
|
|
| 37.4 | 14.6 | 43.7 | 16.9 | 19.6 |
 时,视为沉淀完全
时,视为沉淀完全回答下列问题:
(1)“中性浸出”时,采用“中性”的目的是
(2)“高温高酸浸出”时,“浸渣2”的主要成分为
(3)“萃铜”时发生反应
 ,
, 的结构简式如图所示:
的结构简式如图所示: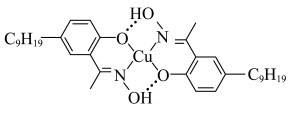
 的价层电子排布图
的价层电子排布图②
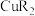 水溶性差的原因是
水溶性差的原因是a.形成分子内氢键 b.分子结构较稳定 c.亲油基团起主导作用
③萃取剂HR的结构简式为
(4)“氧化沉淀”时,试剂X用以调节溶液的pH。
①加入
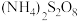 溶液时生成
溶液时生成 沉淀,反应的离子方程式为
沉淀,反应的离子方程式为②沉淀后溶液的pH需不低于
(5)该流程中,可以循环使用的物质有
(6)某黄铜合金晶胞结构如图,其中A、B的原子坐标均可为
 。与Zn原子距离最近且相等的Cu原子有
。与Zn原子距离最近且相等的Cu原子有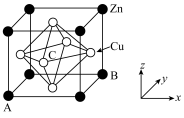
您最近一年使用:0次
5 . 下列实验对应的离子方程式正确的是
A.用 溶液刻蚀印刷电路板: 溶液刻蚀印刷电路板: |
B.将重晶石转化为酸溶性钡盐: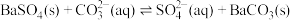 |
C.用 溶液吸收含溴尾气: 溶液吸收含溴尾气: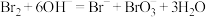 |
D.验证 的漂白性: 的漂白性: |
您最近一年使用:0次
6 . 下列实验设计不能 达到相应实验目的的是
选项 | 实验目的 | 实验设计 |
A | 探究乙醇消去反应的产物 | 取一定量乙醇、浓硫酸、沸石,迅速升温至170℃,将产生的气体通入酸性 中 中 |
B | 配制银氨溶液 | 向 溶液中逐滴加入稀氨水,直至产生的沉淀恰好溶解 溶液中逐滴加入稀氨水,直至产生的沉淀恰好溶解 |
C | 验证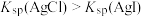 | 向  溶液中滴加2滴等浓度的 溶液中滴加2滴等浓度的 溶液,过滤后往滤液再加入 溶液,过滤后往滤液再加入 溶液 溶液 |
D | 验证浓硫酸的脱水性和氧化性 | 将浓硫酸加入蔗糖中 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
7 . 常温下,向 、
、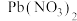 和
和 的混合液中滴加
的混合液中滴加 溶液,
溶液, 与
与 的关系如下图所示,已知:
的关系如下图所示,已知: ,
,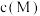 代表
代表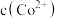 、
、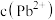 或
或 ;
; ;当被沉淀的离子的物质的量浓度小于
;当被沉淀的离子的物质的量浓度小于 时,认为该离子已沉淀完全。下列叙述正确的是
时,认为该离子已沉淀完全。下列叙述正确的是
 、
、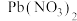 和
和 的混合液中滴加
的混合液中滴加 溶液,
溶液, 与
与 的关系如下图所示,已知:
的关系如下图所示,已知: ,
,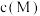 代表
代表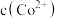 、
、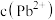 或
或 ;
; ;当被沉淀的离子的物质的量浓度小于
;当被沉淀的离子的物质的量浓度小于 时,认为该离子已沉淀完全。下列叙述正确的是
时,认为该离子已沉淀完全。下列叙述正确的是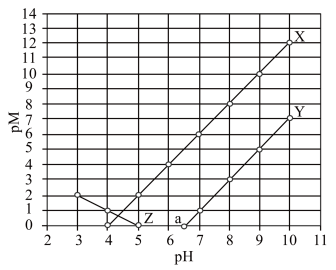
A.常温下,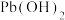 的 的 |
B. 、 、 分别代表 分别代表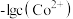 、 、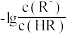 与 与 的关系 的关系 |
C.图中 点对应溶液的 点对应溶液的 为6.5,此时溶液中 为6.5,此时溶液中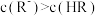 |
D.通过调节溶液 无法分离浓度均为 无法分离浓度均为 的 的 、 、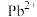 混合溶液 混合溶液 |
您最近一年使用:0次
8 . 锆( )是一种重要的战略金属。一种以氧氯化锆(主要含
)是一种重要的战略金属。一种以氧氯化锆(主要含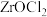 ,还含有少量
,还含有少量 、
、 等元素)为原料生产金属锆的工艺流程如下:
等元素)为原料生产金属锆的工艺流程如下: 、
、 、
、 ;
;
② 时,
时, ,
,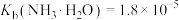 ;
;
③“还原”前后相关物质沸点如下:
回答下列问题:
(1) 是
是 的同族相邻元素,基态
的同族相邻元素,基态 原子的价电子排布式是
原子的价电子排布式是___________ 。
(2)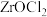 通常采用“一酸一碱”法生产,主要生产过程为:将锆英砂与氢氧化钠混合熔融得到难溶于水的
通常采用“一酸一碱”法生产,主要生产过程为:将锆英砂与氢氧化钠混合熔融得到难溶于水的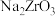 ,再以盐酸酸化得到
,再以盐酸酸化得到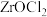 ,写出酸化过程的离子方程式
,写出酸化过程的离子方程式___________ 。
(3)“沉淀”后,废液中 ,则废液中
,则废液中 为
为___________  。
。
(4)“沸腾氯化”时, 转化为
转化为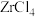 ,同时生成一种还原性气体,该反应的化学方程式为
,同时生成一种还原性气体,该反应的化学方程式为___________ 。
(5)①气态 通常以二聚体
通常以二聚体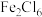 的形式存在,分子结构为
的形式存在,分子结构为 ,二聚体中
,二聚体中 的杂化轨道类型为
的杂化轨道类型为___________ 。 易溶于水,也易溶于乙醚等有机溶剂,请判断其晶体类型为
易溶于水,也易溶于乙醚等有机溶剂,请判断其晶体类型为___________ 。
②“还原”的主要目的是___________ 。
(6)下列金属冶炼方法与本工艺流程中加入 冶炼
冶炼 的方法相似的是___________
的方法相似的是___________
(7)实验室可以用络合滴定法快速测定“酸浸”溶液中锆的含量,步骤如下:___________ ,继续摇动锥形瓶,观察溶液颜色变化。
②已知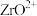 与EDTA发生
与EDTA发生 络合反应,则酸浸液中含量(以
络合反应,则酸浸液中含量(以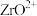 计)为
计)为___________  。
。
 )是一种重要的战略金属。一种以氧氯化锆(主要含
)是一种重要的战略金属。一种以氧氯化锆(主要含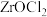 ,还含有少量
,还含有少量 、
、 等元素)为原料生产金属锆的工艺流程如下:
等元素)为原料生产金属锆的工艺流程如下: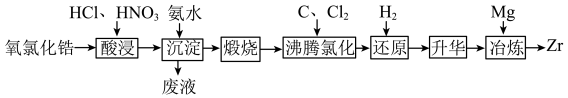
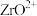 、
、 、
、 ;
;②
 时,
时, ,
,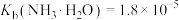 ;
;③“还原”前后相关物质沸点如下:
| 物质 | 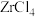 |  |  |  |  |
| 沸点 | 331 | 315 | 1300 | 700 | 1150 |
(1)
 是
是 的同族相邻元素,基态
的同族相邻元素,基态 原子的价电子排布式是
原子的价电子排布式是(2)
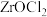 通常采用“一酸一碱”法生产,主要生产过程为:将锆英砂与氢氧化钠混合熔融得到难溶于水的
通常采用“一酸一碱”法生产,主要生产过程为:将锆英砂与氢氧化钠混合熔融得到难溶于水的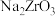 ,再以盐酸酸化得到
,再以盐酸酸化得到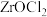 ,写出酸化过程的离子方程式
,写出酸化过程的离子方程式(3)“沉淀”后,废液中
 ,则废液中
,则废液中 为
为 。
。(4)“沸腾氯化”时,
 转化为
转化为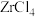 ,同时生成一种还原性气体,该反应的化学方程式为
,同时生成一种还原性气体,该反应的化学方程式为(5)①气态
 通常以二聚体
通常以二聚体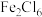 的形式存在,分子结构为
的形式存在,分子结构为 ,二聚体中
,二聚体中 的杂化轨道类型为
的杂化轨道类型为 易溶于水,也易溶于乙醚等有机溶剂,请判断其晶体类型为
易溶于水,也易溶于乙醚等有机溶剂,请判断其晶体类型为②“还原”的主要目的是
(6)下列金属冶炼方法与本工艺流程中加入
 冶炼
冶炼 的方法相似的是___________
的方法相似的是___________| A.高炉炼铁 | B.电解熔融氯化钠制钠 |
| C.铝热反应制锰 | D.氧化汞分解制汞 |
(7)实验室可以用络合滴定法快速测定“酸浸”溶液中锆的含量,步骤如下:

②已知
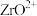 与EDTA发生
与EDTA发生 络合反应,则酸浸液中含量(以
络合反应,则酸浸液中含量(以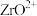 计)为
计)为 。
。
您最近一年使用:0次
9 . 氯化亚铜(CuCl)广泛应用于有机合成,难溶于水和乙醇,在潮湿空气中易氧化和水解。某学习小组探究CuCl的制备并测定纯度。回答下列问题:
已知:①
②某些含铜化合物和离子在水中的颜色和状态如下表:
Ⅰ.组装仪器,检查装置气密性,添加药品;
Ⅱ.水浴加热三颈烧瓶,打开K1、K2;
Ⅲ.待三颈烧瓶中溶液由黄绿色变为无色,关闭K1、K2;
Ⅳ.通过注射器向三颈烧瓶中加入水,生成白色沉淀,一段时间后部分沉淀变为棕红色。
(1)仪器a的名称为___________ ;B的作用为___________ (答出一点即可)。
(2)步骤Ⅲ反应的离子方程式为___________ 。
(3)步骤Ⅳ中,沉淀由白色转化为棕红色的原因___________ 。
(4)为防止生成棕红色固体,还需在原步骤Ⅰ中通过注射器往三颈烧瓶中加入一定量___________ (药品名称),再按上述步骤进行实验即可。
(5)产品先快速水洗后再醇洗,醇洗的目的为___________ 。
(6)测定CuCl产品纯度:将10.00 g产品溶于硝酸,配成250 mL溶液,取25.00 mL,加20.00 mL 0.5000 mol/L AgNO3溶液,充分反应后,加少量硝基苯覆盖沉淀。NH4Fe(SO4)2溶液作指示剂,用0.1000mol/L NH4SCN标准溶液滴定过量的AgNO3溶液,平行实验三次,平均消耗NH4SCN溶液10.00 mL。产品的纯度为___________ ,若未加入硝基苯会导致测定结果___________ (填“偏高”或“偏低”或“无影响”)。
[已知: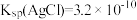 ,
,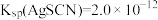 ]。
]。
已知:①

②某些含铜化合物和离子在水中的颜色和状态如下表:
| 化合物或离子 | CuCl | [CuCl4]2- | [CuCl3]2- | CuOH | Cu2O |
| 颜色和状态 | 白色沉淀 | 黄绿色溶液 | 无色溶液 | 黄色沉淀 | 棕红色沉淀 |
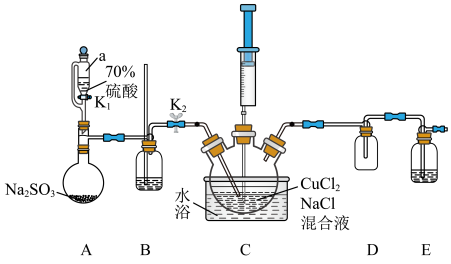
Ⅰ.组装仪器,检查装置气密性,添加药品;
Ⅱ.水浴加热三颈烧瓶,打开K1、K2;
Ⅲ.待三颈烧瓶中溶液由黄绿色变为无色,关闭K1、K2;
Ⅳ.通过注射器向三颈烧瓶中加入水,生成白色沉淀,一段时间后部分沉淀变为棕红色。
(1)仪器a的名称为
(2)步骤Ⅲ反应的离子方程式为
(3)步骤Ⅳ中,沉淀由白色转化为棕红色的原因
(4)为防止生成棕红色固体,还需在原步骤Ⅰ中通过注射器往三颈烧瓶中加入一定量
(5)产品先快速水洗后再醇洗,醇洗的目的为
(6)测定CuCl产品纯度:将10.00 g产品溶于硝酸,配成250 mL溶液,取25.00 mL,加20.00 mL 0.5000 mol/L AgNO3溶液,充分反应后,加少量硝基苯覆盖沉淀。NH4Fe(SO4)2溶液作指示剂,用0.1000mol/L NH4SCN标准溶液滴定过量的AgNO3溶液,平行实验三次,平均消耗NH4SCN溶液10.00 mL。产品的纯度为
[已知:
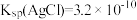 ,
,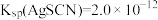 ]。
]。
您最近一年使用:0次
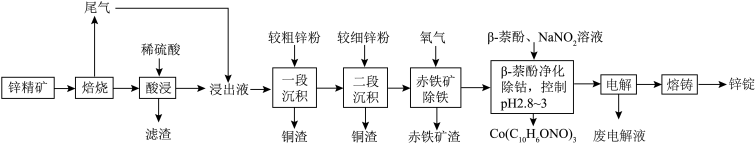
10 . 湿法炼锌具有能耗低,生成产品纯度高等特点,其主要原料为锌精矿(主要成分为硫化锌,还含有铁、钴、铜、镉、铅等元素的杂质),获得较纯锌锭的工艺流程如图: 、
、 、CdO。
、CdO。
(1)铜原子的价层电子排布图为________ 。
(2)“酸浸”中滤渣主要成分为________ 。
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:________ 。
(4)写出“赤铁矿除铁”过程中反应的离子方程式:_________ 。
(5)“ 萘酚净化除钴”先是
萘酚净化除钴”先是 把
把 氧化成
氧化成 ,并生成NO,
,并生成NO, 与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出
与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出 被氧化的离子方程式:
被氧化的离子方程式:________ 。
(6)“电解”工艺中,电解液常有较高浓度的 会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和
会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和 ,生成CuCl沉淀从而除去
,生成CuCl沉淀从而除去 ,发生的反应为
,发生的反应为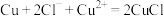 ,该反应的平衡常数
,该反应的平衡常数
________ 。[已知: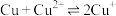
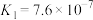 ;
; ]
]
(7)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。
________ ,
________ ;充电过程中ZnS到 的电极反应式为
的电极反应式为________ (x和y用具体数字表示)。
②若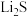 的晶胞参数为a nm,则EF间的距离为
的晶胞参数为a nm,则EF间的距离为________ nm。
 、
、 、CdO。
、CdO。(1)铜原子的价层电子排布图为
(2)“酸浸”中滤渣主要成分为
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:
(4)写出“赤铁矿除铁”过程中反应的离子方程式:
(5)“
 萘酚净化除钴”先是
萘酚净化除钴”先是 把
把 氧化成
氧化成 ,并生成NO,
,并生成NO, 与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出
与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出 被氧化的离子方程式:
被氧化的离子方程式:(6)“电解”工艺中,电解液常有较高浓度的
 会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和
会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和 ,生成CuCl沉淀从而除去
,生成CuCl沉淀从而除去 ,发生的反应为
,发生的反应为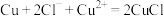 ,该反应的平衡常数
,该反应的平衡常数
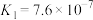 ;
; ]
](7)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。
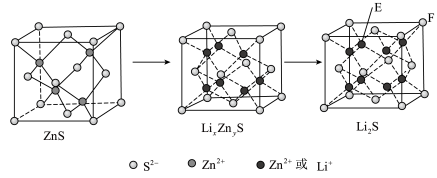


 的电极反应式为
的电极反应式为②若
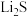 的晶胞参数为a nm,则EF间的距离为
的晶胞参数为a nm,则EF间的距离为
您最近一年使用:0次







