名校
解题方法
1 . 下列生活情境中对应的离子方程式正确的是
A.泡沫灭火器灭火原理: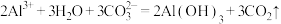 |
B.除水垢时,先用Na2CO3溶液浸泡: |
C.铅蓄电池放电时总反应: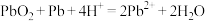 |
D.84消毒液与洁厕灵不能混合使用原理: |
您最近一年使用:0次
2024-05-29更新
|
637次组卷
|
3卷引用:福建省厦门市国祺中学2023-2024学年高三下学期第二次模拟化学试题
名校
解题方法
2 . 锌电解阳极泥(主要成分为 和
和 ,还有少量锰铅氧化物
,还有少量锰铅氧化物 和
和 )是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锰、铅和银的工艺流程如图所示。回答下列问题:
)是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锰、铅和银的工艺流程如图所示。回答下列问题: 易溶于水,不溶于乙醇
易溶于水,不溶于乙醇
②在较高温度及酸性催化条件下,葡萄糖能发生如图反应: 时
时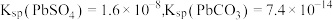
(1)已知 中
中 为
为 价,
价, 为
为 价和
价和 价,该氧化物中
价,该氧化物中 价和
价和 价
价 的物质的量之比为
的物质的量之比为_______ 。
(2)“还原酸浸”过程中主要反应的离子方程式为_______ ,该过程中实际葡萄糖加入量远大于理论需要量,其原因是_______ 。
(3)整个流程中可循环利用的物质是_______ (填名称)。获得 晶体的一系列操作是蒸发结晶、趁热过滤、洗涤、低温干燥,其中“洗涤”的具体操作是
晶体的一系列操作是蒸发结晶、趁热过滤、洗涤、低温干燥,其中“洗涤”的具体操作是_______ 。
(4)书写相关反应的离子方程式,并通过计算说明 时,可用
时,可用 溶液将“滤渣1”中的
溶液将“滤渣1”中的 完全转化为
完全转化为 的原因
的原因_______ 。
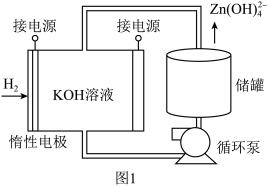
(5)通过氢电极增压法可制得单质锌,装置如图1所示。电解池工作时总反应的离子方程式为_______ 。 和
和 作为敏化剂的太阳能电池,能量转换效率已经超过其他类型太阳能电池。
作为敏化剂的太阳能电池,能量转换效率已经超过其他类型太阳能电池。
① 和
和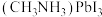 中
中 与
与 之间、
之间、 与
与 之间的离子键成分的百分数大小比较及解释
之间的离子键成分的百分数大小比较及解释_______ 。
②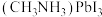 晶胞结构如图2所示,其中
晶胞结构如图2所示,其中 代表
代表 。当
。当 位于晶胞的体心时,
位于晶胞的体心时, 于晶胞的
于晶胞的_______ 位置(填“顶点”“面心”“棱心”或“晶胞内”)。
 和
和 ,还有少量锰铅氧化物
,还有少量锰铅氧化物 和
和 )是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锰、铅和银的工艺流程如图所示。回答下列问题:
)是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锰、铅和银的工艺流程如图所示。回答下列问题: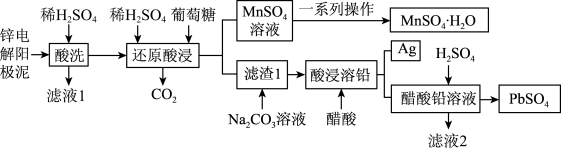
 易溶于水,不溶于乙醇
易溶于水,不溶于乙醇②在较高温度及酸性催化条件下,葡萄糖能发生如图反应:
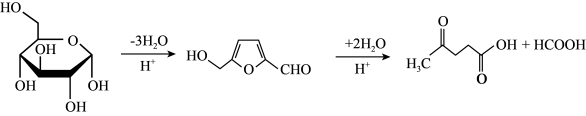
 时
时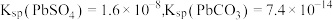
(1)已知
 中
中 为
为 价,
价, 为
为 价和
价和 价,该氧化物中
价,该氧化物中 价和
价和 价
价 的物质的量之比为
的物质的量之比为(2)“还原酸浸”过程中主要反应的离子方程式为
(3)整个流程中可循环利用的物质是
 晶体的一系列操作是蒸发结晶、趁热过滤、洗涤、低温干燥,其中“洗涤”的具体操作是
晶体的一系列操作是蒸发结晶、趁热过滤、洗涤、低温干燥,其中“洗涤”的具体操作是(4)书写相关反应的离子方程式,并通过计算说明
 时,可用
时,可用 溶液将“滤渣1”中的
溶液将“滤渣1”中的 完全转化为
完全转化为 的原因
的原因(5)通过氢电极增压法可制得单质锌,装置如图1所示。电解池工作时总反应的离子方程式为
 和
和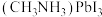 作为敏化剂的太阳能电池,能量转换效率已经超过其他类型太阳能电池。
作为敏化剂的太阳能电池,能量转换效率已经超过其他类型太阳能电池。①
 和
和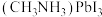 中
中 与
与 之间、
之间、 与
与 之间的离子键成分的百分数大小比较及解释
之间的离子键成分的百分数大小比较及解释②
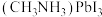 晶胞结构如图2所示,其中
晶胞结构如图2所示,其中 代表
代表 。当
。当 位于晶胞的体心时,
位于晶胞的体心时, 于晶胞的
于晶胞的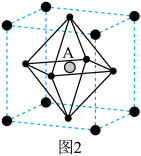
您最近一年使用:0次
2024-05-29更新
|
120次组卷
|
2卷引用:福建省福州延安中学2024届高三下学期高考第一次模拟化学试题
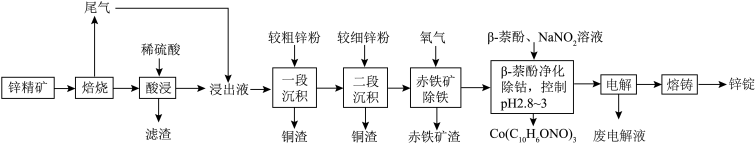
3 . 湿法炼锌具有能耗低,生成产品纯度高等特点,其主要原料为锌精矿(主要成分为硫化锌,还含有铁、钴、铜、镉、铅等元素的杂质),获得较纯锌锭的工艺流程如图: 、
、 、CdO。
、CdO。
(1)铜原子的价层电子排布图为________ 。
(2)“酸浸”中滤渣主要成分为________ 。
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:________ 。
(4)写出“赤铁矿除铁”过程中反应的离子方程式:_________ 。
(5)“ 萘酚净化除钴”先是
萘酚净化除钴”先是 把
把 氧化成
氧化成 ,并生成NO,
,并生成NO, 与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出
与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出 被氧化的离子方程式:
被氧化的离子方程式:________ 。
(6)“电解”工艺中,电解液常有较高浓度的 会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和
会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和 ,生成CuCl沉淀从而除去
,生成CuCl沉淀从而除去 ,发生的反应为
,发生的反应为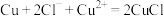 ,该反应的平衡常数
,该反应的平衡常数
________ 。[已知: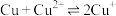
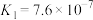 ;
; ]
]
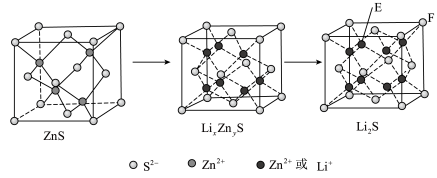
(7)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。
________ ,
________ ;充电过程中ZnS到 的电极反应式为
的电极反应式为________ (x和y用具体数字表示)。
②若 的晶胞参数为a nm,则EF间的距离为
的晶胞参数为a nm,则EF间的距离为________ nm。
 、
、 、CdO。
、CdO。(1)铜原子的价层电子排布图为
(2)“酸浸”中滤渣主要成分为
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:
(4)写出“赤铁矿除铁”过程中反应的离子方程式:
(5)“
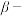 萘酚净化除钴”先是
萘酚净化除钴”先是 把
把 氧化成
氧化成 ,并生成NO,
,并生成NO, 与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出
与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出 被氧化的离子方程式:
被氧化的离子方程式:(6)“电解”工艺中,电解液常有较高浓度的
 会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和
会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和 ,生成CuCl沉淀从而除去
,生成CuCl沉淀从而除去 ,发生的反应为
,发生的反应为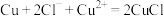 ,该反应的平衡常数
,该反应的平衡常数
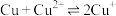
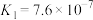 ;
; ]
](7)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。


 的电极反应式为
的电极反应式为②若
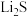 的晶胞参数为a nm,则EF间的距离为
的晶胞参数为a nm,则EF间的距离为
您最近一年使用:0次
名校
4 . 利用某钒废渣(主要成分为 以及铁、铝、硅的氧化物)制备
以及铁、铝、硅的氧化物)制备 的工艺流程如图。
的工艺流程如图。 溶于酸后以
溶于酸后以 的形式存在;过量
的形式存在;过量 可氧化
可氧化 ;
;
Ⅱ. (有机层)
(有机层)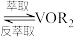 (有机层)
(有机层) ;
;
Ⅲ.溶液中 与
与 可相互转化:
可相互转化: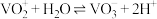 。
。
下列说法错误的是
 以及铁、铝、硅的氧化物)制备
以及铁、铝、硅的氧化物)制备 的工艺流程如图。
的工艺流程如图。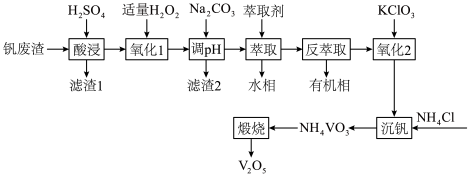
 溶于酸后以
溶于酸后以 的形式存在;过量
的形式存在;过量 可氧化
可氧化 ;
;Ⅱ.
 (有机层)
(有机层)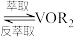 (有机层)
(有机层) ;
;Ⅲ.溶液中
 与
与 可相互转化:
可相互转化: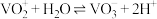 。
。下列说法错误的是
| A.“氧化1”中,不适宜用升温的方式加快转化速率 |
B.“滤渣2”的成分为 |
| C.有机萃取剂可循环使用 |
D.“沉钒”时还需通 调节溶液的酸碱性 调节溶液的酸碱性 |
您最近一年使用:0次
2024-05-28更新
|
512次组卷
|
4卷引用:福建省福州市八县市一中2024届高三下学期模拟联考化学试题
福建省福州市八县市一中2024届高三下学期模拟联考化学试题2024届湖南省湖南大学附属中学高三下学期二模 化学试题 (已下线)江苏省姜堰中学、如东中学、前黄中学三校2023-2024学年高三下学期联考化学试题江苏省部分学校2024届高三下学期高考模拟化学试题
名校
5 . 二氧化铈( )具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含
)具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含 、
、 等)为原料制备
等)为原料制备 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)“氧化焙烧”后,Ce元素转化为 和
和 ,写出氧化焙烧的化学方程式
,写出氧化焙烧的化学方程式_______ 。
(2)“酸浸”时,铈的浸出率与温度、 的关系如图所示,应选择的最适宜的条件为
的关系如图所示,应选择的最适宜的条件为_______ (填标号)。不能用盐酸代替硫酸进行酸浸,理由是_______ 。 B.75℃、
B.75℃、 C.85℃、
C.85℃、 D.100℃、
D.100℃、
(3)“系列操作”包含以下几个过程: 不能溶于有机物TBP,
不能溶于有机物TBP,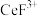 能溶于有机物TBP,且存在反应
能溶于有机物TBP,且存在反应 。
。
“系列操作”在_______ (填仪器名称)中完成,“有机层B”中发生反应的离子方程式为_______ 。
(4)“调pH”中,要使 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制pH大于
为沉淀完全),应控制pH大于_______ (已知:25℃时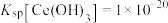 )。
)。
(5)“氧化”中,氧化剂与还原剂的物质的量之比为_______ 。
(6) 具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。
具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。 中位于晶粒表面的
中位于晶粒表面的 具有催化作用。已知
具有催化作用。已知 晶胞边长为
晶胞边长为 ,在边长为
,在边长为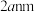 的立方体晶粒中位于表面的
的立方体晶粒中位于表面的 最多有
最多有_______ 个。
②在尾气消除过程中 与
与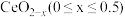 相互转化。
相互转化。 中的Ce为
中的Ce为 、
、 价,测定x的值可判断它们的比例。现取
价,测定x的值可判断它们的比例。现取 固体1.6560g,加入足量硫酸和
固体1.6560g,加入足量硫酸和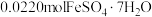 充分溶解,使
充分溶解,使 ⁺全部被还原成
⁺全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性:
标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性: ),则x的值为
),则x的值为_______ ,则此时氧空位率为_______ 。
 )具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含
)具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含 、
、 等)为原料制备
等)为原料制备 的一种工艺流程如图所示。
的一种工艺流程如图所示。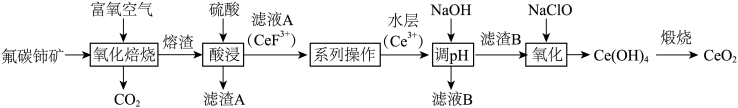
(1)“氧化焙烧”后,Ce元素转化为
 和
和 ,写出氧化焙烧的化学方程式
,写出氧化焙烧的化学方程式(2)“酸浸”时,铈的浸出率与温度、
 的关系如图所示,应选择的最适宜的条件为
的关系如图所示,应选择的最适宜的条件为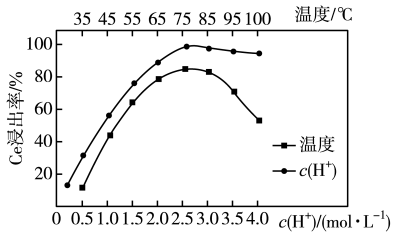
 B.75℃、
B.75℃、 C.85℃、
C.85℃、 D.100℃、
D.100℃、
(3)“系列操作”包含以下几个过程:
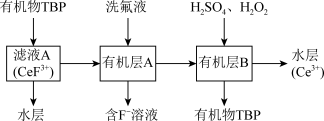
 不能溶于有机物TBP,
不能溶于有机物TBP, 能溶于有机物TBP,且存在反应
能溶于有机物TBP,且存在反应 。
。“系列操作”在
(4)“调pH”中,要使
 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制pH大于
为沉淀完全),应控制pH大于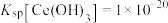 )。
)。(5)“氧化”中,氧化剂与还原剂的物质的量之比为
(6)
 具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。
具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。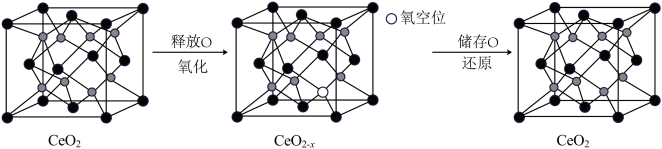
 中位于晶粒表面的
中位于晶粒表面的 具有催化作用。已知
具有催化作用。已知 晶胞边长为
晶胞边长为 ,在边长为
,在边长为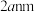 的立方体晶粒中位于表面的
的立方体晶粒中位于表面的 最多有
最多有②在尾气消除过程中
 与
与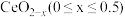 相互转化。
相互转化。 中的Ce为
中的Ce为 、
、 价,测定x的值可判断它们的比例。现取
价,测定x的值可判断它们的比例。现取 固体1.6560g,加入足量硫酸和
固体1.6560g,加入足量硫酸和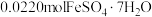 充分溶解,使
充分溶解,使 ⁺全部被还原成
⁺全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性:
标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性: ),则x的值为
),则x的值为
您最近一年使用:0次
6 . 以天青石 (主要成分: 和炭粉焙烧后的水浸液为原料制备
和炭粉焙烧后的水浸液为原料制备  的流程如图所示。
的流程如图所示。 其中。
其中。  约为
约为  。
。
ii.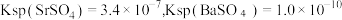 。
。
iii. Sr、Ba分别位于第5、6周期 A族。
A族。
下列说法错误的是
 和炭粉焙烧后的水浸液为原料制备
和炭粉焙烧后的水浸液为原料制备  的流程如图所示。
的流程如图所示。
 其中。
其中。  约为
约为  。
。ii.
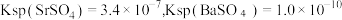 。
。iii. Sr、Ba分别位于第5、6周期
 A族。
A族。下列说法错误的是
A.“焙烧”烟气中可能含有CO和 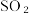 |
| B.“沉钡”后的滤液呈酸性 |
C.“沉钡”过程若  降到 降到  滤渣中混有 滤渣中混有  |
| D.硫酸锶的熔点高于硫酸钡 |
您最近一年使用:0次
2024·福建·模拟预测
解题方法
7 . 硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”。它易溶于水,难溶于乙醇,加热、遇酸均易分解。下图为实验室制取硫代硫酸钠的装置:
I. 制备:
制备:
装置A制备的 经过三通阀通入装置C中的混合溶液,加热、搅拌,至溶液
经过三通阀通入装置C中的混合溶液,加热、搅拌,至溶液 约为
约为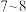 时,停止通入
时,停止通入 气体,得产品混合溶液。
气体,得产品混合溶液。
Ⅱ.产品分离提纯:
产品混合溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到 产品。
产品。
回答下列问题:
(1)装置A中装 的仪器名称为
的仪器名称为___________ 。装置B中的药品可以选择下列物质中的___________ (填字母)。
A.饱和食盐水 B. 溶液 C.饱和
溶液 C.饱和 溶液 D.酸性
溶液 D.酸性 溶液
溶液
(2)为了保证硫代硫酸钠的产量,实验中通入的 不能过量。若
不能过量。若 过量使溶液
过量使溶液 ,产率会降低,请用离子方程式解释原因:
,产率会降低,请用离子方程式解释原因:___________ ;理论上 和
和 的最佳物质的量之比应为
的最佳物质的量之比应为___________ 。
(3)当数据采集处 接近
接近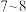 时,三通阀(如图1)的孔路位置应调节为
时,三通阀(如图1)的孔路位置应调节为___________ (填字母)。 的结构如图2所示(可视为一个S原子取代了
的结构如图2所示(可视为一个S原子取代了 中的一个O原子。);
中的一个O原子。);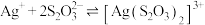 ,常温下,
,常温下, ;
;
 溶液溶解
溶液溶解 生成
生成 的离子方程式:
的离子方程式:___________ ,常温下,该反应的化学平衡常数为___________ 。在配合物离子 中,
中,___________ (填字母)不可能作配位原子。
a. 中的中心S原子 b.
中的中心S原子 b. 中的端基S原子
中的端基S原子

I.
 制备:
制备:装置A制备的
 经过三通阀通入装置C中的混合溶液,加热、搅拌,至溶液
经过三通阀通入装置C中的混合溶液,加热、搅拌,至溶液 约为
约为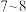 时,停止通入
时,停止通入 气体,得产品混合溶液。
气体,得产品混合溶液。Ⅱ.产品分离提纯:
产品混合溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到
 产品。
产品。回答下列问题:
(1)装置A中装
 的仪器名称为
的仪器名称为A.饱和食盐水 B.
 溶液 C.饱和
溶液 C.饱和 溶液 D.酸性
溶液 D.酸性 溶液
溶液(2)为了保证硫代硫酸钠的产量,实验中通入的
 不能过量。若
不能过量。若 过量使溶液
过量使溶液 ,产率会降低,请用离子方程式解释原因:
,产率会降低,请用离子方程式解释原因: 和
和 的最佳物质的量之比应为
的最佳物质的量之比应为(3)当数据采集处
 接近
接近 时,三通阀(如图1)的孔路位置应调节为
时,三通阀(如图1)的孔路位置应调节为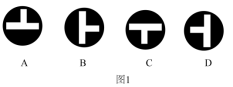
 的结构如图2所示(可视为一个S原子取代了
的结构如图2所示(可视为一个S原子取代了 中的一个O原子。);
中的一个O原子。);
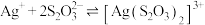 ,常温下,
,常温下, ;
; 溶液溶解
溶液溶解 生成
生成 的离子方程式:
的离子方程式: 中,
中,a.
 中的中心S原子 b.
中的中心S原子 b. 中的端基S原子
中的端基S原子
您最近一年使用:0次
8 . 以软锰矿浆(含 及少量
及少量 等)吸收烟气中
等)吸收烟气中 并制备高纯
并制备高纯 。
。
(1)吸收 。
。
①将烟气与软锰矿浆在吸收塔中逆流接触,烟气中的 被充分吸收,矿浆中的
被充分吸收,矿浆中的 转化为
转化为 。写出
。写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:_______ 。
②脱硫过程中软锰矿浆的 和
和 吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆
吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆 下降,但15小时前
下降,但15小时前 下降缓慢,其主要原因是
下降缓慢,其主要原因是_______ 。 吸收率急剧下降。此时加入菱锰矿
吸收率急剧下降。此时加入菱锰矿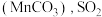 吸收率又可恢复至
吸收率又可恢复至 以上,其原因是
以上,其原因是_______ 。
(2)净化 。
。
①过滤脱硫后的软锰矿浆液,用 沉淀除去所得滤液中的
沉淀除去所得滤液中的 、Mg2+(浓度小于
、Mg2+(浓度小于 )。此时应控制溶液中
)。此时应控制溶液中 略大于
略大于_______  。(已知:
。(已知: 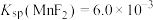 、
、 ,
, 、)
、)
②净化时生成的 沉淀晶胞结构如图所示。在
沉淀晶胞结构如图所示。在 晶胞中
晶胞中 周围距离最近的
周围距离最近的 形成的空隙构型为
形成的空隙构型为_______ 。 。
。
①向反应器中加入 溶液,控制80℃恒温,搅拌下鼓入空气可制得
溶液,控制80℃恒温,搅拌下鼓入空气可制得 。写出生成
。写出生成 的离子方程式:
的离子方程式:_______ 。
②实际生产中,常将 溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入
溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入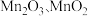 等,其原因是
等,其原因是_______ 。
 及少量
及少量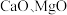 等)吸收烟气中
等)吸收烟气中 并制备高纯
并制备高纯 。
。(1)吸收
 。
。①将烟气与软锰矿浆在吸收塔中逆流接触,烟气中的
 被充分吸收,矿浆中的
被充分吸收,矿浆中的 转化为
转化为 。写出
。写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:②脱硫过程中软锰矿浆的
 和
和 吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆
吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆 下降,但15小时前
下降,但15小时前 下降缓慢,其主要原因是
下降缓慢,其主要原因是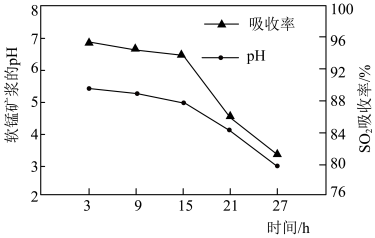
 吸收率急剧下降。此时加入菱锰矿
吸收率急剧下降。此时加入菱锰矿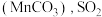 吸收率又可恢复至
吸收率又可恢复至 以上,其原因是
以上,其原因是(2)净化
 。
。①过滤脱硫后的软锰矿浆液,用
 沉淀除去所得滤液中的
沉淀除去所得滤液中的 、Mg2+(浓度小于
、Mg2+(浓度小于 )。此时应控制溶液中
)。此时应控制溶液中 略大于
略大于 。(已知:
。(已知: 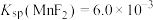 、
、 ,
, 、)
、)②净化时生成的
 沉淀晶胞结构如图所示。在
沉淀晶胞结构如图所示。在 晶胞中
晶胞中 周围距离最近的
周围距离最近的 形成的空隙构型为
形成的空隙构型为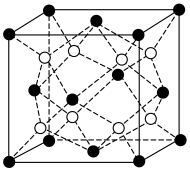
 。
。①向反应器中加入
 溶液,控制80℃恒温,搅拌下鼓入空气可制得
溶液,控制80℃恒温,搅拌下鼓入空气可制得 。写出生成
。写出生成 的离子方程式:
的离子方程式:②实际生产中,常将
 溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入
溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入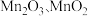 等,其原因是
等,其原因是
您最近一年使用:0次
2024-05-25更新
|
315次组卷
|
2卷引用:福建省泉州中远学校2024届高三下学期5月模拟化学试题
9 . 可利用干法热分解法和湿法催化氧化法高效脱除沼气中的 。
。
(1)已知:部分键能数据为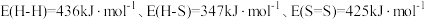 。
。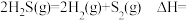
___________  。
。
(2)干法热分解法原理为 。向体积为
。向体积为 恒容容器中充入
恒容容器中充入 ,初始压强为
,初始压强为 ,平衡时体系中各物质
,平衡时体系中各物质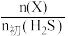 随温度t的变化如图。
随温度t的变化如图。 对应图中的曲线是
对应图中的曲线是___________ (填字母),结合平衡移动原理说明理由。___________
②t1℃时, 的平衡转化率为
的平衡转化率为___________ ,分压平衡常数
___________ (以分压表示,分压=总压×物质的量分数,列计算式即可)。
(3)湿法催化氧化法高效脱除 的过程如下。
的过程如下。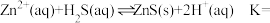
___________ 。(已知:25℃时, 的
的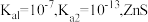 的
的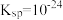 )
)
②“氧化沉硫”中发生反应的离子方程式有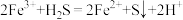 、
、___________ 。
③ 对脱硫效率影响如图。随着
对脱硫效率影响如图。随着 增大,脱硫效率趋于平缓的原因是
增大,脱硫效率趋于平缓的原因是___________ 。___________ (填化学式)。
(4)相比湿法催化氧化法,干法热分解法的优点是___________ ,缺点是___________ 。
 。
。(1)已知:部分键能数据为
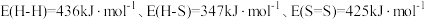 。
。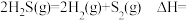
 。
。(2)干法热分解法原理为
 。向体积为
。向体积为 恒容容器中充入
恒容容器中充入 ,初始压强为
,初始压强为 ,平衡时体系中各物质
,平衡时体系中各物质 随温度t的变化如图。
随温度t的变化如图。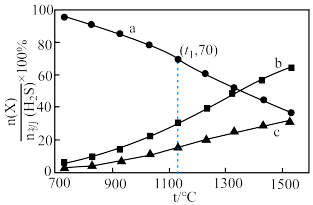
 对应图中的曲线是
对应图中的曲线是②t1℃时,
 的平衡转化率为
的平衡转化率为
(3)湿法催化氧化法高效脱除
 的过程如下。
的过程如下。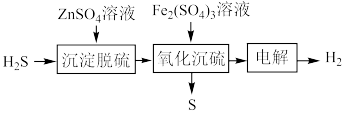
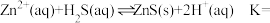
 的
的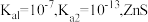 的
的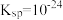 )
)②“氧化沉硫”中发生反应的离子方程式有
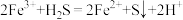 、
、③
 对脱硫效率影响如图。随着
对脱硫效率影响如图。随着 增大,脱硫效率趋于平缓的原因是
增大,脱硫效率趋于平缓的原因是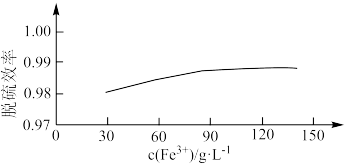
(4)相比湿法催化氧化法,干法热分解法的优点是
您最近一年使用:0次
10 . 利用某阳极泥(含 和
和 单质)回收贵金属
单质)回收贵金属 并合成高能量密度材料
并合成高能量密度材料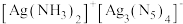 的工艺流程如下。
的工艺流程如下。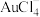 的离子方程式为
的离子方程式为___________ 。
(2)“还原”过程发生反应的化学方程式为___________ 。
(3)溶液中含银微粒的物质的量分数随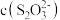 的变化如图。
的变化如图。 ,应调节
,应调节 最佳浓度为
最佳浓度为___________  。
。
②25℃时, 的
的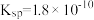 ,
, 的
的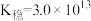 ,
,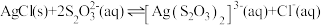 的平衡常数
的平衡常数
___________ 。
(4)“电解”过程生成 的电极反应式为
的电极反应式为___________ 。
(5)“溶解”过程可提高溶解速率的措施有___________ (填1条)。
(6)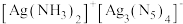 晶体的局部结构如图。
晶体的局部结构如图。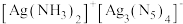 晶体中存在的微粒间作用力有
晶体中存在的微粒间作用力有___________ (填标号)。
A.离子键 B. 键 C.
键 C. 键 D.金属键 E.氢键
键 D.金属键 E.氢键
②晶体中 的杂化轨道类型
的杂化轨道类型___________ (填“相同”或“不同”),依据是___________ 。
 和
和 单质)回收贵金属
单质)回收贵金属 并合成高能量密度材料
并合成高能量密度材料 的工艺流程如下。
的工艺流程如下。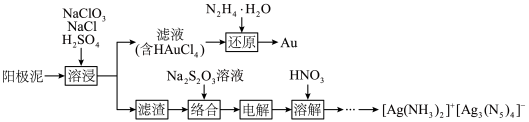
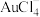 的离子方程式为
的离子方程式为(2)“还原”过程发生反应的化学方程式为
(3)溶液中含银微粒的物质的量分数随
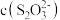 的变化如图。
的变化如图。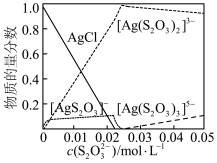
 ,应调节
,应调节 最佳浓度为
最佳浓度为 。
。②25℃时,
 的
的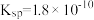 ,
, 的
的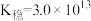 ,
,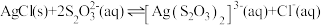 的平衡常数
的平衡常数
(4)“电解”过程生成
 的电极反应式为
的电极反应式为(5)“溶解”过程可提高溶解速率的措施有
(6)
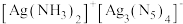 晶体的局部结构如图。
晶体的局部结构如图。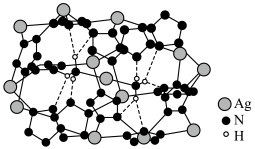
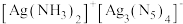 晶体中存在的微粒间作用力有
晶体中存在的微粒间作用力有A.离子键 B.
 键 C.
键 C. 键 D.金属键 E.氢键
键 D.金属键 E.氢键②晶体中
 的杂化轨道类型
的杂化轨道类型
您最近一年使用:0次



