利用某阳极泥(含 和
和 单质)回收贵金属
单质)回收贵金属 并合成高能量密度材料
并合成高能量密度材料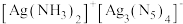 的工艺流程如下。
的工艺流程如下。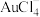 的离子方程式为
的离子方程式为___________ 。
(2)“还原”过程发生反应的化学方程式为___________ 。
(3)溶液中含银微粒的物质的量分数随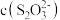 的变化如图。
的变化如图。 ,应调节
,应调节 最佳浓度为
最佳浓度为___________  。
。
②25℃时, 的
的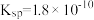 ,
, 的
的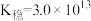 ,
,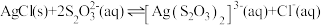 的平衡常数
的平衡常数
___________ 。
(4)“电解”过程生成 的电极反应式为
的电极反应式为___________ 。
(5)“溶解”过程可提高溶解速率的措施有___________ (填1条)。
(6)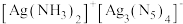 晶体的局部结构如图。
晶体的局部结构如图。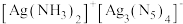 晶体中存在的微粒间作用力有
晶体中存在的微粒间作用力有___________ (填标号)。
A.离子键 B. 键 C.
键 C. 键 D.金属键 E.氢键
键 D.金属键 E.氢键
②晶体中 的杂化轨道类型
的杂化轨道类型___________ (填“相同”或“不同”),依据是___________ 。
 和
和 单质)回收贵金属
单质)回收贵金属 并合成高能量密度材料
并合成高能量密度材料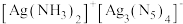 的工艺流程如下。
的工艺流程如下。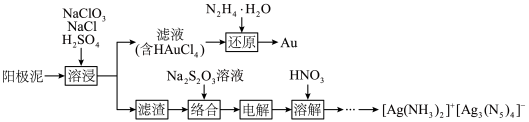
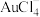 的离子方程式为
的离子方程式为(2)“还原”过程发生反应的化学方程式为
(3)溶液中含银微粒的物质的量分数随
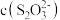 的变化如图。
的变化如图。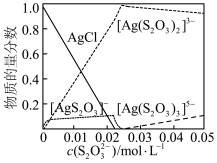
 ,应调节
,应调节 最佳浓度为
最佳浓度为 。
。②25℃时,
 的
的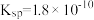 ,
, 的
的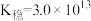 ,
,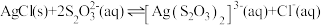 的平衡常数
的平衡常数
(4)“电解”过程生成
 的电极反应式为
的电极反应式为(5)“溶解”过程可提高溶解速率的措施有
(6)
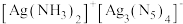 晶体的局部结构如图。
晶体的局部结构如图。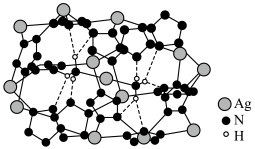
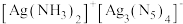 晶体中存在的微粒间作用力有
晶体中存在的微粒间作用力有A.离子键 B.
 键 C.
键 C. 键 D.金属键 E.氢键
键 D.金属键 E.氢键②晶体中
 的杂化轨道类型
的杂化轨道类型
更新时间:2024-05-24 21:34:48
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】氮是最重要的生命必需元素之一,与之相关的碱较多。部分碱在常温下的电离平衡常数如下表。
回答以下问题:
(1)常温下, 氨水的电离度为
氨水的电离度为_______ 。
(2)液氨能发生类似于水的自偶电离: ,基于此,液氨可以与亚硫酰氯(
,基于此,液氨可以与亚硫酰氯( )发生氨解反应生成
)发生氨解反应生成 ,则另一产物为
,则另一产物为_______ 。
(3)用化学用语表示羟胺溶液显碱性的原因_______ ,据此分析羟胺的 小于甲胺
小于甲胺 的原因
的原因_______ (从电负性、电子云密度角度作答)。
(4)常温时,浓度相同的① ②
②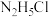 ③
③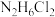 ④
④ ⑤
⑤ 溶液的pH由大到小的顺序是
溶液的pH由大到小的顺序是_______ (填序号)。
(5)用 的标准盐酸滴定
的标准盐酸滴定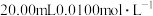 的
的 溶液,滴加标准盐酸的体积为V(mL)。下列说法正确的是
溶液,滴加标准盐酸的体积为V(mL)。下列说法正确的是
| 名称 | 氨 | 联氨 | 羟胺 | 甲胺 |
| 化学式 |  |  | 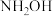 |  |
| 电离常数 |  | 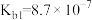 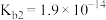 |  |  |
(1)常温下,
 氨水的电离度为
氨水的电离度为(2)液氨能发生类似于水的自偶电离:
 ,基于此,液氨可以与亚硫酰氯(
,基于此,液氨可以与亚硫酰氯( )发生氨解反应生成
)发生氨解反应生成 ,则另一产物为
,则另一产物为(3)用化学用语表示羟胺溶液显碱性的原因
 小于甲胺
小于甲胺 的原因
的原因(4)常温时,浓度相同的①
 ②
②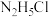 ③
③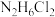 ④
④ ⑤
⑤ 溶液的pH由大到小的顺序是
溶液的pH由大到小的顺序是(5)用
 的标准盐酸滴定
的标准盐酸滴定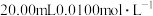 的
的 溶液,滴加标准盐酸的体积为V(mL)。下列说法正确的是
溶液,滴加标准盐酸的体积为V(mL)。下列说法正确的是A.当 时,反应的离子方程式为 时,反应的离子方程式为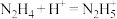 |
| B.滴定过程中,应选用酚酞作指示剂 |
C.当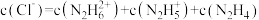 时,溶液呈中性 时,溶液呈中性 |
D.常温下,反应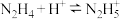 的平衡常数 的平衡常数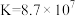 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】异丁烯为重要的化工原料,工业上可采用叔丁醇(TBA)气相脱水法制备高纯异丁烯产品,主要涉及以下反应:
反应1(主反应):
反应2(副反应):
(1)副反应产物 的系统命名为
的系统命名为___________ 。
(2)标准摩尔生成焓是指由稳态单质生成1mol该化合物的焓变,几种物质的标准生成焓如表,求反应1的
___________  。
。
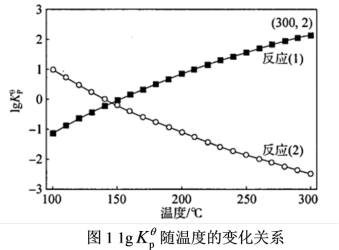
(3)根据,该脱水反应的标准平衡常数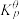 随温度的变化关系如图1所示,则反应2的
随温度的变化关系如图1所示,则反应2的
___________ 0(填“<”或“>”),向体积可变容器中充入1mol的叔丁醇,容器体积为1L,保持300℃100kPa条件,反应一段时间后达到平衡(忽略副反应),则
___________ (已知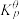 为以标准分压表示的平衡常数,各组分的标准分压
为以标准分压表示的平衡常数,各组分的标准分压 ,
,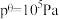 )。
)。
(4)理论计算反应条件对叔丁醇转化率的影响如图2、3所示,脱水反应温度 ℃时,N2/叔丁醇摩尔比对叔丁醇转化率有影响,试从平衡移动的角度分析充入N2的原因
℃时,N2/叔丁醇摩尔比对叔丁醇转化率有影响,试从平衡移动的角度分析充入N2的原因___________ 。根据图示该脱水反应适宜采用条件为 ℃,P=
℃,P=___________ MPa,N2/叔丁醇摩尔比=3/1。


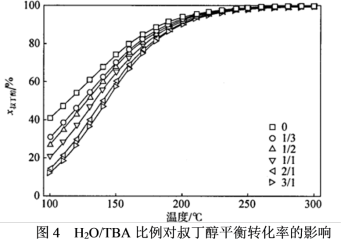
(5)已知工业原料叔丁醇中存在不同含量的水分,相同温度下不同初始原料中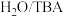 比例对叔丁醇平衡转化率的影响如图4所示,实际生产最佳工艺条件为
比例对叔丁醇平衡转化率的影响如图4所示,实际生产最佳工艺条件为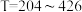 ℃,请从
℃,请从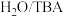 比例角度分析该条件下的优点
比例角度分析该条件下的优点___________ 。
反应1(主反应):

反应2(副反应):

(1)副反应产物
 的系统命名为
的系统命名为(2)标准摩尔生成焓是指由稳态单质生成1mol该化合物的焓变,几种物质的标准生成焓如表,求反应1的

 。
。| 组分 |  | 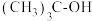 | 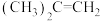 |
焓变/ | -241.83 | -339.21 | -17.1 |
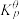 随温度的变化关系如图1所示,则反应2的
随温度的变化关系如图1所示,则反应2的

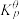 为以标准分压表示的平衡常数,各组分的标准分压
为以标准分压表示的平衡常数,各组分的标准分压 ,
,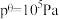 )。
)。
(4)理论计算反应条件对叔丁醇转化率的影响如图2、3所示,脱水反应温度
 ℃时,N2/叔丁醇摩尔比对叔丁醇转化率有影响,试从平衡移动的角度分析充入N2的原因
℃时,N2/叔丁醇摩尔比对叔丁醇转化率有影响,试从平衡移动的角度分析充入N2的原因 ℃,P=
℃,P=

(5)已知工业原料叔丁醇中存在不同含量的水分,相同温度下不同初始原料中
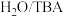 比例对叔丁醇平衡转化率的影响如图4所示,实际生产最佳工艺条件为
比例对叔丁醇平衡转化率的影响如图4所示,实际生产最佳工艺条件为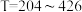 ℃,请从
℃,请从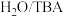 比例角度分析该条件下的优点
比例角度分析该条件下的优点
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】甲醇来源丰富、价格低廉,是一种重要的化工原料,有着重要的应用前景。
(1)工业上以CH4和H2O为原料,通过下列反应来制备甲醇:
I.CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.0kJ·mol-1
II.CO(g)+2H2(g)=CH3OH(g) △H=-129.0kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为______ 。
(2)若以CH4、CO和H2O(g)为原料制备甲醇,欲使原子利用率最高,则投料时n(CH4)∶n(CO)∶n(H2O)是_______ 。
(3)若在恒温恒容的容器内进行反应:CO(g)+2H2(g)⇌CH3OH(g),该反应平衡常数表达式为_______ 。一定条件下,可用来判断该反应达到平衡状态的标志有_____ 。(填字母)
A.CO百分含量保持不变
B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变
D.CO的生成速率与CH3OH的生成速率相等
(4)工业上利用甲醇部分氧化制备氢气。在一定温度和催化剂作用下,原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则在制备H2时发生的主要反应方程式为_______ (已知产物为两种气体);n(O2)/n(CH3OH)=0.25时,主要产物为_______ 。

(5)甲醇燃料电池结构如图所示。其工作时负极电极反应式可表示为:_______ 。

(1)工业上以CH4和H2O为原料,通过下列反应来制备甲醇:
I.CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.0kJ·mol-1
II.CO(g)+2H2(g)=CH3OH(g) △H=-129.0kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为
(2)若以CH4、CO和H2O(g)为原料制备甲醇,欲使原子利用率最高,则投料时n(CH4)∶n(CO)∶n(H2O)是
(3)若在恒温恒容的容器内进行反应:CO(g)+2H2(g)⇌CH3OH(g),该反应平衡常数表达式为
A.CO百分含量保持不变
B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变
D.CO的生成速率与CH3OH的生成速率相等
(4)工业上利用甲醇部分氧化制备氢气。在一定温度和催化剂作用下,原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则在制备H2时发生的主要反应方程式为

(5)甲醇燃料电池结构如图所示。其工作时负极电极反应式可表示为:

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】三氧化钨(WO3)常用于制备特种合金、防火材料和防腐涂层。现利用白钨精矿(含80%CaWO4及少量Fe、Zn和Mg等的氧化物)生产WO3,设计了如下工艺流程:

已知:①浸出液中钨(W)以[WO3C2O4H2O]2-形式存在。
②钨酸(H2WO4)难溶于水。
③Ksp(CaSO4)=4.9×10-5,Ksp(CaC2O4)=2.3×10-9;
Ka1(H2C2O4)=5.6×10-2,Ka2(H2C2O4)=1.6×10-4。
回答下列问题:
(1)“破碎”的目的是_______ ;“破碎”后的白钨精矿粒径约为50μm,往其中加入浸取液后形成的分散系属于_______ 。
(2)操作I的名称为_______ 。
(3)浸出液中含量最大的阳离子是_______ ;[WO3C2O4H2O]2-中W元素的化合价为_______ 。
(4)“加热”时发生反应的离子方程式为_______ ;“煅烧”时发生反应的化学方程式为_______ 。
(5)本工艺中能循环使用的物质是_______ 。
(6)通过计算说明“浸取”过程形成CaSO4而不能形成CaC2O4的原因:_______ 。

已知:①浸出液中钨(W)以[WO3C2O4H2O]2-形式存在。
②钨酸(H2WO4)难溶于水。
③Ksp(CaSO4)=4.9×10-5,Ksp(CaC2O4)=2.3×10-9;
Ka1(H2C2O4)=5.6×10-2,Ka2(H2C2O4)=1.6×10-4。
回答下列问题:
(1)“破碎”的目的是

(2)操作I的名称为
(3)浸出液中含量最大的阳离子是
(4)“加热”时发生反应的离子方程式为
(5)本工艺中能循环使用的物质是
(6)通过计算说明“浸取”过程形成CaSO4而不能形成CaC2O4的原因:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】氯化铈是冶炼稀土金属、稀土合金的重要原料。为节约和充分利用资源,以某废料(主要含 ,还含少量的
,还含少量的 )为原料,通过如图1所示工艺流程制备氯化铈。
)为原料,通过如图1所示工艺流程制备氯化铈。

已知:a、 具有强氧化性,通常情况下不和无机酸反应。
具有强氧化性,通常情况下不和无机酸反应。
b、常温下, ,
, 。
。
回答下列问题:
(1)为加快“酸浸1”的速率,可采取的措施是___________ (写一条即可)。
(2)“浸液A”中存在的金属阳离子为___________ (填离子符号),“浸渣A”的主要成分为___________ (填化学式),“浸渣B”的主要用途为___________ (写出一种)。
(3)“酸浸2”中 的浸出率与
的浸出率与 、温度的变化关系如图2所示,应选择的适宜条件是___________(填标号)。
、温度的变化关系如图2所示,应选择的适宜条件是___________(填标号)。

(4)“酸溶”过程中加入盐酸后,通常还需加入 ,其主要目的为
,其主要目的为___________ 。
(5)“沉铈2”过程中生成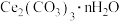 的离子方程式为
的离子方程式为___________ 。若 恰好沉淀完全
恰好沉淀完全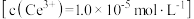 ,此时测得溶液的
,此时测得溶液的 ,则溶液中
,则溶液中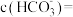
___________  。
。
 ,还含少量的
,还含少量的 )为原料,通过如图1所示工艺流程制备氯化铈。
)为原料,通过如图1所示工艺流程制备氯化铈。
已知:a、
 具有强氧化性,通常情况下不和无机酸反应。
具有强氧化性,通常情况下不和无机酸反应。b、常温下,
 ,
, 。
。回答下列问题:
(1)为加快“酸浸1”的速率,可采取的措施是
(2)“浸液A”中存在的金属阳离子为
(3)“酸浸2”中
 的浸出率与
的浸出率与 、温度的变化关系如图2所示,应选择的适宜条件是___________(填标号)。
、温度的变化关系如图2所示,应选择的适宜条件是___________(填标号)。
A. | B. | C. | D.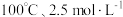 |
 ,其主要目的为
,其主要目的为(5)“沉铈2”过程中生成
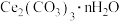 的离子方程式为
的离子方程式为 恰好沉淀完全
恰好沉淀完全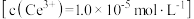 ,此时测得溶液的
,此时测得溶液的 ,则溶液中
,则溶液中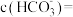
 。
。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】氟铈矿(含CeFCO3、BaO、SiO2等)是稀土元素最主要的来源,其中不仅含有丰富的稀土元素Ce(31.51%,以CeO2计),还含有大量的F资源(8.92%)和其他稀土资源(30.71%,用RE表示),其分离工艺流程如下:

已知:①氧化焙烧时,Ce元素转化成CeO2;
②酸浸后,Ce元素主要以Ce4+形式存在,其他稀土RE主要以RE3+形式存在;
③Ce4+能与F-结合成[CeF2]2+,Al3+能与F-结合成[AlFx]3-x,均易溶于水,难溶于有机溶剂,不能被P204萃取剂萃取。
回答下列问题:
(1)为了提高生产效率,焙烧时可以采取的操作___________ 。
(2)废渣的主要成分是___________ 。
(3)氧化焙烧时及萃取之前,均加入铝盐,其目的是___________ 。
(4)萃取Ce4+时,选用经典的酸性有机萃取剂P204(可用HA表示),萃取的过程可以表示成 ,通过将萃取后的有机相pH值调
,通过将萃取后的有机相pH值调___________ (填“高”或“低”)来将Ce4+从萃取剂中分离出来。
(5)将上述过程中获得Ce4+还原成Ce3+,再加入NH4HCO3溶液,即可获得稀土发光材料Ce2(CO3)3,但实际操作中,通常固体产品中含有少量Ce(OH)3,则当溶液Ce3+恰好完全沉淀时,即 ,
,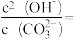
___________ ,为了使该条件下获得的固体产品中不含Ce(OH)3,应控制pH不超过___________ 。(已知常温下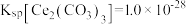 ,
,
(6)水相2中,n(Al):n(F)=1:4,请写出生成Na3AlF6沉淀的离子方程式___________ 。

已知:①氧化焙烧时,Ce元素转化成CeO2;
②酸浸后,Ce元素主要以Ce4+形式存在,其他稀土RE主要以RE3+形式存在;
③Ce4+能与F-结合成[CeF2]2+,Al3+能与F-结合成[AlFx]3-x,均易溶于水,难溶于有机溶剂,不能被P204萃取剂萃取。
回答下列问题:
(1)为了提高生产效率,焙烧时可以采取的操作
(2)废渣的主要成分是
(3)氧化焙烧时及萃取之前,均加入铝盐,其目的是
(4)萃取Ce4+时,选用经典的酸性有机萃取剂P204(可用HA表示),萃取的过程可以表示成
 ,通过将萃取后的有机相pH值调
,通过将萃取后的有机相pH值调(5)将上述过程中获得Ce4+还原成Ce3+,再加入NH4HCO3溶液,即可获得稀土发光材料Ce2(CO3)3,但实际操作中,通常固体产品中含有少量Ce(OH)3,则当溶液Ce3+恰好完全沉淀时,即
 ,
,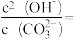
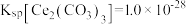 ,
,
(6)水相2中,n(Al):n(F)=1:4,请写出生成Na3AlF6沉淀的离子方程式
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】为应对全球石油资源口益紧缺。提高煤的利用效率,我国开发了煤制烃技术,并进入工业化试验阶段。
(1)煤气化制合成气(CO和H2):C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.3kJ/mol该反应在高温下能自发进行,理由是_____________ 。
(2)由合成气制甲醇:合成气CO和H2在一定条件下能发生如下反应:
主反应I.CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
反应II.CO(g)+H2(g) C(s)+H2O(g)
C(s)+H2O(g)
①在容积均为VL的甲、乙、丙三个密闭容器中分别充入amolCO和2 amolH2,三个容器的反应温度分别为T1、T2、T3(T1<T2<T3)且恒定不变,若只发生反应I,在其他条件相同的情况下,实验测得反应均进行到tmin时CO的体积分数如图所示,此时三个容器中一定处于化学平衡状态的是_____ (填“T1”、“T2”或“T3”):该温度下的化学平衡常数为_____ (用a、V表示)。

②为减弱副反应的发生,下列采取的措施合理的是______ 。
A.反应前加入少量的水蒸气 B.增压
C.降低反应温度 D.使用合适催化剂,提高甲醇的选择性
(3)由甲醇制烯烃
主反应:i.2CH3OH C2H4+2H2O
C2H4+2H2O
ii.3CH3OH C3H6+3H2O
C3H6+3H2O
副反应:iii.2CH3OH CH3OCH3+H2O
CH3OCH3+H2O
某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat.1和Cat.2),以恒定的流速通入CH3OH,在相同的压强下进行两种催化剂上甲醇制烯烃的对比研究。得到如图实验数据:(选择性:转化的甲醇中生成乙烯和丙烯的百分比)



下列说法不正确的是_________ 。
A.反应进行一段时间后甲醇的转化率减小,可能的原因是催化剂失活,工业生产中需定期更换催化剂
B.使用Cat.2反应2h后乙烯和内烯的选择性下降,可能的原因是生成副产物二甲醚
C.使用Cat.1产生的烯烃主要为丙烯,使用Cat.2产生的烯烃主要为乙烯
D.不管使用Cat.1还是使用Cat.2都能提高活化分子的百分数
(4)已知:2CrO42-+2H+ Cr2O72-+H2O。以铬酸钾为原料,电化学法备重铬酸钾的实验装置示意图如下
Cr2O72-+H2O。以铬酸钾为原料,电化学法备重铬酸钾的实验装置示意图如下
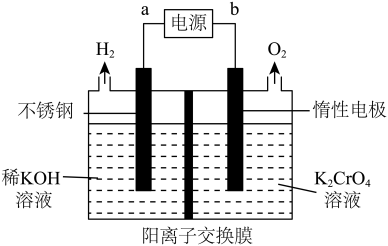
①a为电源的________ (填“正极”或“负极”)
②该制备过程总反应的化学方程式为_________ 。
(1)煤气化制合成气(CO和H2):C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.3kJ/mol该反应在高温下能自发进行,理由是
(2)由合成气制甲醇:合成气CO和H2在一定条件下能发生如下反应:
主反应I.CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)反应II.CO(g)+H2(g)
 C(s)+H2O(g)
C(s)+H2O(g)①在容积均为VL的甲、乙、丙三个密闭容器中分别充入amolCO和2 amolH2,三个容器的反应温度分别为T1、T2、T3(T1<T2<T3)且恒定不变,若只发生反应I,在其他条件相同的情况下,实验测得反应均进行到tmin时CO的体积分数如图所示,此时三个容器中一定处于化学平衡状态的是

②为减弱副反应的发生,下列采取的措施合理的是
A.反应前加入少量的水蒸气 B.增压
C.降低反应温度 D.使用合适催化剂,提高甲醇的选择性
(3)由甲醇制烯烃
主反应:i.2CH3OH
 C2H4+2H2O
C2H4+2H2O ii.3CH3OH
 C3H6+3H2O
C3H6+3H2O副反应:iii.2CH3OH
 CH3OCH3+H2O
CH3OCH3+H2O某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat.1和Cat.2),以恒定的流速通入CH3OH,在相同的压强下进行两种催化剂上甲醇制烯烃的对比研究。得到如图实验数据:(选择性:转化的甲醇中生成乙烯和丙烯的百分比)



下列说法不正确的是
A.反应进行一段时间后甲醇的转化率减小,可能的原因是催化剂失活,工业生产中需定期更换催化剂
B.使用Cat.2反应2h后乙烯和内烯的选择性下降,可能的原因是生成副产物二甲醚
C.使用Cat.1产生的烯烃主要为丙烯,使用Cat.2产生的烯烃主要为乙烯
D.不管使用Cat.1还是使用Cat.2都能提高活化分子的百分数
(4)已知:2CrO42-+2H+
 Cr2O72-+H2O。以铬酸钾为原料,电化学法备重铬酸钾的实验装置示意图如下
Cr2O72-+H2O。以铬酸钾为原料,电化学法备重铬酸钾的实验装置示意图如下
①a为电源的
②该制备过程总反应的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】含铬(Ⅵ)废水能诱发致癌,对人类和自然环境有严重的破坏作用。利用Cu2O光催化可以处理含有 的废水。
的废水。
Ⅰ.制取Cu2O
(1)电解法:利用铜和钛做电极,电解含有NaCl和NaOH的溶液时,反应只消耗了铜和水,体系pH及Cl﹣浓度维持不变(溶液体积变化忽略不计)。阳极电极反应式是_____ 。
(2)还原法:控制100℃、pH=5的条件时,利用亚硫酸钠与硫酸铜溶液反应可以制得Cu2O,同时产生SO2气体。反应过程中需要不断地加入烧碱,其原因是_____ 。
Ⅱ.利用Cu2O光催化处理含 的废水的研究。
的废水的研究。
(1)光照射到Cu2O光催化剂上产生光催化反应, 和H2O分别在光催化反应中形成的微电极上发生电极反应,反应原理如图1所示。写出
和H2O分别在光催化反应中形成的微电极上发生电极反应,反应原理如图1所示。写出 转化Cr3+的电极反应:
转化Cr3+的电极反应:_____ 。

(2)研究中对Cu2O的作用提出两种假设:
a.Cu2O作光催化剂;b.Cu2O与 发生氧化还原反应。
发生氧化还原反应。
已知:Cu2O的添加量是2×10﹣4mol/L, 的初始浓度是1×10﹣3mol/L;对比实验(pH=3.0且其他条件相同),反应1.5小时结果如图2所示。结合试剂用量数据和实验结果可得到的结论是
的初始浓度是1×10﹣3mol/L;对比实验(pH=3.0且其他条件相同),反应1.5小时结果如图2所示。结合试剂用量数据和实验结果可得到的结论是_____ ,依据是_____ 。
(3)溶液的pH对 降解率的影响如图3所示。
降解率的影响如图3所示。
已知:Cu2O Cu+CuSO4;酸性越大,
Cu+CuSO4;酸性越大, 被还原率越大。
被还原率越大。
①pH分别为2、3、4时, 的降解率最好的是
的降解率最好的是_____ ,其原因是_____ 。
②已知pH=5时,会产生Cr(OH)3沉淀。pH=5时, 的降解率低的原因是
的降解率低的原因是_____ 。
 的废水。
的废水。Ⅰ.制取Cu2O
(1)电解法:利用铜和钛做电极,电解含有NaCl和NaOH的溶液时,反应只消耗了铜和水,体系pH及Cl﹣浓度维持不变(溶液体积变化忽略不计)。阳极电极反应式是
(2)还原法:控制100℃、pH=5的条件时,利用亚硫酸钠与硫酸铜溶液反应可以制得Cu2O,同时产生SO2气体。反应过程中需要不断地加入烧碱,其原因是
Ⅱ.利用Cu2O光催化处理含
 的废水的研究。
的废水的研究。(1)光照射到Cu2O光催化剂上产生光催化反应,
 和H2O分别在光催化反应中形成的微电极上发生电极反应,反应原理如图1所示。写出
和H2O分别在光催化反应中形成的微电极上发生电极反应,反应原理如图1所示。写出 转化Cr3+的电极反应:
转化Cr3+的电极反应:
(2)研究中对Cu2O的作用提出两种假设:
a.Cu2O作光催化剂;b.Cu2O与
 发生氧化还原反应。
发生氧化还原反应。已知:Cu2O的添加量是2×10﹣4mol/L,
 的初始浓度是1×10﹣3mol/L;对比实验(pH=3.0且其他条件相同),反应1.5小时结果如图2所示。结合试剂用量数据和实验结果可得到的结论是
的初始浓度是1×10﹣3mol/L;对比实验(pH=3.0且其他条件相同),反应1.5小时结果如图2所示。结合试剂用量数据和实验结果可得到的结论是(3)溶液的pH对
 降解率的影响如图3所示。
降解率的影响如图3所示。已知:Cu2O
 Cu+CuSO4;酸性越大,
Cu+CuSO4;酸性越大, 被还原率越大。
被还原率越大。①pH分别为2、3、4时,
 的降解率最好的是
的降解率最好的是②已知pH=5时,会产生Cr(OH)3沉淀。pH=5时,
 的降解率低的原因是
的降解率低的原因是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺。工艺流程如右图: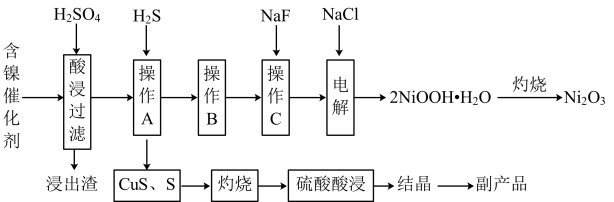
已知常温下:①有关氢氧化物开始沉淀和沉淀完全的pH如右表 ②Cu2O+2H+=Cu+Cu2++H2O③常温时,Ksp(CaF2)=2.7×10-11
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式___________________ 。
(2)浸出渣主要成分为CaSO4·2H2O和____________ 两种物质。
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤。请对该实验方案进行评价____________________ (若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)流程中的“副产品”为_____________ (填化学式)。在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L 0.6 mol·L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗____________ mol H2SO4。
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则溶液中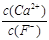 =
=____ 。
(6)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-,则阳极的电极反应式为____________________ ;
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。则该步反应的离子方程式为____________________________ 。

已知常温下:①有关氢氧化物开始沉淀和沉淀完全的pH如右表 ②Cu2O+2H+=Cu+Cu2++H2O③常温时,Ksp(CaF2)=2.7×10-11
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式
(2)浸出渣主要成分为CaSO4·2H2O和
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤。请对该实验方案进行评价
(4)流程中的“副产品”为
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则溶液中
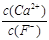 =
=(6)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-,则阳极的电极反应式为
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。则该步反应的离子方程式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐1】W、X、Y、Z(W、X、Y、Z分别代表元素符号)均为元素周期表中前四周期的元素,其原子序数依次增大,其中W、X、Y、Z为短周期元素,它们的单质在通常情况下均为无色气体。X元素的基态原子在同周期元素基态原子中含有的未成对电子数最多,Y元素的基态原子中s能级上的电子数等于p能级上的电子数,Z为金属元素,其基态原子是具有4s1结构的基态原子中质子数最多的原子,试回答下列问题:
(1)写出X的基态原子的价电子排布式_________________ ;
(2)比较X、Y两元素基态原子的第一电离能大小:X__________ Y(填“>”、“<”或“=”),理由是________ ;
(3)W、X两元素能写出一种常见气体M,每个M分子中含有10个电子,M分子中心原子的杂化方式为_________ ;WX两种元素还能写出一种常见阳离子N,每个N中也含有10个电子,但在N与M中所含化学键的键角大小不同,其原因是__________ ;
(4)Z2+可与M分子在谁溶液中形成[Z(M)4]2+,其中M分子和Z2+通过__________ -结合;
(5)单质Z的警报结构如图所示,已知两个最近的Z原子距离为a,Z的相对原子质量用Mr表示,则该晶体密度为_______________ (只列计算式)。
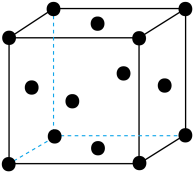
(1)写出X的基态原子的价电子排布式
(2)比较X、Y两元素基态原子的第一电离能大小:X
(3)W、X两元素能写出一种常见气体M,每个M分子中含有10个电子,M分子中心原子的杂化方式为
(4)Z2+可与M分子在谁溶液中形成[Z(M)4]2+,其中M分子和Z2+通过
(5)单质Z的警报结构如图所示,已知两个最近的Z原子距离为a,Z的相对原子质量用Mr表示,则该晶体密度为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】Ⅰ. 失水后可转为
失水后可转为 ,与
,与 可联合制备铁粉精(FexOy)和
可联合制备铁粉精(FexOy)和 。
。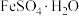 结构如图所示。
结构如图所示。

(1) 价层电子排布式为
价层电子排布式为_______ 。
(2)比较 和
和 分子中的键角大小并给出相应解释:
分子中的键角大小并给出相应解释:_______ 。
(3)晶体中 和
和 之间的作用分别为
之间的作用分别为_______ 。
Ⅱ.KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。
(4)已知KH2PO2是次磷酸的正盐,H3PO2的结构式为_______ ,其中P采取_______ 杂化方式。
(5)与PO 电子总数相同的等电子体(具有相同价电子数或电子数和相同原子数的分子或离子之间的互称)的分子式为
电子总数相同的等电子体(具有相同价电子数或电子数和相同原子数的分子或离子之间的互称)的分子式为_______ 。
(6)磷酸通过分子间脱水缩合形成多磷酸,如:

如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为_______ 。
(7)下图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷元素的曲线是_______ (填序号)。

 失水后可转为
失水后可转为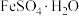 ,与
,与 可联合制备铁粉精(FexOy)和
可联合制备铁粉精(FexOy)和 。
。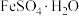 结构如图所示。
结构如图所示。
(1)
 价层电子排布式为
价层电子排布式为(2)比较
 和
和 分子中的键角大小并给出相应解释:
分子中的键角大小并给出相应解释:(3)晶体中
 和
和 之间的作用分别为
之间的作用分别为Ⅱ.KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。
(4)已知KH2PO2是次磷酸的正盐,H3PO2的结构式为
(5)与PO
 电子总数相同的等电子体(具有相同价电子数或电子数和相同原子数的分子或离子之间的互称)的分子式为
电子总数相同的等电子体(具有相同价电子数或电子数和相同原子数的分子或离子之间的互称)的分子式为(6)磷酸通过分子间脱水缩合形成多磷酸,如:

如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为
(7)下图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷元素的曲线是

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】物质结构具有极强的几何美感,微粒间存在不同的作用力,从不同的堆积方式到五彩斑斓的晶体结构,我们感叹于大自然神奇的力量的同时创造着新物质,让生活变得更美好!
(1)-40℃时, 与冰反应生成HOF和HF。常温常压下,HOF为无色气体,固态HOF的晶体类型为
与冰反应生成HOF和HF。常温常压下,HOF为无色气体,固态HOF的晶体类型为_______ ,HOF水解反应的产物为_______ 。(填化学式)。
(2) 中心原子为Cl,
中心原子为Cl, 中心原子为O,二者均为V形结构,但
中心原子为O,二者均为V形结构,但 中存在大
中存在大 键(
键( )。
)。 中Cl原子的轨道杂化方式
中Cl原子的轨道杂化方式_______ ;基态Cl原子中电子占据最高能级的电子云轮廓为_______ ;O―Cl―O键角_______ Cl―O―Cl键角(填“>”“<”或“=”)。比较 与
与 中Cl―O键的键长并说明原因
中Cl―O键的键长并说明原因_______ 。
(3)几种化学键的键能如下表所示:
由两种单质化合形成1mol ,焓变
,焓变
_______  。
。
(4)已知: 常温常压下为无色气体,熔点―129℃,沸点―207℃,
常温常压下为无色气体,熔点―129℃,沸点―207℃, 为黄色油状液体,熔点―40℃,沸点70℃,95℃以上易爆炸。根据物质结构知识和题中信息解释以下问题:
为黄色油状液体,熔点―40℃,沸点70℃,95℃以上易爆炸。根据物质结构知识和题中信息解释以下问题:
① 热稳定性高于
热稳定性高于 :
:_______ 。
② 熔、沸点高于
熔、沸点高于 :
:_______ 。
(5)过渡金属易与CO形成羰基配合物,如配合物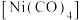 ,常温下为液态,易溶于
,常温下为液态,易溶于 、苯等有机溶剂。
、苯等有机溶剂。
①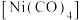 固态时属于
固态时属于_______ 分子(填极性或非极性)。
②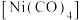 中Ni与CO的
中Ni与CO的_______ 原子形成配位键。
③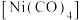 分子中
分子中 键和
键和 键个数比为
键个数比为_______ 。
(6) 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。基态
反应制得。基态 的电子占据的最高能级符号为
的电子占据的最高能级符号为_______ ,该能级具有的原子轨道数为_______ , 的立体结构是
的立体结构是_______ 。
(7)某Ba-Ti-O晶体具有良好的电学性能,其晶胞为立方晶胞(如图)晶胞边长为a pm。设阿伏加德罗常数的值为 ,下列说法错误的是_______。
,下列说法错误的是_______。

(8)基态 原子的价层电子轨道表示式:
原子的价层电子轨道表示式:_______ 。
(9)硝酸乙基铵 是人类发现的第一种常温离子液体,其熔点为12℃,已知
是人类发现的第一种常温离子液体,其熔点为12℃,已知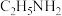 结合质子的能力比
结合质子的能力比 略强,下列有关硝酸乙基铵的说法正确的是_______。
略强,下列有关硝酸乙基铵的说法正确的是_______。
(1)-40℃时,
 与冰反应生成HOF和HF。常温常压下,HOF为无色气体,固态HOF的晶体类型为
与冰反应生成HOF和HF。常温常压下,HOF为无色气体,固态HOF的晶体类型为(2)
 中心原子为Cl,
中心原子为Cl, 中心原子为O,二者均为V形结构,但
中心原子为O,二者均为V形结构,但 中存在大
中存在大 键(
键( )。
)。 中Cl原子的轨道杂化方式
中Cl原子的轨道杂化方式 与
与 中Cl―O键的键长并说明原因
中Cl―O键的键长并说明原因(3)几种化学键的键能如下表所示:
| 化学键 | N≡N | F―F | N―F |
键能 | 941.6 | 154.8 | 283.0 |
 ,焓变
,焓变
 。
。(4)已知:
 常温常压下为无色气体,熔点―129℃,沸点―207℃,
常温常压下为无色气体,熔点―129℃,沸点―207℃, 为黄色油状液体,熔点―40℃,沸点70℃,95℃以上易爆炸。根据物质结构知识和题中信息解释以下问题:
为黄色油状液体,熔点―40℃,沸点70℃,95℃以上易爆炸。根据物质结构知识和题中信息解释以下问题:①
 热稳定性高于
热稳定性高于 :
:②
 熔、沸点高于
熔、沸点高于 :
:(5)过渡金属易与CO形成羰基配合物,如配合物
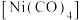 ,常温下为液态,易溶于
,常温下为液态,易溶于 、苯等有机溶剂。
、苯等有机溶剂。①
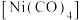 固态时属于
固态时属于②
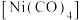 中Ni与CO的
中Ni与CO的③
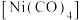 分子中
分子中 键和
键和 键个数比为
键个数比为(6)
 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。基态
反应制得。基态 的电子占据的最高能级符号为
的电子占据的最高能级符号为 的立体结构是
的立体结构是(7)某Ba-Ti-O晶体具有良好的电学性能,其晶胞为立方晶胞(如图)晶胞边长为a pm。设阿伏加德罗常数的值为
 ,下列说法错误的是_______。
,下列说法错误的是_______。
A.化学式为 | B. 和 和 间的最短距离为 间的最短距离为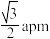 |
C.该晶胞中与 等距离且最近的 等距离且最近的 有4个 有4个 | D.晶体的密度为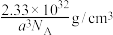 |
(8)基态
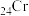 原子的价层电子轨道表示式:
原子的价层电子轨道表示式:(9)硝酸乙基铵
 是人类发现的第一种常温离子液体,其熔点为12℃,已知
是人类发现的第一种常温离子液体,其熔点为12℃,已知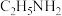 结合质子的能力比
结合质子的能力比 略强,下列有关硝酸乙基铵的说法正确的是_______。
略强,下列有关硝酸乙基铵的说法正确的是_______。| A.该离子液体不易挥发,可用作绿色溶剂 |
| B.该物质在常温下不能导电 |
| C.该离子液体阴阳离子体积很大,结构松散,作用力弱 |
| D.同温同物质的量浓度的硝酸乙基铵溶液和硝酸铵溶液相比前者的pH小 |
您最近一年使用:0次



