1 . 下列实验中的颜色变化与氧化还原反应有关的是
A. 通入品红溶液中,溶液由红色变为无色 通入品红溶液中,溶液由红色变为无色 |
| B.苯酚长时间放置在空气中,晶体由无色变为粉红色 |
| C.KI溶液滴入AgCl浊液中,沉淀由白色变为黄色 |
D.稀硫酸滴入 溶液中,溶液由黄色变为橙色 溶液中,溶液由黄色变为橙色 |
您最近一年使用:0次
名校
2 . 二氧化铈( )是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含
)是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含 、
、 、
、 等)为原料制备
等)为原料制备 ,其工艺流程如图所示:
,其工艺流程如图所示:
(1)“焙烧”时,通入空气的主要目的是_________________ 。
(2)滤渣的主要成分是___________________ (填化学式)。
(3)“还原、脱氟”时,先加入硫脲(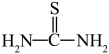 ),目的是将溶液中的
),目的是将溶液中的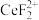 还原为
还原为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_________________ [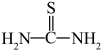 被氧化为
被氧化为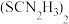 ,生成物还有HF和
,生成物还有HF和 ]。
]。
(4)“沉铈”时反应的离子方程式为__________________ 。若用 溶液代替
溶液代替 溶液,产生的后果是
溶液,产生的后果是________________ 。
(5)若常温下,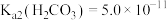 ,
,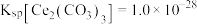 ,
, 恰好沉淀完全
恰好沉淀完全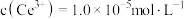 ,此时测得溶液的
,此时测得溶液的 ,则溶液中
,则溶液中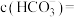
_____________  。
。
(6)二氧化铈作为一种SCR脱硝催化剂,能在 和
和 之间改变氧化状态,将
之间改变氧化状态,将 氧化为
氧化为 ,并引起氧空位的形成,得到新的铈氧化物
,并引起氧空位的形成,得到新的铈氧化物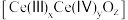 。铈氧化物发生的可能变化如图所示。当
。铈氧化物发生的可能变化如图所示。当
 氧化标准状况下
氧化标准状况下 NO后,生成新的铈氧化物中x、y、z的最简整数比为
NO后,生成新的铈氧化物中x、y、z的最简整数比为____________ 。
 )是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含
)是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含 、
、 、
、 等)为原料制备
等)为原料制备 ,其工艺流程如图所示:
,其工艺流程如图所示: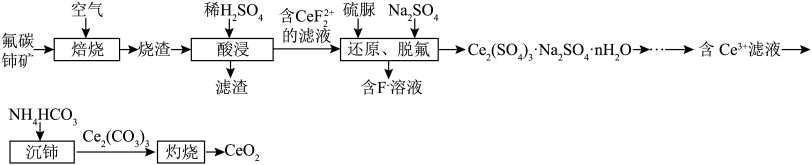
(1)“焙烧”时,通入空气的主要目的是
(2)滤渣的主要成分是
(3)“还原、脱氟”时,先加入硫脲(
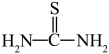 ),目的是将溶液中的
),目的是将溶液中的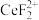 还原为
还原为 ,写出该反应的离子方程式:
,写出该反应的离子方程式: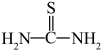 被氧化为
被氧化为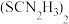 ,生成物还有HF和
,生成物还有HF和 ]。
]。(4)“沉铈”时反应的离子方程式为
 溶液代替
溶液代替 溶液,产生的后果是
溶液,产生的后果是(5)若常温下,
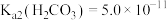 ,
,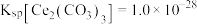 ,
, 恰好沉淀完全
恰好沉淀完全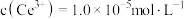 ,此时测得溶液的
,此时测得溶液的 ,则溶液中
,则溶液中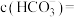
 。
。(6)二氧化铈作为一种SCR脱硝催化剂,能在
 和
和 之间改变氧化状态,将
之间改变氧化状态,将 氧化为
氧化为 ,并引起氧空位的形成,得到新的铈氧化物
,并引起氧空位的形成,得到新的铈氧化物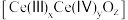 。铈氧化物发生的可能变化如图所示。当
。铈氧化物发生的可能变化如图所示。当
 氧化标准状况下
氧化标准状况下 NO后,生成新的铈氧化物中x、y、z的最简整数比为
NO后,生成新的铈氧化物中x、y、z的最简整数比为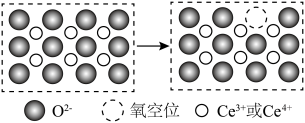
您最近一年使用:0次
昨日更新
|
63次组卷
|
3卷引用:2024届河南省信阳市高三下学期高考考前押题理科综合试卷-高中化学
解题方法
3 . 某电镀污泥中含有较多的 、
、 、
、 、
、 、
、 ,从中回收相应金属的流程如下。
,从中回收相应金属的流程如下。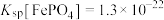 、
、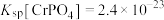 ;
;
② 、
、 以氢氧化物形式开始沉淀与刚好完全沉淀时的
以氢氧化物形式开始沉淀与刚好完全沉淀时的 如表所示:
如表所示:
回答下列问题:
(1)萃取剂 应具有难溶于水、
应具有难溶于水、___________ 的性质,萃取原理可表示为 ,实验表明,当溶液的
,实验表明,当溶液的 时,
时, 的萃取率会显著降低,其原因是
的萃取率会显著降低,其原因是___________ 。
(2)用离子方程式表示加入 的目的是
的目的是___________ ,若“沉铬”结束时溶液中 ,则溶液中
,则溶液中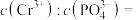
___________ 。
(3)“氧化”时,试剂 为氧化剂,试写出两种不会引入新杂质的
为氧化剂,试写出两种不会引入新杂质的 试剂:
试剂:___________ ;“调 ”时,
”时, 的调控范围是
的调控范围是___________ 。
(4)“沉锌”时不宜用 溶液,其原因是
溶液,其原因是___________ (任答一点),“操作 ”为
”为___________ 、洗涤、烘干。
(5)已知 的晶胞如图所示,若晶胞参数为
的晶胞如图所示,若晶胞参数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为___________  。
。
 、
、 、
、 、
、 、
、 ,从中回收相应金属的流程如下。
,从中回收相应金属的流程如下。
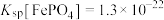 、
、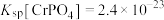 ;
;②
 、
、 以氢氧化物形式开始沉淀与刚好完全沉淀时的
以氢氧化物形式开始沉淀与刚好完全沉淀时的 如表所示:
如表所示:| 金属离子 |  |  |
开始沉淀的 | 1.4 | 5.5 |
刚好完全沉淀的 | 3.0 | 8.0 |
(1)萃取剂
 应具有难溶于水、
应具有难溶于水、 ,实验表明,当溶液的
,实验表明,当溶液的 时,
时, 的萃取率会显著降低,其原因是
的萃取率会显著降低,其原因是(2)用离子方程式表示加入
 的目的是
的目的是 ,则溶液中
,则溶液中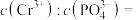
(3)“氧化”时,试剂
 为氧化剂,试写出两种不会引入新杂质的
为氧化剂,试写出两种不会引入新杂质的 试剂:
试剂: ”时,
”时, 的调控范围是
的调控范围是(4)“沉锌”时不宜用
 溶液,其原因是
溶液,其原因是 ”为
”为(5)已知
 的晶胞如图所示,若晶胞参数为
的晶胞如图所示,若晶胞参数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为 。
。
您最近一年使用:0次
4 . 根据下列实验操作和现象所得出的结论错误的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向5 mL浓度均为0.10 mol·L 的KCl和KI混合溶液中滴加几滴 的KCl和KI混合溶液中滴加几滴 溶液,产生黄色沉淀 溶液,产生黄色沉淀 | 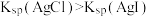 |
| B | 向 溶液中加入过量的KI溶液,充分反应后,再滴入几滴KSCN溶液,溶液变红 溶液中加入过量的KI溶液,充分反应后,再滴入几滴KSCN溶液,溶液变红 |  与KI的反应为可逆反应 与KI的反应为可逆反应 |
| C | 向新制氯水中滴加几滴紫色石蕊溶液,溶液先变红后褪色 | 新制氯水显酸性且具有漂白性 |
| D | 向盛有2 mL新制的银氨溶液的试管中加入1 mL 10%葡萄糖溶液,振荡后将试管放在热水浴中温热,试管壁上出现银镜 | 葡萄糖具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
昨日更新
|
36次组卷
|
2卷引用:2024届河南省名校联盟高三下学期5月联考(三模)理综试题-高中化学
名校
解题方法
5 . 下列离子方程式书写错误的是
A.向硫化钠溶液中通入足量二氧化硫: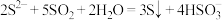 |
B.已知酸性: ,将少量 ,将少量 通入 通入 溶液中: 溶液中: |
C.用盐酸处理铜器表面的铜锈: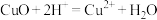 |
D.利用 与 与 制备 制备 沉淀: 沉淀: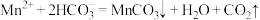 |
您最近一年使用:0次
7日内更新
|
248次组卷
|
3卷引用:2024届河南省郑州外国语学校高三下学期最后一卷理科综合试题-高中化学
名校
6 . 已知常温下水溶液中 、
、 、
、 、
、 、
、 的分布分数
的分布分数 如[如
如[如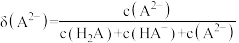 ]随
]随 变化曲线如图1所示,溶液中
变化曲线如图1所示,溶液中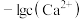 和
和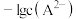 关系如图2所示,用
关系如图2所示,用 的
的 溶液滴定
溶液滴定
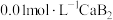 溶液,下列说法错误的是
溶液,下列说法错误的是
 、
、 、
、 、
、 、
、 的分布分数
的分布分数 如[如
如[如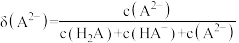 ]随
]随 变化曲线如图1所示,溶液中
变化曲线如图1所示,溶液中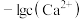 和
和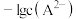 关系如图2所示,用
关系如图2所示,用 的
的 溶液滴定
溶液滴定
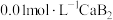 溶液,下列说法错误的是
溶液,下列说法错误的是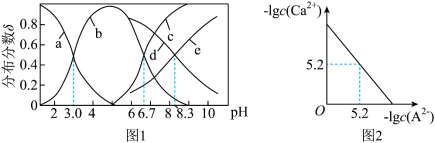
A.曲线b表示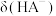 |
B. 溶液中存在: 溶液中存在: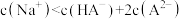 |
C.反应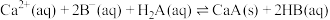 的平衡常数 的平衡常数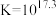 |
D.滴定过程中始终存在: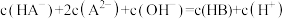 |
您最近一年使用:0次
7日内更新
|
60次组卷
|
2卷引用:2024届河南省信阳市高三下学期高考考前押题理科综合试卷-高中化学
名校
解题方法
7 . 锑白 是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为
是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为 ,含少量的
,含少量的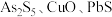 和
和 等)提取锑白的工艺流程如图所示:
等)提取锑白的工艺流程如图所示: ;
;
②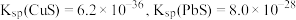 。
。
回答下列问题:
(1)“粉碎”辉锑矿的目的是___________ 。
(2)“滤渣Ⅰ”的主要成分除不溶性杂质外还有S、___________ (填化学式); 在“浸取”时发生反应的离子方程式为
在“浸取”时发生反应的离子方程式为___________ 。
(3)“除砷”时,反应中氧化剂与还原剂的物质的量之比为___________ (P转化为最高价态)。
(4)若浸取液中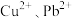 的浓度均为
的浓度均为 ,则c(S2-)≥
,则c(S2-)≥___________  才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时
才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时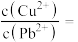
___________ 。
(5)“中和脱氯”时脱氯率与反应温度的关系如图所示:___________ 。
(6)锑可用于制备超亮光电极材料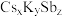 ,其晶胞结构如图所示,晶体a的化学式为
,其晶胞结构如图所示,晶体a的化学式为___________ ,晶体b中与 距离最近的
距离最近的 的个数为
的个数为___________ 。
 是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为
是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为 ,含少量的
,含少量的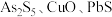 和
和 等)提取锑白的工艺流程如图所示:
等)提取锑白的工艺流程如图所示: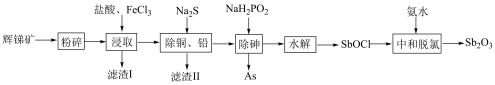
 ;
;②
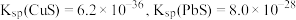 。
。回答下列问题:
(1)“粉碎”辉锑矿的目的是
(2)“滤渣Ⅰ”的主要成分除不溶性杂质外还有S、
 在“浸取”时发生反应的离子方程式为
在“浸取”时发生反应的离子方程式为(3)“除砷”时,反应中氧化剂与还原剂的物质的量之比为
(4)若浸取液中
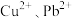 的浓度均为
的浓度均为 ,则c(S2-)≥
,则c(S2-)≥ 才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时
才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时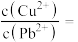
(5)“中和脱氯”时脱氯率与反应温度的关系如图所示:
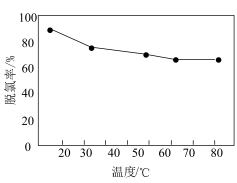
(6)锑可用于制备超亮光电极材料
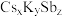 ,其晶胞结构如图所示,晶体a的化学式为
,其晶胞结构如图所示,晶体a的化学式为 距离最近的
距离最近的 的个数为
的个数为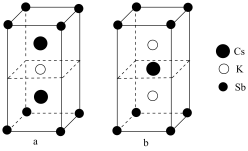
您最近一年使用:0次
8 . 298K时,用NaOH溶液分别滴定等物质的量浓度的HR、 、
、 三种溶液。pM[p表示负对数,M表示
三种溶液。pM[p表示负对数,M表示 、
、 、
、 ]随溶液pH变化的关系如图所示。
]随溶液pH变化的关系如图所示。 ,当离子浓度
,当离子浓度 时,该离子完全沉淀。
时,该离子完全沉淀。
下列推断正确的是
 、
、 三种溶液。pM[p表示负对数,M表示
三种溶液。pM[p表示负对数,M表示 、
、 、
、 ]随溶液pH变化的关系如图所示。
]随溶液pH变化的关系如图所示。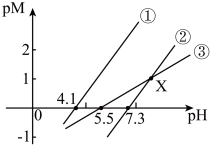
 ,当离子浓度
,当离子浓度 时,该离子完全沉淀。
时,该离子完全沉淀。下列推断正确的是
A.①代表滴定 溶液的变化关系 溶液的变化关系 |
B.调节pH=5时,溶液中 完全沉淀 完全沉淀 |
C.滴定HR溶液至X点时,溶液中: |
D.经计算, 能完全溶于HR溶液 能完全溶于HR溶液 |
您最近一年使用:0次
7日内更新
|
217次组卷
|
4卷引用:2024届河南省五市高三下学期二模理综试题-高中化学
2024届河南省五市高三下学期二模理综试题-高中化学(已下线)T13-溶液中的离子平衡(已下线)湖南师大附中2024届高三下学期第三次模拟考试化学试题2024届四川省成都市第七中学高三下学期5月模拟考试理科综合试题-高中化学
9 . 室温下,在含 、
、 和
和 的溶液中滴加
的溶液中滴加 溶液,混合液中pX[
溶液,混合液中pX[ ,X代表
,X代表 ,
, 、
、 ]和
]和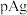 [
[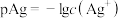 ]的关系如图所示。已知:
]的关系如图所示。已知: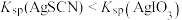 。下列叙述正确的是
。下列叙述正确的是
 、
、 和
和 的溶液中滴加
的溶液中滴加 溶液,混合液中pX[
溶液,混合液中pX[ ,X代表
,X代表 ,
, 、
、 ]和
]和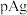 [
[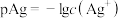 ]的关系如图所示。已知:
]的关系如图所示。已知: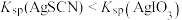 。下列叙述正确的是
。下列叙述正确的是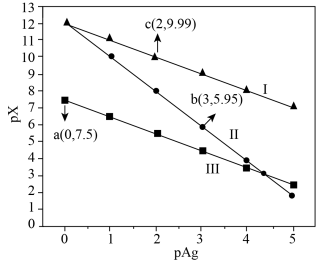
A.直线II代表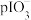 和pAg的关系 和pAg的关系 |
B. |
C.室温下, 的饱和溶液的物质的量浓度比AgSCN大 的饱和溶液的物质的量浓度比AgSCN大 |
D. 的平衡常数K为 的平衡常数K为 |
您最近一年使用:0次
7日内更新
|
148次组卷
|
3卷引用:2024届河南省周口市西华县第一高级中学高三下学期信息卷第四练理综试题-高中化学
名校
10 .  是一种重要的工业化学品。某研究小组利用如图所示装置制备
是一种重要的工业化学品。某研究小组利用如图所示装置制备 ,并进行相关探究。
,并进行相关探究。
(1)装置A中发生反应的化学方程式为___________ 。
(2)装置B的作用为___________ ;干燥管中的试剂为___________ (任写一种)。
【查阅资料】Ⅰ.常温下镁和水反应现象不明显,镁和水反应会在镁条表面形成致密的 膜,阻碍反应进一步发生;
膜,阻碍反应进一步发生;
Ⅱ.镁与饱和 溶液剧烈反应产生大量气体和白色沉淀;
溶液剧烈反应产生大量气体和白色沉淀;
Ⅲ. 质地紧密,
质地紧密, 质地疏松,该实验条件下,
质地疏松,该实验条件下, 对
对 膜没有作用。
膜没有作用。
【预测】 溶液中的某种组分破坏了
溶液中的某种组分破坏了 与
与 反应生成的
反应生成的 膜。
膜。
【实验设计】用砂纸擦去镁条表面氧化膜,取表面积和质量相同的镁条(2cm)进行实验,测量产生气泡的速率。
(3)测得实验结果 ,得出结论:
,得出结论:___________ ;请结合必要的文字和化学用语解释得出该结论的原因为___________ 。
(4)另一同学经查阅资料发现 也能破坏
也能破坏 膜,于是进行如下探究:
膜,于是进行如下探究:
测得实验结果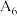
___________ 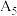 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(5)观察实验4和5发现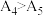 ,请解释其原因
,请解释其原因___________ 。
(6)加热 可以得到纯碱,写出纯碱在生产或生活中的一种应用:
可以得到纯碱,写出纯碱在生产或生活中的一种应用:___________ 。
 是一种重要的工业化学品。某研究小组利用如图所示装置制备
是一种重要的工业化学品。某研究小组利用如图所示装置制备 ,并进行相关探究。
,并进行相关探究。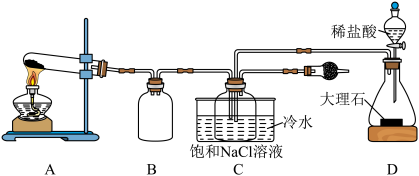
(1)装置A中发生反应的化学方程式为
(2)装置B的作用为
【查阅资料】Ⅰ.常温下镁和水反应现象不明显,镁和水反应会在镁条表面形成致密的
 膜,阻碍反应进一步发生;
膜,阻碍反应进一步发生;Ⅱ.镁与饱和
 溶液剧烈反应产生大量气体和白色沉淀;
溶液剧烈反应产生大量气体和白色沉淀;Ⅲ.
 质地紧密,
质地紧密, 质地疏松,该实验条件下,
质地疏松,该实验条件下, 对
对 膜没有作用。
膜没有作用。【预测】
 溶液中的某种组分破坏了
溶液中的某种组分破坏了 与
与 反应生成的
反应生成的 膜。
膜。【实验设计】用砂纸擦去镁条表面氧化膜,取表面积和质量相同的镁条(2cm)进行实验,测量产生气泡的速率。
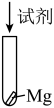
| 实验序号 | 实验装置 | 添加试剂及用量 | 产生气泡速率(mL/min) |
| 1 |
| 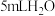 |  |
| 2 | 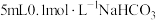 |  | |
| 3 | 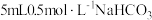 |  | |
| 4 | 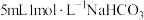 |  |
(3)测得实验结果
 ,得出结论:
,得出结论:(4)另一同学经查阅资料发现
 也能破坏
也能破坏 膜,于是进行如下探究:
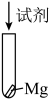
膜,于是进行如下探究:| 实验序号 | 实验装置 | 添加试剂及用量 | 产生气泡速率(mL/min) |
| 5 |
| 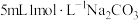 | 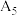 |
| 6 | 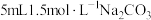 | 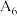 |
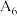
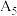 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(5)观察实验4和5发现
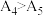 ,请解释其原因
,请解释其原因(6)加热
 可以得到纯碱,写出纯碱在生产或生活中的一种应用:
可以得到纯碱,写出纯碱在生产或生活中的一种应用:
您最近一年使用:0次