名校
解题方法
1 . 已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:________________ 。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:_______________ 。
(3)“调pH”时pH的调控范围为_____________ ,试用化学反应原理的相关知识解释滤渣Ⅱ的生成:______________________________________________________ 。
(4)写出“沉镍”时发生反应的离子方程式:__________________________________ ,证明Ni2+已经沉淀完全的实验步骤及现象是___________________________________ ,当Ca2+沉淀完全时,溶液中c(F-)>____________ mol·L-1(写出计算式即可)。
(5)操作a的内容是_________________________________________________________ 。

已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:
(3)“调pH”时pH的调控范围为
(4)写出“沉镍”时发生反应的离子方程式:
(5)操作a的内容是
您最近一年使用:0次
2017-10-16更新
|
162次组卷
|
3卷引用:福建省莆田第一中学2018届高三第三次月考理科综合化学试题
2 . 自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是
| A.相同温度下,CuS的溶解度大于PbS的溶解度 |
| B.原生铜的硫化物具有还原性,而铜蓝没有还原性 |
C.CuSO4与ZnS反应的离子方程式是  CuS↓ CuS↓ |
| D.整个过程涉及的反应类型有氧化还原反应和复分解反应 |
您最近一年使用:0次
2019-01-30更新
|
2478次组卷
|
29卷引用:2013届福建安溪一中、养正中学高三上学期期中联考化学试卷
(已下线)2013届福建安溪一中、养正中学高三上学期期中联考化学试卷2010年北京普通高等学校招生全国统一考试理科综合能力测试化学(已下线)2010—2011学年云南省昆明三中高二下学期期末考试化学试卷(已下线)2012届河南省郑州市智林学校高三上学期10月份月考化学试卷(已下线)2011-2012年湖南株洲市南方中学高二上学期期末考试理科化学试卷(已下线)2011-2012学年浙江省余姚中学高二下学期期中考试化学试卷2014-2015山东省临沭二中高二1月月考化学试卷2016届天津一中高三零月考化学试卷上海市南洋模范中学2017届高三上学期期中考试化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二12月月考化学试题(B卷)内蒙古巴彦淖尔市第一中学2017-2018学年高二12月月考化学试题(A卷)广东省中山市第一中学2017-2018学年高二上学期第三次统测化学试题甘肃省天水市第一中学2017-2018学年高二下学期入学考试化学试题河北省衡水市安平县安平中学2018-2019学年高二(实验部)上学期第一次月考化学试题【全国百强校】河北省石家庄市辛集中学2019届高三上学期12月月考化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——难溶电解质的沉淀溶解平衡(强化练习)高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 课时1 溶解平衡及其应用人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 教材帮课时1 沉淀溶解平衡及其应用河北正定中学2020-2021学年高二上学期第三次月考化学试题(已下线)专题3.4.2 沉淀溶解平衡的应用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)3.4.2 沉淀溶解平衡原理的应用-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)3.4.2 沉淀溶解平衡的应用(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)云南省澄江市第一中学2021-2022年高二下学期3月月考化学试题(已下线)第22讲 沉淀溶解平衡的应用(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)上海师范大学附属中学2022-2023学年高三上学期期中考试化学试题作业(二十一) 沉淀溶解平衡与溶度积黑龙江省哈尔滨市宾县第二中学2022-2023学年高二上学期期中考试化学试题陕西省宝鸡市金台区2023-2024学年高二上学期期中考试化学试题
名校
3 . 下列说法正确的是
| A.氢氧燃料电池工作时,O2在负极上得到电子 |
| B.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中c (Cl—) / c (Br—)不变 |
| C.0.1mol·L-1Na2CO3溶液加热后,溶液的碱性减小 |
| D.室温下,稀释0.1mol·L-1CH3COOH溶液,溶液的导电能力增强 |
您最近一年使用:0次
2017-09-07更新
|
352次组卷
|
2卷引用:福建省福州市第八中学2016-2017学年高二下学期期末考试(理)化学试题
4 . 一定温度下,在Ba(OH)2的悬浊液中,存在Ba(OH)2固体与其电离的离子间的溶解平衡关系:Ba(OH)2(s) Ba2+(aq)+2OH-(aq),向此体系中再加入少量的BaO粉末,如果保持温度不变,则下列说法正确的是
Ba2+(aq)+2OH-(aq),向此体系中再加入少量的BaO粉末,如果保持温度不变,则下列说法正确的是
 Ba2+(aq)+2OH-(aq),向此体系中再加入少量的BaO粉末,如果保持温度不变,则下列说法正确的是
Ba2+(aq)+2OH-(aq),向此体系中再加入少量的BaO粉末,如果保持温度不变,则下列说法正确的是| A.c(Ba2+)增大 |
| B.溶液中Ba2+数目减少 |
| C.溶液pH减小 |
| D.溶液质量增大 |
您最近一年使用:0次
名校
5 . 下列离子方程式书写正确的是
| A.用FeS除工业废水中Cu2+:Cu2+(aq)+FeS(s)═Fe2+(aq) +CuS(s) |
B.用惰性电极电解饱和MgCl2溶液:2Cl﹣+2H2O Cl2↑+H2↑+2OH﹣ Cl2↑+H2↑+2OH﹣ |
| C.FeBr2溶液中通入过量Cl2:2Fe2++2Br﹣+2Cl2═2Fe3++Br2+4Cl﹣ |
D.向Na[Al(OH)4]溶液中滴加NaHCO3溶液:[Al(OH)4]-+ HCO ═Al(OH)3↓+ CO2↑+ H20 ═Al(OH)3↓+ CO2↑+ H20 |
您最近一年使用:0次
2017-09-06更新
|
132次组卷
|
2卷引用:福建省宁化第一中学2021-2022学年高三上学期第二次阶段考试化学试题
名校
6 . 分别进行下列操作,由现象得出的结论正确的是
选项 | 操作 | 现象 | 结论 |
A | 向某一溶液中滴加Ba(NO3)2和HNO3混合溶液 | 生成白色沉淀 | 原溶液中有SO42- |
B | 向盛有2mL0.1mol/LAgNO3溶液的试管中滴加1mL0.1mol/ LNaCl溶液,再向其中滴加4~5滴0.1mol/LKI溶液 | 先有白色沉淀成,后又产生黄色沉淀 | Ksp(AgCl)> Ksp(AgI) |
C | 室温下,取相同大小、形状和质量的Cu粒分别投入0.1mol/L的稀硝酸和10.0mol/L的浓硝酸中 | Cu粒与浓硝酸反应比与稀硝酸反应剧烈 | 探究浓度对化学反应速率的影响 |
D | 向某一溶液中滴加稀盐酸,将生成的气体通入澄清石灰水中 | 澄清石灰水变浑浊 | 生成的气体可能是SO2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2017-05-24更新
|
498次组卷
|
2卷引用:福建省厦门市双十中学2018届高三第九次能力考试理综化学试题
真题
名校
7 . 在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
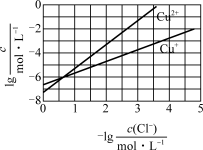

| A.Ksp(CuCl)的数量级为10-7 |
| B.除Cl-反应为Cu+Cu2++2Cl-=2CuCl |
| C.加入Cu越多,Cu+浓度越高,除Cl-效果越好 |
| D.2Cu+=Cu2++Cu平衡常数很大,反应趋于完全 |
您最近一年使用:0次
2017-08-08更新
|
11737次组卷
|
38卷引用:福建省泉州市泉港区第一中学2018-2019学年高二年级下学期期中考化学试题
(已下线)福建省泉州市泉港区第一中学2018-2019学年高二年级下学期期中考化学试题河北省安平中学2016-2017学年高二下学期期末考试化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅲ卷精编版)湖南省怀化市2018届高三上学期期末教育质量监测化学试题江西省等三省十校2018届高三下学期联考理综化学试题(已下线)《考前20天终极攻略》-5月23日 溶液中的离子平衡(已下线)解密13 沉淀溶解平衡——备战2018年高考化学之高频考点解密(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第5讲 数形结合思想的应用【教学案】湖南省怀化市2018届高三上学期期末统一考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2019届高三上学期期末考试化学试题【全国百强校】河南省信阳市第一高级中学2019届高三上学期期末考试化学试题四川省宜宾市叙州区第一中学2020届高三上学期第一次月考理综化学试题云南省玉溪市江川二中2019-2020学年高三上学期期中考试化学试题(已下线)专题8.4 难溶电解质的溶解平衡(练)-《2020年高考一轮复习讲练测》2020届人教版高三化学二轮专题巩固练习:水溶液中的离子平衡【懂做原理题】2020届高三化学选修4二轮专题练——沉淀溶解平衡的曲线分析【精编23题】贵州省镇远县二中2019-2020学年高三上学期期末考试化学试题贵州省岑巩县第二中学2019-2020学年高三上学期期末考试化学试题(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训2020届湖南省湘潭市高三教学质量监测卷化学试题湖南省衡阳市2020年高中毕业班教学质量监测卷理科综合化学鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 过高考 3年真题强化闯关(已下线)小题必刷34 沉淀溶解平衡、溶度积常数及其应用——2021年高考化学一轮复习小题必刷(通用版本)(已下线)练习12 难溶电解质的溶解平衡-2020-2021学年【补习教材·寒假作业】高二化学(人教版)甘肃省白银市第十中学2019-2020学年高二上学期期中考试化学试题(已下线)专题12 水溶液中离子平衡(攻克各种图像问题)-2021年高考化学必做热点专题(已下线)考点26 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点帮(全国通用)河北正定中学2020-2021学年高三上学期第四次半月考化学试题(已下线)考向27 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点微专题(已下线)第5讲 沉淀溶解平衡-【微专题·大素养】备战2022年高考化学核心突破(水溶液中的离子反应与平衡)(已下线)3.4.2 沉淀溶解平衡的应用-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)考点29 沉淀溶解平衡-备战2023年高考化学一轮复习考点帮(全国通用)四川省凉山宁南中学2019-2020学年高二下学期第一次月考化学试题云南省富宁县第一中学校2021-2022学年高三下学期开学考试理综化学试题(已下线)题型28 沉淀溶解平衡常数及其应用图像(已下线)第6讲 沉淀溶解平衡图像分析
名校
8 . 已知在25℃的水溶液中,AgCl、AgBr、AgI均难溶于水,且Ksp(AgCl)= 1.8×10-10,Ksp(AgBr)= 1.0×10-12,Ksp(AgI)= 8.7×10-17;
(1) 若向AgBr的饱和溶液中加入少量的AgCl固体,则c(Br-)_______________ 。 (填“增大”、“减小”或“不变”)。
(2)在25℃时,若取0.188 g的AgBr(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Br-的物质的量浓度为_____________ 。
(3)① 由上述Ksp判断,在上述(2)的体系中,能否实现AgBr向AgI的转化_______ (填“能”或“否”),简述理由:_____________________________________________________________ 。
② 若某KCl溶液的浓度为 1.0×10-2 mol·L-1 ,将等体积的该KCl溶液与AgNO3 溶液混合,则生成沉淀所需AgNO3 溶液的最小浓度为__________ mol·L-1。
(1) 若向AgBr的饱和溶液中加入少量的AgCl固体,则c(Br-)
(2)在25℃时,若取0.188 g的AgBr(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Br-的物质的量浓度为
(3)① 由上述Ksp判断,在上述(2)的体系中,能否实现AgBr向AgI的转化
② 若某KCl溶液的浓度为 1.0×10-2 mol·L-1 ,将等体积的该KCl溶液与AgNO3 溶液混合,则生成沉淀所需AgNO3 溶液的最小浓度为
您最近一年使用:0次
2017-07-14更新
|
384次组卷
|
2卷引用:福建省龙海市程溪中学2016-2017学年高二下学期期末考试化学试题
名校
9 . 下列叙述正确的是
| A.两种难溶性盐,Ksp较小的,其溶解度也一定较小 |
| B.稀释氨水溶液,溶液中所有离子的浓度都降低 |
| C.稀释醋酸钠溶液,CH3COO- 水解程度变大,故溶液的pH增大 |
| D.相同条件下,HA比HB易电离,则NaA溶液的pH比NaB溶液的pH小 |
您最近一年使用:0次
2017-07-13更新
|
199次组卷
|
3卷引用:福建省龙海市程溪中学2016-2017学年高二下学期期末考试化学试题
10 . (1)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。
已知浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中 为:
为:_______ ,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(2)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl−,利用Ag+与CrO42−生成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好沉淀完全(浓度等于1.0×10−5 mol·L−1)时,溶液中c(Ag+)为_______ mol·L−1,此时溶液中c(CrO42−)等于__________ mol·L−1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10−12和2.0×10−10)。
已知浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中
 为:
为:(2)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl−,利用Ag+与CrO42−生成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好沉淀完全(浓度等于1.0×10−5 mol·L−1)时,溶液中c(Ag+)为
您最近一年使用:0次



