山东省临沂市第一中学2018届高三上学期开学收心考试化学试题
山东
高三
开学考试
2017-09-13
342次
整体难度:
适中
考查范围:
化学与STSE、常见无机物及其应用、认识化学科学、化学实验基础、物质结构与性质、化学反应原理
一、单选题 添加题型下试题
| A.《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之”。“瓦”,传统无机非金属材料,主要成分为硅酸盐。 |
| B.《本草纲目》“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上…其清如水,味极浓烈,盖酒露也.”这里所用的“法”是指蒸馏。 |
| C.《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色反应。 |
| D.《抱朴子·金丹篇》中记载:“丹砂烧之成水银,积变又还成丹砂。”该过程未发生氧化还原反应。 |
【知识点】 化学科学对人类文明发展的意义解读
| A.新能源汽车的推广与使用,有助于减少光化学烟雾的产生 |
| B.氯气泄漏时,可用蘸有肥皂水的湿毛巾捂住口鼻疏散到安全区域 |
| C.铁在潮湿的空气中放置,易发生化学腐蚀而生锈 |
| D.地球上99%的溴元素以Br-形式存在于海水中,溴化钠和溴化钾在医药上常用作镇静剂 |
【知识点】 氯气与碱溶液反应解读 溴、碘的性质 化学科学对人类文明发展的意义解读
| A.高纯度的SiO2是制备光导纤维、太阳能电池板的主要材料 |
| B.NO2有氧化性,可以损害多种织物和尼龙制品 |
| C.Al2O3熔点高,一般采用电解熔融的AlCl3制备金属铝 |
| D.利用Na2CO3可与盐酸反应的原理,治疗胃酸过多 |
| A.氢氧燃料电池负极消耗1.12L气体时,电路中转移的电子数为0.1NA |
| B.1L0.1 mol·L-1的Na2S溶液中,阴离子总数目大于0.1 NA |
| C.64gCu和足量的硫粉加热,充分反应转移的电子数是2NA |
| D.常温常压下,36g18O2中含中子数为16 NA |
【知识点】 阿伏加德罗常数的求算解读
| 物质及其杂质 | 检验试剂 | 除杂试剂 | 除杂方法 | |
| A | HCl(Cl2) | 湿润的淀粉KI试纸 | 饱和食盐水 | 洗气 |
| B | C2H5OH(H2O) | 无水硫酸铜粉末 | 生石灰 | 蒸馏 |
| C | CO2(SO2) | 品红溶液 | 饱和碳酸钠溶液 | 洗气 |
| D | NH4Cl(I2) | 淀粉溶液 | 无 | 加热 |
| A.A | B.B | C.C | D.D |
| A.弱碱性溶液中:Na+、K+、HCO3-、SO32- |
| B.空气中:NH3、NO、SO2、CO |
| C.漂白粉溶液中:Na+、Al3+、SO42-、NO3- |
| D.铜与足量稀硝酸反应后的溶液中:K+、Fe2+、I-、Cl- |
【知识点】 限定条件下的离子共存解读
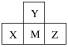
| A.若Y的最简单氢化物的沸点比M的低,则X单质可与强碱溶液反应 |
| B.简单阴离子半径:M>Z>Y |
| C.最高价氧化物对应水化物的酸性:Z>M |
| D.若Y的氢化物的水溶液呈碱性,则X的氧化物不与任何酸反应 |
| A.用FeS除工业废水中Cu2+:Cu2+(aq)+FeS(s)═Fe2+(aq) +CuS(s) |
B.用惰性电极电解饱和MgCl2溶液:2Cl﹣+2H2O Cl2↑+H2↑+2OH﹣ Cl2↑+H2↑+2OH﹣ |
| C.FeBr2溶液中通入过量Cl2:2Fe2++2Br﹣+2Cl2═2Fe3++Br2+4Cl﹣ |
D.向Na[Al(OH)4]溶液中滴加NaHCO3溶液:[Al(OH)4]-+ HCO ═Al(OH)3↓+ CO2↑+ H20 ═Al(OH)3↓+ CO2↑+ H20 |
| A.c(A-)/ c(B-)> c(HA)/ c(HB) | B.c(A-)- c(B-)= c(HA)- c(HB) |
| C.c(Na+)=c(A-)+c(B-) | D.c(HB)> c(HA) >c(OH-) |
| A.某温度下,NaCl溶液和CH3COONH4溶液均显中性,两溶液水的电离程度相同。 |
| B.常温下,将PH=3的醋酸溶液和0.001 mol·L-1的盐酸等体积混合,则混合液PH<3 |
| C.Na2CO3溶液加水稀释后,恢复至原温度,PH和KW均减小 |
| D.常温下,PH相同的①NH4Cl ② NH4Al(SO4)2 ③(NH4)2SO4三种溶液中c(NH4+):①=③>② |
【知识点】 水的电离 盐溶液中离子浓度大小的比较解读
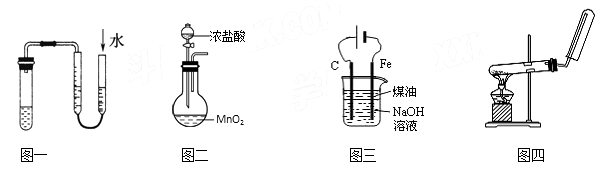
| A.利用图一方法验证装置的气密性 | B.利用图二装置制备氯气 |
| C.利用图三制备Fe(OH)2并能较长时间观察其颜色 | D.利用图四装置制备氨气 |
【知识点】 仪器使用与实验安全 化学实验方案的设计与评价
| A.向含酚酞的Na2CO3溶液中滴加BaCl2溶液,红色变浅 |
| B.加热MgCl2·6H2O固体最终得到Mg(OH)Cl |
| C.将FeS2矿石粉碎更有利于焙烧制备SO2气体 |
| D.NO2气体经过冷凝和加压成无色液体 |
【知识点】 化学反应原理综合考查解读
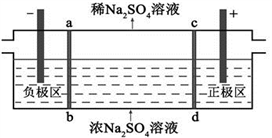
下列叙述不正确的是
| A.通电后中间隔室的SO42-离子向正极区迁移,电解后正极区PH减小 |
| B.ab为阳离子交换膜,负极区得到NaOH溶液 |
| C.负极区反应为2 H2O–4e–=O2+4H+,负极区溶液pH降低 |
| D.每有1molO2生成,会有4molNa+进入负极区 |
【知识点】 电解原理的应用
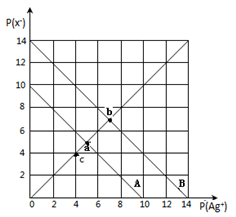
| A.t℃时,c点可表示AgCl的不饱和溶液 |
| B.B线表示的是AgBr |
| C.取a、b两点处溶液等体积混合,维持t℃不变,混合溶液中一定无白色沉淀生成 |
D.在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数K≈104 AgBr(s)+Cl-(aq)平衡常数K≈104 |
【知识点】 难溶电解质的溶解平衡 溶度积规则及其应用解读 溶度积常数相关计算解读
①LiAlH4 + 4H2O = LiOH + Al(OH)3 + 4H2↑
②NaBH4 + NH4Cl = NH3BH3 + NaCl + H2↑,
则下列说法错误的是
| A.LiAlH4中H元素均为 -1价 |
| B.反应②中,每生成1mol NH3BH3会转移2mole- |
| C.两个反应中,H2均既是氧化产物,又是还原产物 |
| D.NH4Cl和NaBH4所含化学键类型相同 |
二、填空题 添加题型下试题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
由①、③、⑧三种元素形成的一种离子化合物的电子式
(2)工业上制备元素⑥单质的方程式为
(3)①、②两种元素形成的离子化合物中,两种简单离子的半径大小
(4)常温下,将元素⑧的单质通入⑤的最高价氧化物的水溶液中,两者恰好反应,此时溶液中离子浓度由大到小的顺序是
【知识点】 元素周期律、元素周期表的推断
三、解答题 添加题型下试题
i.在汽车排气管加装催化转化器,可有效降低污染物的浓度,发生反应:2NO(g)+2CO(g)
 N2(g)+2CO2(g)△H<0。为了模拟催化转化器的工作原理,在t℃时,将2molNO与1mol CO充入1L反应容器中,反应过程中NO(g)、CO(g)、N2(g)的物质的量变化如图所示,
N2(g)+2CO2(g)△H<0。为了模拟催化转化器的工作原理,在t℃时,将2molNO与1mol CO充入1L反应容器中,反应过程中NO(g)、CO(g)、N2(g)的物质的量变化如图所示,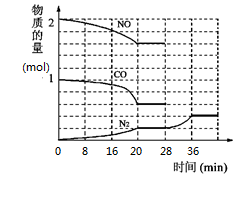
(1)①则反应进行到20min时,CO2的平均反应速率为
②28min~36min内NO、CO、N2的物质的量发生了变化(NO、CO图象未画出),引起该变化的条件可能是
a.加入催化剂 b.通入0.2mol N2
c.缩小容器体积 d.增加CO2的物质的量
③当36min达到平衡后,若保持体系温度为t℃,再向容器中充入CO、CO2气体,使两者物质的量浓度均加倍,平衡将
(2)若均取2molNO和1molCO的混合气体分别放入3种不同的容器中进行该反应,A容器保持恒温恒压,B容器保持恒温恒容,C容器保持恒容绝热,且初始时3个容器的容积和温度均相同,下列说法正确的是
a.3个容器中NO的平衡转化率的大小顺序为 aA>aB>aC.
b.当A容器内气体的平均摩尔质量不变时,说明该反应处于化学平衡状态
c.A、B两个容器达到平衡所用的时间:tA>tB
d.当C容器内平衡常数不变时,说明该反应处于化学平衡状态
ii. 某温度下,NO2(g)+SO2(g)⇌SO3(g)+NO(g)的平衡常数K=
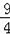 ,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如表所示,
,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如表所示,| 起始浓度 | 甲 | 乙 | 丙 |
| c(NO2)/mol•L﹣1 | 0.10 | 0.20 | 0.20 |
| c(SO2)/mol•L﹣1 | 0.10 | 0.10 | 0.20 |
(3)①10min后,甲中达到平衡,则甲中NO2的转化率α(NO2)=
②达到平衡后,设甲、乙、丙中SO2(g)的转化率分别为a、b、c,则三者的大小关系为
(4)利用反应NO2+NH3→N2+H2O(未配平)消除NO2的简易装置如图所示。
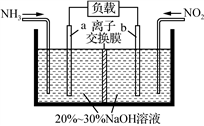
电极b的电极反应式为
i.亚硝酸钠的制备
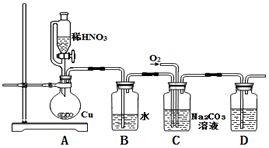
(1)实验中用恒压滴液漏斗,相比普通分液漏斗,显著的优点是
(2)D中澄清石灰水变浑浊,则C中制备NaNO2的离子方程式为
ii. 探究亚硝酸钠与硫酸反应气体产物成分.
已知:①NO+NO2+2OH﹣═2NO2﹣+H2O ②气体液化的温度:NO2:21℃,NO:﹣152℃
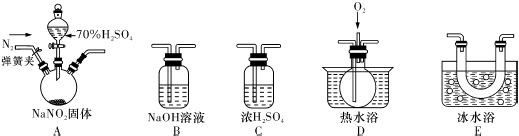
(3)反应前应打开弹簧夹,先通入一段时间氮气,目的是
(4)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):
A、C、
(5)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体.
①确认A中产生的气体含有NO,依据的现象是
②装置B的作用是
iii. 设计实验证明酸性条件下NaNO2具有氧化性:
供选用的试剂:NaNO2溶液、KMnO4溶液、FeSO4溶液、KI溶液、稀硫酸、淀粉溶液、KSCN溶液
【知识点】 化学实验方案的设计与评价 物质制备的探究解读

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;
②沉淀I中只含有两种沉淀;
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中Co2O3发生反应的离子反应方程式为
(2)NaClO3在浸出液中发生的离子反应方程式为
(3)加入Na2CO3调PH至5.2,目的是
(4)操作I包括:将水层加入浓盐酸调整PH为2-3,
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表.
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为
[已知: CoC2O4·2H2O的摩尔质量为183g·mol-1]
试卷分析
试卷题型(共 19题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 化学科学对人类文明发展的意义 | |
| 2 | 0.65 | 氯气与碱溶液反应 溴、碘的性质 化学科学对人类文明发展的意义 | |
| 3 | 0.65 | 二氧化氮 二氧化硅的用途 碳酸钠 氧化铝 | |
| 4 | 0.65 | 阿伏加德罗常数的求算 | |
| 5 | 0.65 | 物质的分离、提纯 物质的检验 | |
| 6 | 0.65 | 限定条件下的离子共存 | |
| 7 | 0.65 | 元素周期律、元素周期表的推断 同周期元素性质递变规律 同主族元素性质递变规律 “位构性”关系理解及应用 | |
| 8 | 0.65 | 离子方程式的书写 离子方程式的正误判断 沉淀转化 电解原理的应用 | |
| 9 | 0.65 | 盐类水解规律理解及应用 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 弱电解质的电离平衡常数 | |
| 10 | 0.65 | 水的电离 盐溶液中离子浓度大小的比较 | |
| 11 | 0.65 | 仪器使用与实验安全 化学实验方案的设计与评价 | |
| 12 | 0.65 | 化学反应原理综合考查 | |
| 13 | 0.65 | 电解原理的应用 | |
| 14 | 0.65 | 难溶电解质的溶解平衡 溶度积规则及其应用 溶度积常数相关计算 | |
| 15 | 0.65 | 氧化还原反应基本概念 氧化还原反应有关计算 化学键与物质类别关系的判断 | |
| 二、填空题 | |||
| 16 | 0.65 | 元素周期律、元素周期表的推断 | |
| 三、解答题 | |||
| 17 | 0.65 | 化学反应原理综合考查 转化率的相关计算及判断 化学平衡题中基于图表数据的相关计算 新型电池 | 原理综合题 |
| 18 | 0.65 | 化学实验方案的设计与评价 物质制备的探究 | 实验探究题 |
| 19 | 0.65 | 氧化还原反应方程式的配平 物质分离、提纯综合应用 探究物质组成或测量物质的含量 化学实验方案的设计与评价 | 工业流程题 |



