【校级联考】福建省长汀、连城一中等六校2019届高三上学期期中考联考化学试题
福建
高三
期中
2018-11-16
276次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、化学与STSE、化学实验基础、有机化学基础、化学反应原理、物质结构与性质
【校级联考】福建省长汀、连城一中等六校2019届高三上学期期中考联考化学试题
福建
高三
期中
2018-11-16
276次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、化学与STSE、化学实验基础、有机化学基础、化学反应原理、物质结构与性质
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
1. 下列说法正确的是
| A.化学反应能够制造出新的物质,也能制造出新的元素 |
| B.明矾水解时产生的胶体粒子,可作漂白剂 |
| C.食品包装袋中常放入小袋的生石灰,防止食品氧化变质 |
| D.河流入海口处会形成三角洲,其原理与卤水点豆腐相似 |
您最近一年使用:0次
2018-09-10更新
|
1498次组卷
|
5卷引用:山东省临沂市第十九中学2019届高三上学期第二次质量调研考试化学试题
山东省临沂市第十九中学2019届高三上学期第二次质量调研考试化学试题【校级联考】福建省长汀、连城一中等六校2019届高三上学期期中考联考化学试题福建省上杭县第一中学2019届高三上学期期中考试 化学甘肃省兰州市第一中学2020届高三上学期9月月考化学试题(已下线)专题2.1 物质的分类 胶体 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》
单选题
|
适中(0.64)
名校
2. 分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是
| A.冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物 |
| B.HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 |
| C.漂白粉、福尔马林、冰水、王水、氯水均为混合物 |
| D.Na2O、NaOH、Na2CO3、NaCl都属于钠的含氧化合物 |
【知识点】 物质的分类
您最近一年使用:0次
2016-12-09更新
|
301次组卷
|
5卷引用:2016届吉林省吉林大学附属中学高三上第一次摸底考试化学试卷
单选题
|
较易(0.85)
名校
3. 下列说法不正确的是
| A.《黄白第十大》中“曾青涂铁,铁赤如铜”主要发生了置换反应 |
| B.《本草纲目》中“用浓酒和糟入甑,蒸令气上,用器承滴露”,利用到蒸馏 |
| C.唐代《真元妙道要略》中有云“以硫磺、雄黄合硝石并蜜烧之,焰起烧手、面及屋舍者”,描述了硫磺熏制过程 |
| D.“所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”过程包括了溶解、蒸发、结晶等操作 |
您最近一年使用:0次
2018-11-15更新
|
162次组卷
|
3卷引用:【校级联考】福建省长汀、连城一中等六校2019届高三上学期期中考联考化学试题
单选题
|
适中(0.65)
名校
4. 下列化学用语或模型图正确的是
A.氮气的结构式: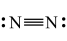 |
B.用电子式表示溴化氢的形成过程为: |
C.CO2的比例模型: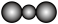 |
D.14C的原子结构示意图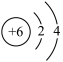 |
您最近一年使用:0次
2018-09-01更新
|
462次组卷
|
3卷引用:辽宁省实验中学2017-2018学年高一下学期期末考试化学试题
单选题
|
适中(0.65)
名校
5. 设NA为阿伏伽德罗常数值。下列有关叙述正确的是( )
| A.10g 46%的乙醇水溶液中,氧原子的个数为0.4NA |
| B.1 mol N2与4 mol H2反应生成的NH3分子数为2NA |
| C.1 mol Fe溶于过量硝酸,电子转移数为2NA |
| D.14 g乙烯和丙烯混合气体中的氢原子数为NA |
您最近一年使用:0次
2018-11-15更新
|
154次组卷
|
4卷引用:【校级联考】福建省长汀、连城一中等六校2019届高三上学期期中考联考化学试题
单选题
|
适中(0.65)
名校
6. 下列实验操作及现象能够达成相应实验目的的是
| 实验目的 | 实验操作及现象 | |
| A | 检验Na2SO3溶液是否变质 | 向Na2SO3溶液中加入Ba(NO3)2溶液,出现白色沉淀,再加入稀硝酸,沉淀不溶解 |
| B | 证明酸性条件下H2O2氧化性强于I2 | 向淀粉KI溶液中滴入3滴稀硫酸,未见溶液变蓝;再加入10%的H2O2溶液,溶液立即变蓝色 |
| C | 证明碳的非金属性强于硅 | 将浓盐酸滴入碳酸钠固体中,生成的气体通入盛有水玻璃的试管中,出现浑浊 |
| D | 向某溶液中滴入氯水,再滴加KSCN溶液显红色 | 原溶液中一定有Fe2+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-11-15更新
|
174次组卷
|
2卷引用:【校级联考】福建省长汀、连城一中等六校2019届高三上学期期中考联考化学试题
单选题
|
较易(0.85)
名校
7. 下列说法不正确的是
| A.淀粉、纤维素水解的最终产物均为葡萄糖 |
| B.葡萄糖既可以与银氨溶液反应,又可以与新制氢氧化铜悬浊液反应 |
| C.糖类、油脂、蛋白质都是高分子化合物,都能发生水解反应 |
| D.天然油脂没有固定的熔点和沸点,所以天然油脂是混合物 |
您最近一年使用:0次
2018-11-15更新
|
185次组卷
|
2卷引用:【校级联考】福建省长汀、连城一中等六校2019届高三上学期期中考联考化学试题
单选题
|
适中(0.65)
名校
8. 有机物甲、乙的结构如图所示。下列说法错误的是


| A.甲、乙都能与溴的单质发生加成反应 |
| B.甲、乙互为同分异构体 |
| C.一定条件下,甲、乙均能发生取代反应 |
| D.甲、乙都能与金属钠反应生成氢气 |
您最近一年使用:0次
2018-11-15更新
|
258次组卷
|
4卷引用:【校级联考】福建省长汀、连城一中等六校2019届高三上学期期中考联考化学试题
单选题
|
适中(0.65)
名校
9. 常温下,在下列给定条件的溶液中,一定能大量共存的离子组是
| A.Kw/c(H+)=0.1mol/L的溶液:Na+、K+、SiO32-、NO3- |
| B.加入铝粉生成H2的溶液:K+、Mg2+、SO42-、HCO3- |
| C.c(Fe3+)=0.1mo/L的溶液:NO3-、Al3+、Cl-、CO32- |
| D.能使pH试纸呈红色的溶液:Na+、NH4+、Fe2+、NO3- |
【知识点】 限定条件下的离子共存解读
您最近一年使用:0次
2018-01-15更新
|
194次组卷
|
5卷引用:江苏省海安高级中学2018届高三1月月考化学试题
江苏省海安高级中学2018届高三1月月考化学试题江苏省泰州中学2018届高三3月月度检测(二模模拟)化学试题(已下线)【中等生百日捷进提升系列-技能方法】专题05 离子共存类选择题解题方法和策略【校级联考】福建省长汀、连城一中等六校2019届高三上学期期中考联考化学试题福建省上杭县第一中学2019届高三上学期期中考试 化学
单选题
|
适中(0.65)
名校
10. 类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是 ( )
| 选项 | 已知 | 类推 |
| A | 向Ca(OH)2悬浊液中通入Cl2: Cl2+Ca(OH)2=Ca2++Cl-+ClO-+H2O | 向CaCO3悬浊液中通入Cl2: Cl2+CaCO3=Ca2++Cl-+ClO-+CO2↑ |
| B | 向氯化铝溶液中加入足量NaOH溶液: Al3++4OH-=[Al(OH)4]- | 向氯化铝溶液中加入足量氨水: Al3++4NH3·H2O=[Al(OH)4]-+H2O+4NH4+ |
| C | FeCl2溶液中滴入氯水: 2Fe2++Cl2===2Fe3++2Cl- | 向FeCl2溶液中滴入碘水: 2Fe2++I2===2Fe3++2I- |
| D | 向Ca(OH)2溶液中通入过量CO2: CO2+OH-===HCO3- | 向Ca(OH)2溶液中通入过量SO2: SO2+OH-===HSO3- |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-11-15更新
|
227次组卷
|
3卷引用:【校级联考】福建省长汀、连城一中等六校2019届高三上学期期中考联考化学试题
二、多选题 添加题型下试题
多选题
|
适中(0.65)
名校
解题方法
11. 某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和K2SO4溶液。下列说法正确的是( )
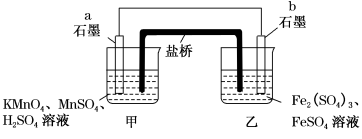
| A.b电极上发生还原反应 |
| B.外电路电流方向是从a到b |
| C.电池工作时,盐桥中的SO42-移向甲烧杯 |
| D.a电极上发生的反应为MnO4-+8H++5e-=Mn2++4H2O |
【知识点】 原电池 原电池原理 原电池电极反应式书写解读
您最近一年使用:0次
2019-01-25更新
|
311次组卷
|
16卷引用:2015届山东省潍坊市高三下学期二模考试化学试卷
2015届山东省潍坊市高三下学期二模考试化学试卷2016届甘肃省兰州第一中学高三12月月考化学试卷2016届辽宁省大石桥市第二高级中学高三上期末化学试卷2016届甘肃省武威六中高三一轮复习阶段测(五)化学试卷2016-2017学年黑龙江哈尔滨六中高二上期末化学卷辽宁省营口中学2017-2018学年高二上学期期末考试化学试题湖北省孝感市八校2017-2018学年高二上学期期末考试化学试题【校级联考】福建省长汀、连城一中等六校2019届高三上学期期中考联考化学试题福建省上杭县第一中学2019届高三上学期期中考试 化学湖南省邵东县创新实验学校2019届高三上学期第五次月考化学试题【全国百强校】黑龙江省大庆实验中学2017-2018学年高二上学期期末考试化学试题(已下线)考点09 原电池原理及其应用——备战2019年浙江新高考化学考点黑龙江省双鸭山市第一中学2019-2020学年高二上学期期末考试化学试题湖南省部分市(州)学校2022-2023学年高三上学期第一次复习联考(二)化学试题海南省琼海市嘉积第二中学2021-2022学年高二下学期教学质量监测(段考)化学科试题 福建省福州市格致中学2022-2023学年高三上学期期中模拟测试化学试题
三、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
12. 如图是实验室硫酸试剂标签上的部分内容,据此下列说法正确的是


| A.配制稀硫酸定容时俯视刻度线会造成所配溶液浓度偏高 |
| B.取该硫酸1ml与1ml水混合后,物质的量浓度为9.2mol/L |
| C.将该硫酸配成1mol/L的稀硫酸480ml所需的玻璃仪器只有:烧杯、500ml容量瓶、玻璃棒 |
| D.1molFe与足量的该硫酸反应产生1mol氢气 |
您最近一年使用:0次
2018-11-15更新
|
49次组卷
|
3卷引用:【校级联考】福建省长汀、连城一中等六校2019届高三上学期期中考联考化学试题
单选题
|
适中(0.65)
名校
13. 氢化铝锂(LiAlH4)和硼氢化钠(NaBH4)都是有机合成中非常重要的还原剂,可发生如下反应:
①LiAlH4 + 4H2O = LiOH + Al(OH)3 + 4H2↑
②NaBH4 + NH4Cl = NH3BH3 + NaCl + H2↑,
则下列说法错误的是
①LiAlH4 + 4H2O = LiOH + Al(OH)3 + 4H2↑
②NaBH4 + NH4Cl = NH3BH3 + NaCl + H2↑,
则下列说法错误的是
| A.LiAlH4中H元素均为 -1价 |
| B.反应②中,每生成1mol NH3BH3会转移2mole- |
| C.两个反应中,H2均既是氧化产物,又是还原产物 |
| D.NH4Cl和NaBH4所含化学键类型相同 |
您最近一年使用:0次
2017-09-06更新
|
321次组卷
|
5卷引用:山东省临沂市第一中学2018届高三上学期开学收心考试化学试题
山东省临沂市第一中学2018届高三上学期开学收心考试化学试题【校级联考】福建省长汀、连城一中等六校2019届高三上学期期中考联考化学试题福建省上杭县第一中学2019届高三上学期期中考试 化学(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第3讲 氧化还原反应 (题型专练)安徽省滁州市定远县民族中学2018-2019学年高一上学期12月月考化学试题
单选题
|
较难(0.4)
名校
解题方法
14. 某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、[Al(OH)4]-中的若干种离子,离子浓度均为0.1mol·L -1 ,某同学进行了如下实验,下列说法正确的是
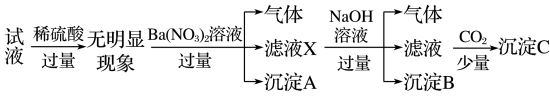

| A.无法确定原试液中是否含有Al3+、Cl- |
| B.原溶液中存在NH4+、Fe2+、Cl-、SO42- |
| C.无法确定沉淀C的成分 |
| D.滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+ |
您最近一年使用:0次
2016-09-03更新
|
1448次组卷
|
18卷引用:2016届山东省枣庄市滕州五中高三上学期期末化学试卷
2016届山东省枣庄市滕州五中高三上学期期末化学试卷2016届湖北省武昌实验中学高三高考前模拟理综化学试卷2015-2016学年辽宁省大连市瓦房店高中高二下期末化学试卷2017届河北省定州中学高三上学期周练(8.28)化学试卷2017届湖北省荆、荆、襄、宜四地七校高三上联考一化学卷河南省林州市第一中学2018届高三8月调研考试化学试题河北省定州中学2017-2018学年高二上学期开学考试化学试题陕西省西安中学2018届高三10月月考化学试题湖北省荆州中学2018届高三上学期第二次双周考化学试题安徽省六安市第一中学2018届高三上学期第三次月考化学试题陕西省西安中学2018届高三上学期期中考试化学试题辽宁师范大学附属中学2018届高三上学期期末考试化学试题湖南省长沙市长郡中学2017-2018学年高一下学期开学考试化学试题2017-2018学年第一学期期末复习备考之精准复习模拟题高三化学(单科)(C卷)2019届高考化学一轮复习离子反应天津市2018届高三第二学期高考模拟化学试题【校级联考】福建省长汀、连城一中等六校2019届高三上学期期中考联考化学试题福建省上杭县第一中学2019届高三上学期期中考试 化学
单选题
|
适中(0.65)
名校
15. 下列事实与平衡移动原理无关的是
| A.向含酚酞的Na2CO3溶液中滴加BaCl2溶液,红色变浅 |
| B.加热MgCl2·6H2O固体最终得到Mg(OH)Cl |
| C.将FeS2矿石粉碎更有利于焙烧制备SO2气体 |
| D.NO2气体经过冷凝和加压成无色液体 |
【知识点】 化学反应原理综合考查解读
您最近一年使用:0次
2017-09-06更新
|
378次组卷
|
6卷引用:山东省临沂市第一中学2018届高三上学期开学收心考试化学试题
单选题
|
适中(0.65)
名校
解题方法
16. CO(g)和H2O(g)以1 : 2体积比分别通入到体积为2 L的恒容密闭容器中进行反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
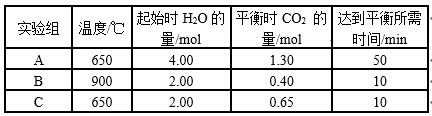
下列说法不正确的是
 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
下列说法不正确的是
| A.从实验数据分析,该反应的正反应是吸热反应 |
| B.实验A中,在0~10min内,以v(H2)表示的反应速率大于0.013mol(L·min)-1 |
| C.从生产效益分析,C组实验的条件最佳 |
| D.比较实验B、C,说明C实验使用了更高效的催化剂 |
【知识点】 化学反应条件的控制及优化 勒夏特列原理的应用解读
您最近一年使用:0次
2018-10-02更新
|
837次组卷
|
5卷引用:浙江省嘉兴市2019届高三上学期9月份考试化学试题
四、解答题 添加题型下试题
解答题-无机推断题
|
较难(0.4)
名校
解题方法
17. Ⅰ.下列是某研究性学习小组对某无色水样成分的检测过程,已知该水样中只可能含有K+ 、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO32-、SO42-、Cl-中的若干种离子,该小组同学取了100ml水样进行实验:向水样中先滴加硝酸钡溶液,再滴加1mol·L-1硝酸,实验过程中沉淀质量与所加试剂量的关系变化如下图所示:
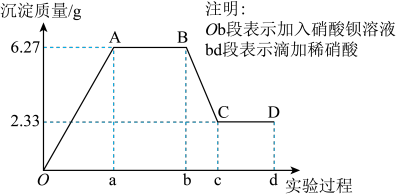
(1)仅凭观察 可知该水样中一定不含有的阳离子是________ 。
(2)由B点到C点变化过程中消耗硝酸的体积为__________ ml。
(3)试根据实验结果推测K+是否存在_______ (填“是”或“否”)若存在,其物质的量浓度的范围是______ mol·L-1(若不存在,则不必回答)。
(4)设计简单实验验证原水样中可能存在的离子__________________________________ (写出实验步骤、现象和结论)。
II.湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
(1)写出并配平湿法制高铁酸钾反应的离子方程式:_________________________ 。
(2)若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________ mol。
(3)低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),原因_______________________________________________________________________ 。
(4)已知K2FeO4能水解产生Fe(OH)3用作净水剂,请写出水解的离子方程式___________
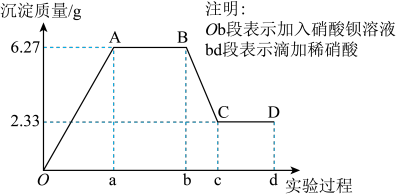
(1)
(2)由B点到C点变化过程中消耗硝酸的体积为
(3)试根据实验结果推测K+是否存在
(4)设计简单实验验证原水样中可能存在的离子
II.湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
(1)写出并配平湿法制高铁酸钾反应的离子方程式:
(2)若反应过程中转移了0.3 mol电子,则还原产物的物质的量为
(3)低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),原因
(4)已知K2FeO4能水解产生Fe(OH)3用作净水剂,请写出水解的离子方程式
您最近一年使用:0次
2018-11-15更新
|
190次组卷
|
2卷引用:【校级联考】福建省长汀、连城一中等六校2019届高三上学期期中考联考化学试题
解答题-实验探究题
|
较难(0.4)
名校
18. 聚合硫酸铁、明矾可用作净水剂。某课题组拟以废弃的铝铁合金为原料制备聚合硫酸铁和明矾,设计化工流程如下:
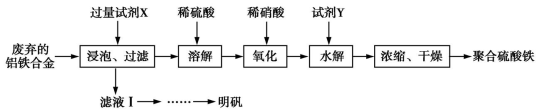
(1)聚合硫酸铁能溶于水,微溶于乙醇,其化学式可表示为[Fe2(OH)x(SO4)y]n。
①在聚合硫酸铁中,x、y之间的关系是_______ 。试剂X中溶质的化学式为________ 。
②上述流程图中的“氧化”设计存在缺陷,请提出改进意见;____________________ 为了降低聚合硫酸铁的溶解度,在浓缩过程中加入适量的溶剂是________ (填结构简式)。
③加入试剂Y的目的是为了调节溶液的PH,若Y为氧化物,写出调节PH的离子方程式:________ ;溶液的pH对[Fe2(OH)x(SO4)y]n中x的值有较大影响(如图A所示),试分析pH过小(pH≤3.0)导致聚合硫酸铁中x的值减小的原因:________ 。
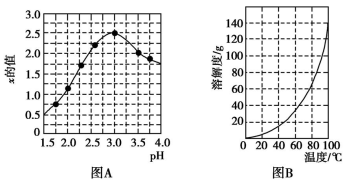
(2)明矾的化学式为KAl(SO4)2·12H2O。图B为明矾的溶解度随温度变化的曲线,由滤液Ⅰ制备明矾晶体的流程如下(供选用的试剂:废弃的铝铁合金、稀硫酸、NaOH溶液和酒精):
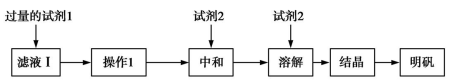
①试剂1是____ ;操作1的名称是________ 。
②结晶措施是________ 。

(1)聚合硫酸铁能溶于水,微溶于乙醇,其化学式可表示为[Fe2(OH)x(SO4)y]n。
①在聚合硫酸铁中,x、y之间的关系是
②上述流程图中的“氧化”设计存在缺陷,请提出改进意见;
③加入试剂Y的目的是为了调节溶液的PH,若Y为氧化物,写出调节PH的离子方程式:

(2)明矾的化学式为KAl(SO4)2·12H2O。图B为明矾的溶解度随温度变化的曲线,由滤液Ⅰ制备明矾晶体的流程如下(供选用的试剂:废弃的铝铁合金、稀硫酸、NaOH溶液和酒精):

①试剂1是
②结晶措施是
您最近一年使用:0次
2018-11-15更新
|
287次组卷
|
2卷引用:【校级联考】福建省长汀、连城一中等六校2019届高三上学期期中考联考化学试题
解答题-实验探究题
|
适中(0.65)
名校
19. 硫酰氯(SO2Cl2)常用作氯化剂和氯磺化剂,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。现在拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =−97.3 kJ·mol−1,实验装置如图所示(部分夹持装置未画出)。
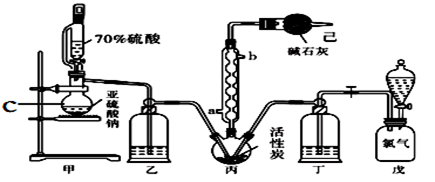
已知:硫酰氯通常条件下为无色液体,熔点−54.1℃,沸点69.1℃。在潮湿空气中“发烟”;长期放置或者100°C以上发生分解,生成二氧化硫和氯气。回答下列问题:
(1)仪器C的名称是_______________ ,冷凝管的进水方向______ (填“a”或“b”)。
(2)下列操作或描述正确的是_________________ 。
A.将70%硫酸换成98.3%硫酸,可以加快制取SO2的速率
B.实验中通过观察乙、丁导管口产生气泡的速率相等,可控制两种反应物体积相等
C.装置戊上方分液漏斗中最好选用0.10 mol·L-1NaCl溶液,减小氯气的溶解度
D.装置己防止污染,又防止硫酰氯变质
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯,写出反应方程式:____________________ 。
(4)硫酰氯在潮湿空气中“发烟”,原因是_______________________ (用化学方程式表示)。
(5)若反应中消耗的二氧化硫体积为560 mL(标准状况下),最后经过分离提纯得到2.7 g纯净的硫酰氯,则硫酰氯的产率为_______ 。

已知:硫酰氯通常条件下为无色液体,熔点−54.1℃,沸点69.1℃。在潮湿空气中“发烟”;长期放置或者100°C以上发生分解,生成二氧化硫和氯气。回答下列问题:
(1)仪器C的名称是
(2)下列操作或描述正确的是
A.将70%硫酸换成98.3%硫酸,可以加快制取SO2的速率
B.实验中通过观察乙、丁导管口产生气泡的速率相等,可控制两种反应物体积相等
C.装置戊上方分液漏斗中最好选用0.10 mol·L-1NaCl溶液,减小氯气的溶解度
D.装置己防止污染,又防止硫酰氯变质
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯,写出反应方程式:
(4)硫酰氯在潮湿空气中“发烟”,原因是
(5)若反应中消耗的二氧化硫体积为560 mL(标准状况下),最后经过分离提纯得到2.7 g纯净的硫酰氯,则硫酰氯的产率为
您最近一年使用:0次
2018-11-15更新
|
306次组卷
|
3卷引用:【校级联考】福建省长汀、连城一中等六校2019届高三上学期期中考联考化学试题
20. I、从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)已知:Fe3O4(s) + CO(g) = 3FeO(s) + CO2(g) ΔH1 = +19.3 kJ·mol-1
3FeO(s) + H2O(g) = Fe3O4(s) + H2(g) ΔH2 = -57.2 kJ·mol-1
C(s) + CO2(g) = 2 CO(g) ΔH3 = +172.4 kJ·mol-1
写出以铁氧化物为催化剂裂解水制氢气总反应的热化学方程式___________ 。
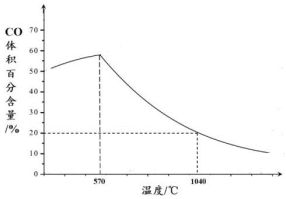
(2)下图表示其它条件一定时,Fe3O4(s)和CO(g)反应达平衡时CO(g)的体积百分含量随温度的变化关系。
①当温度低于570℃时,温度降低,CO的转化率__________ (填“增大”、“减小”或“不变”),理由是_______________ 。
②当温度高于570℃时,随温度升高,反应Fe3O4(s) + CO(g) 3FeO(s) + CO2(g)平衡常数的变化趋势是
3FeO(s) + CO2(g)平衡常数的变化趋势是_________ ;(填“增大”、“减小”或“不变”);1040℃时,该反应的化学平衡常数的数值是____________ 。
II、汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
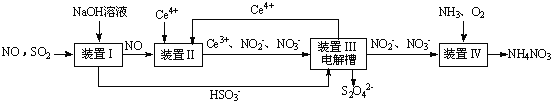
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成NO3-和NO2-物质的量之比为2:1时的离子方程式:________________________ 。
(2)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的____ (填“阳极”或“阴极”),同时在另一极生成S2O42-的电极反应式为_________ 。
(3)已知进入装置Ⅳ的溶液中NO2-的浓度为a g·L-1,要使1.5 m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气___ L(用含a代数式表示,结果保留整数,否则不给分 )。
(1)已知:Fe3O4(s) + CO(g) = 3FeO(s) + CO2(g) ΔH1 = +19.3 kJ·mol-1
3FeO(s) + H2O(g) = Fe3O4(s) + H2(g) ΔH2 = -57.2 kJ·mol-1
C(s) + CO2(g) = 2 CO(g) ΔH3 = +172.4 kJ·mol-1
写出以铁氧化物为催化剂裂解水制氢气总反应的热化学方程式

(2)下图表示其它条件一定时,Fe3O4(s)和CO(g)反应达平衡时CO(g)的体积百分含量随温度的变化关系。
①当温度低于570℃时,温度降低,CO的转化率
②当温度高于570℃时,随温度升高,反应Fe3O4(s) + CO(g)
 3FeO(s) + CO2(g)平衡常数的变化趋势是
3FeO(s) + CO2(g)平衡常数的变化趋势是II、汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。

装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成NO3-和NO2-物质的量之比为2:1时的离子方程式:
(2)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的
(3)已知进入装置Ⅳ的溶液中NO2-的浓度为a g·L-1,要使1.5 m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气
您最近一年使用:0次
2018-11-15更新
|
248次组卷
|
2卷引用:【校级联考】福建省长汀、连城一中等六校2019届高三上学期期中考联考化学试题
试卷分析
整体难度:适中
考查范围:认识化学科学、常见无机物及其应用、化学与STSE、化学实验基础、有机化学基础、化学反应原理、物质结构与性质
试卷题型(共 20题)
题型
数量
单选题
15
多选题
1
解答题
4
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 胶体的性质和应用 明矾的净水作用及原理 食品添加剂 | |
| 2 | 0.64 | 物质的分类 | |
| 3 | 0.85 | 蒸发与结晶 蒸馏与分馏 化学在工业中的应用 | |
| 4 | 0.65 | 有关粒子结构的化学用语 原子结构示意图、离子结构示意图 共价型分子结构式、电子式 原子、离子、原子团及其电子式的书写与判断 | |
| 5 | 0.65 | 阿伏加德罗常数的应用 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 6 | 0.65 | 硫酸根离子的检验 Fe2+的鉴别及其应用 化学实验方案的设计与评价 | |
| 7 | 0.85 | 油脂在碱性条件下水解 葡萄糖与新制氢氧化铜溶液的反应 淀粉、纤维素的水解 蛋白质的水解 | |
| 8 | 0.65 | 同分异构现象、同分异构体的概念 取代反应 加成反应 多官能团有机物的结构与性质 | |
| 9 | 0.65 | 限定条件下的离子共存 | |
| 10 | 0.65 | 离子方程式的书写 氯气与水的反应 铝三角转化 | |
| 12 | 0.65 | 配制一定物质的量浓度的溶液实验的误差分析 配制一定物质的量浓度的溶液实验的仪器 | |
| 13 | 0.65 | 氧化还原反应基本概念 氧化还原反应有关计算 化学键与物质类别关系的判断 | |
| 14 | 0.4 | 离子共存 离子的检验 | |
| 15 | 0.65 | 化学反应原理综合考查 | |
| 16 | 0.65 | 化学反应条件的控制及优化 勒夏特列原理的应用 | |
| 二、多选题 | |||
| 11 | 0.65 | 原电池 原电池原理 原电池电极反应式书写 | |
| 三、解答题 | |||
| 17 | 0.4 | 氧化还原反应有关计算 氧化还原反应方程式的配平 常见阳离子的检验 常见阴离子的检验 | 无机推断题 |
| 18 | 0.4 | 物质分离、提纯综合应用 常见无机物的制备 物质制备的探究 | 实验探究题 |
| 19 | 0.65 | 二氧化硫的制备 物质制备的探究 综合实验设计与评价 | 实验探究题 |
| 20 | 0.65 | 盖斯定律与热化学方程式 化学平衡图像分析 化学平衡常数的概念及表达方式 电解池电极反应式及化学方程式的书写与判断 | 原理综合题 |



