1 . ZnO在化学工业中主要用作橡胶和颜料的添加剂,医药上用于制软膏、橡皮膏等。工业上可由菱锌矿(主要成分为ZnCO3,还含有Ni、Cd、Fe、Mn等元素)制备。工艺如图所示:
已知:①“溶浸”后的溶液中金属离子主要有:Zn2+、Fe2+、Cd2+、Mn2+、Ni2+。
②弱酸性溶液中KMnO4能将Mn2+氧化生成MnO2。
③氧化性顺序:Ni2+>Cd2+>Zn2+。
(1)基态Zn原子的核外电子排布式为___________ ,铁在元素周期表中的位置为___________ ,Ni2+和Fe2+可形成如图所示的配合物离子,其中铁的一个配体为茂环阴离子(C5H ),该配体以π电子参与配位,配合物离子中与铁形成配位键的电子共有
),该配体以π电子参与配位,配合物离子中与铁形成配位键的电子共有___________ 个,S元素的杂化方式为___________ 。 ”是向“溶浸”后的溶液中加入少量
”是向“溶浸”后的溶液中加入少量___________ (填化学式)调节至弱酸性(pH为5.5)。此时溶液中 的最大浓度是
的最大浓度是___________ 。
(3)加 “氧化除杂”发生反应的离子方程式分别是
“氧化除杂”发生反应的离子方程式分别是 和
和___________ 。
(4)“还原除杂”除去的离子是___________ 。
(5)生成碱式碳酸锌 沉淀,写出该步骤的离子方程式
沉淀,写出该步骤的离子方程式___________ 。碱式碳酸锌灼烧后得到ZnO,ZnO的一种晶体的晶胞是立方晶胞(如图所示),晶胞参数为apm,该晶胞的密度为___________ g/cm3,请在图中画出该晶胞沿 轴方向的平面投影图
轴方向的平面投影图___________ 。

| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ | Mn2+ | Ni2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.0 | 7.4 | 8.1 | 6.9 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.0 | 9.4 | 10.1 | 8.9 |
②弱酸性溶液中KMnO4能将Mn2+氧化生成MnO2。
③氧化性顺序:Ni2+>Cd2+>Zn2+。
(1)基态Zn原子的核外电子排布式为
 ),该配体以π电子参与配位,配合物离子中与铁形成配位键的电子共有
),该配体以π电子参与配位,配合物离子中与铁形成配位键的电子共有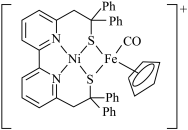
 ”是向“溶浸”后的溶液中加入少量
”是向“溶浸”后的溶液中加入少量 的最大浓度是
的最大浓度是(3)加
 “氧化除杂”发生反应的离子方程式分别是
“氧化除杂”发生反应的离子方程式分别是 和
和(4)“还原除杂”除去的离子是
(5)生成碱式碳酸锌
 沉淀,写出该步骤的离子方程式
沉淀,写出该步骤的离子方程式 轴方向的平面投影图
轴方向的平面投影图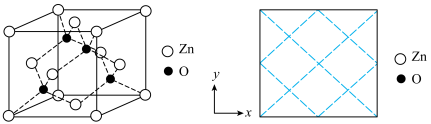
您最近一年使用:0次
2 .  被誉为电子陶瓷工业的支柱。工业中以毒重石(主要成分为
被誉为电子陶瓷工业的支柱。工业中以毒重石(主要成分为 ,含少量
,含少量 、
、 和
和 )为原料制备
)为原料制备 的流程如下:
的流程如下: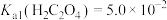 ,
,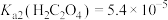 ,
, ;
;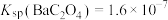 ,
,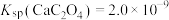 。
。
回答下列问题:
(1)基态Fe原子核外电子的空间运动状态有_____ 种。
(2)浸渣的主要成分为_____ 和_____ (填化学式),“浸出”步骤中 与
与 溶液反应的原理为
溶液反应的原理为_____ (用离子方程式表示)。
(3)若浸出液中 ,
, ,“除钙”步骤中,当沉钙率为90%时,钡损率为
,“除钙”步骤中,当沉钙率为90%时,钡损率为_____ 。
(4) 溶液显
溶液显_____ (填“酸”“碱”或“中”)性;“沉钛”步骤所得沉淀为 ,该步骤生成的能循环利用的物质是
,该步骤生成的能循环利用的物质是_____ (填化学式)。
(5)“热解”步骤的化学方程式为_____ 。
(6) 在室温下为立方晶胞,其结构如图所示,已知Ba与O的最小间距大于Ti与O的最小间距。
在室温下为立方晶胞,其结构如图所示,已知Ba与O的最小间距大于Ti与O的最小间距。 ,则B点微粒的坐标为
,则B点微粒的坐标为_____ 。
②Ti在晶胞中的位置为_____ ;晶胞中一个Ba周围与其最近的O的个数为_____ 。
 被誉为电子陶瓷工业的支柱。工业中以毒重石(主要成分为
被誉为电子陶瓷工业的支柱。工业中以毒重石(主要成分为 ,含少量
,含少量 、
、 和
和 )为原料制备
)为原料制备 的流程如下:
的流程如下: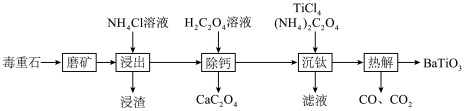
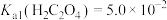 ,
,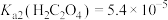 ,
, ;
;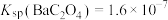 ,
,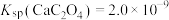 。
。回答下列问题:
(1)基态Fe原子核外电子的空间运动状态有
(2)浸渣的主要成分为
 与
与 溶液反应的原理为
溶液反应的原理为(3)若浸出液中
 ,
, ,“除钙”步骤中,当沉钙率为90%时,钡损率为
,“除钙”步骤中,当沉钙率为90%时,钡损率为(4)
 溶液显
溶液显 ,该步骤生成的能循环利用的物质是
,该步骤生成的能循环利用的物质是(5)“热解”步骤的化学方程式为
(6)
 在室温下为立方晶胞,其结构如图所示,已知Ba与O的最小间距大于Ti与O的最小间距。
在室温下为立方晶胞,其结构如图所示,已知Ba与O的最小间距大于Ti与O的最小间距。
 ,则B点微粒的坐标为
,则B点微粒的坐标为②Ti在晶胞中的位置为
您最近一年使用:0次
解题方法
3 . 以菱锌矿(主要含有ZnCO3,另含有少量CaO、Fe2O3、FeO、CoO、CuO、SiO2等)为原料电解制Zn的流程如图:
(1)“酸浸”时为提高锌的浸出率,可采取的措施有___________ (写出一种即可)。
(2)“调pH过滤”中,物质X最适宜选择___________ (填标号)。
A.NaOH B.Ca(OH)2 C.NH3·H2O
(3)“氧化过滤”中,Fe2+转化为Fe(OH)3沉淀的离子方程式为___________ 。若反应结束时,溶液pH为5,则残留的c(Fe3+)=___________ mol·L-l。
(4)H2O2是常见绿色氧化剂,原因是___________ 。
(5)“脱钙镁过滤”后,溶液中 =
=___________ 。
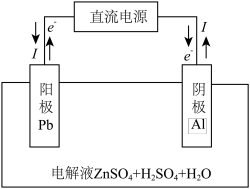
(6)“电解”装置示意如图,开始通电后,阳极表面生成PbO2,保护阳极不被酸性电解液腐蚀,相应的电极反应式为___________ 。
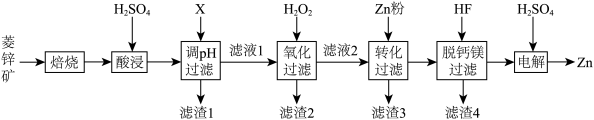
| 物质 | Fe(OH)3 | Zn(OH)2 | MgF2 | CaF2 |
| Ksp | 2.7×10-39 | 1.3×10-17 | 5.2×10-11 | 3.9×10-9 |
(1)“酸浸”时为提高锌的浸出率,可采取的措施有
(2)“调pH过滤”中,物质X最适宜选择
A.NaOH B.Ca(OH)2 C.NH3·H2O
(3)“氧化过滤”中,Fe2+转化为Fe(OH)3沉淀的离子方程式为
(4)H2O2是常见绿色氧化剂,原因是
(5)“脱钙镁过滤”后,溶液中
 =
=(6)“电解”装置示意如图,开始通电后,阳极表面生成PbO2,保护阳极不被酸性电解液腐蚀,相应的电极反应式为
您最近一年使用:0次
解题方法
4 . 下列实验操作不能达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 实验室配制FeCl3水溶液 | 将FeCl3溶于少量浓盐酸中,再加水稀释 |
| B | 除去MgCl2酸性溶液中的Fe3+ | 加入过量MgO充分搅拌,过滤 |
| C | 证明Cu(OH)2的Ksp比Mg(OH)2的小 | 将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1CuSO4溶液 |
| D | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
5 . 下列有关离子方程式书写错误的是
A.用纯碱溶液浸泡锅炉水垢(CaSO4):CaSO4(s)+ (aq) (aq)  (aq)+CaCO3(s) (aq)+CaCO3(s) |
B.泡沫灭火器工作原理:Al3++3 =Al(OH)3↓+3CO2↑ =Al(OH)3↓+3CO2↑ |
C.纯碱溶液去除油污: +H2O +H2O  +OH- +OH- |
D.明矾净水的原理:Al3++3H2O Al(OH)3↓+3H+ Al(OH)3↓+3H+ |
您最近一年使用:0次
6 . 甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的反应:CO(g)+2H2(g) CH3OH(g) △H,下表所列数据是该反应在不同温度下的化学平衡常数(K)
CH3OH(g) △H,下表所列数据是该反应在不同温度下的化学平衡常数(K)
由表中数据判断反应为___________ 热反应(填“吸”或“放”);某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为___________ ,此时的温度为___________ (从表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2kJ/mol
③H2O(g)=H2O(l) △H3kJ/mol
则CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=___________ kJ/mol(用△H1、△H2、△H3表示)
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有 )时,实验室利用如图装置模拟该法:
)时,实验室利用如图装置模拟该法:___________ 。
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10-5mol·L-1时,Cr3+沉淀完全,此时溶液的pH=___________ 。(已知,Ksp=6.4×10-31,lg2=0.3)
(1)以下是工业上合成甲醇的反应:CO(g)+2H2(g)
 CH3OH(g) △H,下表所列数据是该反应在不同温度下的化学平衡常数(K)
CH3OH(g) △H,下表所列数据是该反应在不同温度下的化学平衡常数(K)| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2kJ/mol
③H2O(g)=H2O(l) △H3kJ/mol
则CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有
 )时,实验室利用如图装置模拟该法:
)时,实验室利用如图装置模拟该法: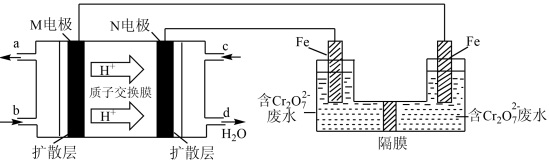
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10-5mol·L-1时,Cr3+沉淀完全,此时溶液的pH=
您最近一年使用:0次
7 . 二氧化铈 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: 能与
能与 结合成
结合成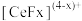 ,也能与
,也能与 结合成
结合成 ;
;
②在硫酸体系中 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。
回答下列问题:
(1)氧化焙烧中氧化的目的是_______ 。
(2)“萃取”时存在反应: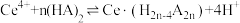 ,如图中D是分配比,表示
,如图中D是分配比,表示 分别在有机层中与水层中存在形式的物质的量浓度之比
分别在有机层中与水层中存在形式的物质的量浓度之比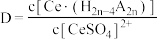 保持其它条件不变,若在起始料液中加入不同量的
保持其它条件不变,若在起始料液中加入不同量的 以改变水层中的
以改变水层中的 ,请解释D随起始料液中
,请解释D随起始料液中 变化的原因:
变化的原因:_______ 。 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:_______ 。
(4)向水层中加入 溶液来调节溶液的
溶液来调节溶液的 ,
, 应大于
应大于_______ 时, 完全生成
完全生成 沉淀。(已知
沉淀。(已知 )
)
(5)“氧化”步骤中氧化剂与还原剂物质的量之比为_______ 。
(6) 是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着
是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着 的循环,请写出
的循环,请写出 消除
消除 尾气(气体产物是空气的某一成分)的化学方程式
尾气(气体产物是空气的某一成分)的化学方程式_______ 。
(7)氧化铈 ,常用作玻璃工业添加剂,在其立方晶胞中掺杂
,常用作玻璃工业添加剂,在其立方晶胞中掺杂 ,
, 占据原来
占据原来 的位置,可以得到更稳定的结构,如图所示,
的位置,可以得到更稳定的结构,如图所示, 晶胞中
晶胞中 与最近
与最近 的核间距为
的核间距为 。(已知:
。(已知: 的空缺率
的空缺率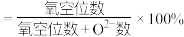 )
) 点原子的分数坐标为
点原子的分数坐标为 ,则
,则 点原子的分数坐标为
点原子的分数坐标为_______ 。
② 晶胞中与
晶胞中与 最近的
最近的 的个数为
的个数为_______ 。
③ 晶体的密度为
晶体的密度为_______ (只需列出表达式)。
④若掺杂 后得到
后得到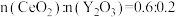 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为_______ 。
 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: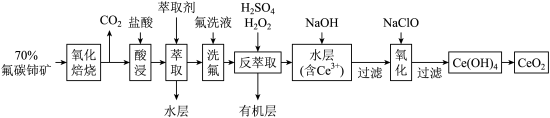
 能与
能与 结合成
结合成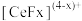 ,也能与
,也能与 结合成
结合成 ;
;②在硫酸体系中
 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。回答下列问题:
(1)氧化焙烧中氧化的目的是
(2)“萃取”时存在反应:
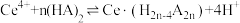 ,如图中D是分配比,表示
,如图中D是分配比,表示 分别在有机层中与水层中存在形式的物质的量浓度之比
分别在有机层中与水层中存在形式的物质的量浓度之比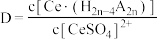 保持其它条件不变,若在起始料液中加入不同量的
保持其它条件不变,若在起始料液中加入不同量的 以改变水层中的
以改变水层中的 ,请解释D随起始料液中
,请解释D随起始料液中 变化的原因:
变化的原因: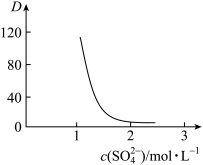
 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:(4)向水层中加入
 溶液来调节溶液的
溶液来调节溶液的 ,
, 应大于
应大于 完全生成
完全生成 沉淀。(已知
沉淀。(已知 )
)(5)“氧化”步骤中氧化剂与还原剂物质的量之比为
(6)
 是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着
是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着 的循环,请写出
的循环,请写出 消除
消除 尾气(气体产物是空气的某一成分)的化学方程式
尾气(气体产物是空气的某一成分)的化学方程式(7)氧化铈
 ,常用作玻璃工业添加剂,在其立方晶胞中掺杂
,常用作玻璃工业添加剂,在其立方晶胞中掺杂 ,
, 占据原来
占据原来 的位置,可以得到更稳定的结构,如图所示,
的位置,可以得到更稳定的结构,如图所示, 晶胞中
晶胞中 与最近
与最近 的核间距为
的核间距为 。(已知:
。(已知: 的空缺率
的空缺率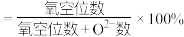 )
)
 点原子的分数坐标为
点原子的分数坐标为 ,则
,则 点原子的分数坐标为
点原子的分数坐标为②
 晶胞中与
晶胞中与 最近的
最近的 的个数为
的个数为③
 晶体的密度为
晶体的密度为④若掺杂
 后得到
后得到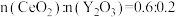 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为
您最近一年使用:0次
2024-04-24更新
|
379次组卷
|
3卷引用:福建省福建师范大学附属中学2023-2024学年高三下学期综合测试三(4月月考)化学试题
福建省福建师范大学附属中学2023-2024学年高三下学期综合测试三(4月月考)化学试题(已下线)化学(福建卷02)-2024年高考押题预测卷2024届河南省漯河市高级中学高三下学期三模理综试题-高中化学
名校
8 . 某温度下, 与不同pH的
与不同pH的 体系反应可生成不同的沉淀。下面图1表示
体系反应可生成不同的沉淀。下面图1表示 体系中各含碳粒子的物质的量分数与pH的关系。图2表示
体系中各含碳粒子的物质的量分数与pH的关系。图2表示 与不同pH的
与不同pH的 体系反应生成沉淀的情况,其中曲线Ⅰ的离子浓度关系符合
体系反应生成沉淀的情况,其中曲线Ⅰ的离子浓度关系符合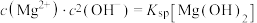 ;曲线Ⅱ的离子浓度关系符合
;曲线Ⅱ的离子浓度关系符合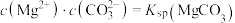 [注:起始
[注:起始 mol⋅L
mol⋅L ,不同pH下
,不同pH下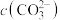 由图1得到]。
由图1得到]。
 与不同pH的
与不同pH的 体系反应可生成不同的沉淀。下面图1表示
体系反应可生成不同的沉淀。下面图1表示 体系中各含碳粒子的物质的量分数与pH的关系。图2表示
体系中各含碳粒子的物质的量分数与pH的关系。图2表示 与不同pH的
与不同pH的 体系反应生成沉淀的情况,其中曲线Ⅰ的离子浓度关系符合
体系反应生成沉淀的情况,其中曲线Ⅰ的离子浓度关系符合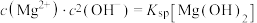 ;曲线Ⅱ的离子浓度关系符合
;曲线Ⅱ的离子浓度关系符合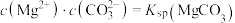 [注:起始
[注:起始 mol⋅L
mol⋅L ,不同pH下
,不同pH下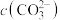 由图1得到]。
由图1得到]。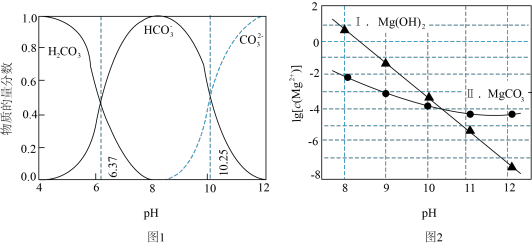
A.上述 体系呈中性时, 体系呈中性时,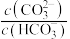 一定是 一定是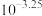 |
B.符合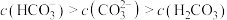 的pH范围: 的pH范围: |
C. , ,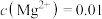 mol⋅L mol⋅L 时,溶液中存在 时,溶液中存在 和 和 两种沉淀 两种沉淀 |
D. , ,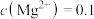 mol⋅L mol⋅L 时可发生反应: 时可发生反应: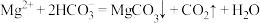 |
您最近一年使用:0次
2024-04-22更新
|
242次组卷
|
3卷引用:2024届福建省厦门第一中学高三下学期高考模拟(最后一卷)化学试题
9 . 利用席夫碱L(结构简式为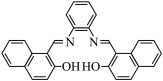 ,相对分子质量为416)制备金属缓蚀剂
,相对分子质量为416)制备金属缓蚀剂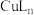 并测定其组成。
并测定其组成。
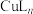 (实验装置如图,夹持装置省略)。
(实验装置如图,夹持装置省略)。向三颈烧瓶中加入席夫碱L和
 (沸点为39.8℃),将其置于35℃恒温水浴,按下图连接好仪器。滴加
(沸点为39.8℃),将其置于35℃恒温水浴,按下图连接好仪器。滴加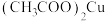 溶液,回流1h。置于冰水浴中冷却,离心分离、洗涤、干燥,得到固体
溶液,回流1h。置于冰水浴中冷却,离心分离、洗涤、干燥,得到固体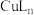 。
。
(2)控制水浴温度为35℃的原因是
(3)洗涤所用最佳试剂为______(填标号)。
| A.去离子水 | B.无水乙醇 | C.NaOH溶液 | D. 溶液 溶液 |
Ⅱ.测定
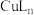 组成
组成称取0.3g
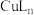 于坩埚中焙烧。将焙烧产物转入烧杯中,再加入少量稀
于坩埚中焙烧。将焙烧产物转入烧杯中,再加入少量稀 充分溶解,滴加少量NaOH溶液调节pH至3~4。将上述溶液转入锥形瓶中,加入过量KI溶液,用
充分溶解,滴加少量NaOH溶液调节pH至3~4。将上述溶液转入锥形瓶中,加入过量KI溶液,用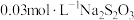 标准溶液滴定至浅黄色,加入淀粉溶液,继续滴定至浅蓝色,接近滴定终点时加入KSCN溶液,继续滴定至终点,消耗
标准溶液滴定至浅黄色,加入淀粉溶液,继续滴定至浅蓝色,接近滴定终点时加入KSCN溶液,继续滴定至终点,消耗 标准溶液20.40mL。
标准溶液20.40mL。已知:i.
 ;
;
ii.25℃时,
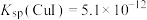 ,
,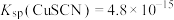 ;
; 能吸附
能吸附 。
。(4)
 与
与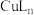 释放出的
释放出的 反应的离子方程式为
反应的离子方程式为(5)调节溶液pH至3~4的原因是
(6)加入KSCN溶液的目的是
(7)
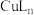 中
中
您最近一年使用:0次
解题方法
10 . 利用氟磷灰石[主要成分为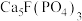 杂质为
杂质为 等]为原料生产可应用于巨型激光器“神光二号”的磷酸二氢钾(
等]为原料生产可应用于巨型激光器“神光二号”的磷酸二氢钾( ),工艺流程如下。
),工艺流程如下。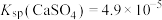 ,
,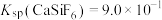 ,
,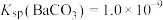 ,
,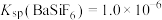 ,
,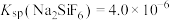 。
。
(1)“酸浸Ⅰ”中生成 ,其化学方程式为
,其化学方程式为______ 。
(2)“酸浸Ⅱ”中,滤渣的主要成分为______ 。
(3)“脱氟”中试剂X为______ (填“ ”或“
”或“ ”);当
”);当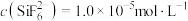 时,溶液中试剂X电离出的剩余金属阳离子的浓度为
时,溶液中试剂X电离出的剩余金属阳离子的浓度为______  。
。
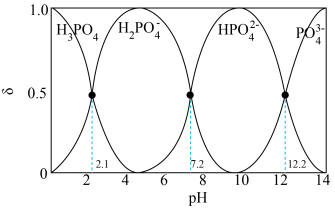
(4)“中和法”为获得较高纯度的 ,控制pH范围为
,控制pH范围为______ ;在此pH范围内纯度的 溶液中各微粒浓度大小关系为
溶液中各微粒浓度大小关系为______ 。
已知:溶液中 、
、 、
、 、
、 的分布分数
的分布分数 随pH变化曲线如图。[如
随pH变化曲线如图。[如 分布分数:
分布分数: ]
]______ 。
②分析产品室可得到 的原因
的原因______ 。
③相较于“中和法”,“电解法”的优点有______ (写出2条即可)。
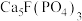 杂质为
杂质为 等]为原料生产可应用于巨型激光器“神光二号”的磷酸二氢钾(
等]为原料生产可应用于巨型激光器“神光二号”的磷酸二氢钾( ),工艺流程如下。
),工艺流程如下。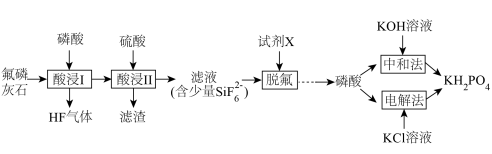
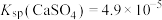 ,
,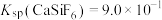 ,
,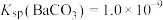 ,
,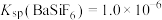 ,
,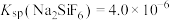 。
。(1)“酸浸Ⅰ”中生成
 ,其化学方程式为
,其化学方程式为(2)“酸浸Ⅱ”中,滤渣的主要成分为
(3)“脱氟”中试剂X为
 ”或“
”或“ ”);当
”);当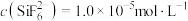 时,溶液中试剂X电离出的剩余金属阳离子的浓度为
时,溶液中试剂X电离出的剩余金属阳离子的浓度为 。
。(4)“中和法”为获得较高纯度的
 ,控制pH范围为
,控制pH范围为 溶液中各微粒浓度大小关系为
溶液中各微粒浓度大小关系为已知:溶液中
 、
、 、
、 、
、 的分布分数
的分布分数 随pH变化曲线如图。[如
随pH变化曲线如图。[如 分布分数:
分布分数: ]
]
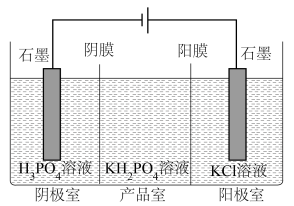
②分析产品室可得到
 的原因
的原因③相较于“中和法”,“电解法”的优点有
您最近一年使用:0次



