1 . 下列实验目的对应的实验操作正确的是
| 选项 | 实验目的 | 实验操作 |
| A | 证明酸性: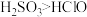 | 将 通入漂白粉溶液,观察是否变浑浊 通入漂白粉溶液,观察是否变浑浊 |
| B | 证明 溶液与 溶液与 反应后 反应后 完全沉淀 完全沉淀 | 反应后静置,取上层清液,向其中再加1滴 溶液,观察是否产生沉淀 溶液,观察是否产生沉淀 |
| C | 证明 具有氧化性 具有氧化性 | 将少量稀硫酸滴入 溶液,观察是否产生刺激性气味的气体 溶液,观察是否产生刺激性气味的气体 |
| D | 证明 和 和 溶度积的大小 溶度积的大小 | 向氢氧化钠溶液中先加入少量 溶液,充分反应后再加入少量 溶液,充分反应后再加入少量 溶液,观察沉淀颜色变化 溶液,观察沉淀颜色变化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 | 实验操作 | 实验目的或结论 |
| A | 将 固体粉末加入过量 固体粉末加入过量 溶液中,充分搅拌,溶解得到无色溶液 溶液中,充分搅拌,溶解得到无色溶液 |  既体现碱性又体现酸性 既体现碱性又体现酸性 |
| B | 向含有少量FeCl3的MgCl2溶液中加入足量粉MgO末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
| C | 向NaCl、NaI混合溶液中滴入少量AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl)大于Ksp(AgI) |
| D | 检验某有机物( | 该有机物中含有醛基 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 锑白 是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为
是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为 ,含少量的
,含少量的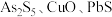 和
和 等)提取锑白的工艺流程如图所示:
等)提取锑白的工艺流程如图所示: ;
;
②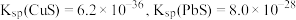 。
。
回答下列问题:
(1)“粉碎”辉锑矿的目的是___________ 。
(2)“滤渣Ⅰ”的主要成分除不溶性杂质外还有S、___________ (填化学式); 在“浸取”时发生反应的离子方程式为
在“浸取”时发生反应的离子方程式为___________ 。
(3)“除砷”时,反应中氧化剂与还原剂的物质的量之比为___________ (P转化为最高价态)。
(4)若浸取液中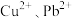 的浓度均为
的浓度均为 ,则c(S2-)≥
,则c(S2-)≥___________  才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时
才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时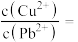
___________ 。
(5)“中和脱氯”时脱氯率与反应温度的关系如图所示:___________ 。
(6)锑可用于制备超亮光电极材料 ,其晶胞结构如图所示,晶体a的化学式为
,其晶胞结构如图所示,晶体a的化学式为___________ ,晶体b中与 距离最近的
距离最近的 的个数为
的个数为___________ 。
 是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为
是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为 ,含少量的
,含少量的 和
和 等)提取锑白的工艺流程如图所示:
等)提取锑白的工艺流程如图所示: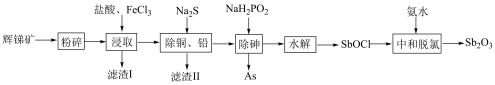
 ;
;②
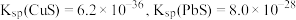 。
。回答下列问题:
(1)“粉碎”辉锑矿的目的是
(2)“滤渣Ⅰ”的主要成分除不溶性杂质外还有S、
 在“浸取”时发生反应的离子方程式为
在“浸取”时发生反应的离子方程式为(3)“除砷”时,反应中氧化剂与还原剂的物质的量之比为
(4)若浸取液中
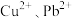 的浓度均为
的浓度均为 ,则c(S2-)≥
,则c(S2-)≥ 才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时
才能使二者完全沉淀(当离子浓度≤1×10-5mol/L时认为沉淀完全),此时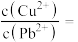
(5)“中和脱氯”时脱氯率与反应温度的关系如图所示:
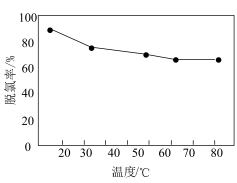
(6)锑可用于制备超亮光电极材料
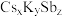 ,其晶胞结构如图所示,晶体a的化学式为
,其晶胞结构如图所示,晶体a的化学式为 距离最近的
距离最近的 的个数为
的个数为
您最近一年使用:0次
4 . 铼( )用于制造高效能火箭引擎。从辉钼矿氧化焙烧后的烟道灰(主要成分有
)用于制造高效能火箭引擎。从辉钼矿氧化焙烧后的烟道灰(主要成分有 、
、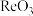 、
、 、
、 、
、 )中提取铼粉的一种工艺流程如图所示。
)中提取铼粉的一种工艺流程如图所示。
(1)“氧化浸出时,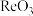 被氧化为
被氧化为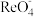 ,
,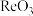 被氧化的离子方程式为
被氧化的离子方程式为____________ 。
(2)水解中和时,加 调节溶液
调节溶液 ,除钼的化合物外,滤渣1中还有
,除钼的化合物外,滤渣1中还有__________ (填化学式),此时溶液中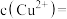
_________  。
。
(3)硫化沉淀时, 与
与 反应生成难溶的
反应生成难溶的 ,离子方程式为
,离子方程式为______________ 。
(4)“离子交换”“解吸”“树脂再生”一系列步骤中物质转化关系如图所示。____________ (填化学式)。
②“解吸”所用 中的阴离子的空间构型为
中的阴离子的空间构型为__________ 。
(5)铼的某种氧化物的晶胞如图所示,铼原子填在氧原子围成的__________ (“填四面体”、“立方体”或“八面体”)空隙中。
 )用于制造高效能火箭引擎。从辉钼矿氧化焙烧后的烟道灰(主要成分有
)用于制造高效能火箭引擎。从辉钼矿氧化焙烧后的烟道灰(主要成分有 、
、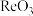 、
、 、
、 、
、 )中提取铼粉的一种工艺流程如图所示。
)中提取铼粉的一种工艺流程如图所示。
 |  |  | |
开始沉淀 | 2.5 | 7.0 | 5.7 |
完全沉淀 (金属离子浓度 (金属离子浓度 ) ) | 3.2 | 9.0 | 6.7 |
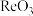 被氧化为
被氧化为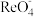 ,
,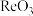 被氧化的离子方程式为
被氧化的离子方程式为(2)水解中和时,加
 调节溶液
调节溶液 ,除钼的化合物外,滤渣1中还有
,除钼的化合物外,滤渣1中还有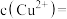
 。
。(3)硫化沉淀时,
 与
与 反应生成难溶的
反应生成难溶的 ,离子方程式为
,离子方程式为(4)“离子交换”“解吸”“树脂再生”一系列步骤中物质转化关系如图所示。

②“解吸”所用
 中的阴离子的空间构型为
中的阴离子的空间构型为(5)铼的某种氧化物的晶胞如图所示,铼原子填在氧原子围成的

您最近一年使用:0次
名校
解题方法
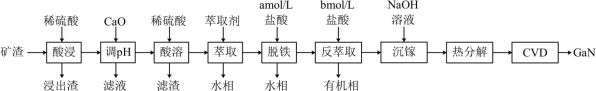
5 . 氮化镓(GaN)具有优异的光电性能。一种利用炼锌矿渣[主要含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4、SiO2]制备GaN的工艺流程如下:
②常温下,Ksp[Zn(OH)2]=10-16.6,Ksp[Ga(OH)3]=10-35.1,Ksp[Fe(OH)3]=10-38.5。
③Ga3+、Fe3+在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
回答下列问题:
(1)“酸浸”时能提高反应速率的措施有____________ (答1条即可)
(2)“酸浸”所得浸出液中Ga3+、Zn2+浓度分别为0.21g/L、65g/L。常温下,为尽可能多地提取Ga3+并确保不混入Zn(OH)2,用CaO“调pH”时须不能大于___________ (假设调pH时溶液体积不变)
(3)“脱铁”和“反萃取”时,所用盐酸的浓度a=________ mol/L,b=______ mol/L(选填上表中盐酸的浓度)。
(4)“沉镓”时,若加入NaOH的量过多,会导致Ga3+的沉淀率降低,原因是___________ (用离子方程式表示)。
(5)利用CVD(化学气相沉积)技术,将热分解得到的Ga2O3与NH3在高温下反应可制得GaN,同时生成另一种产物,该反应化学方程式为_______________ 。
(6)GaN晶体的一种立方晶胞如图下所示。________ 种空间运动状态。
②该晶胞边长为anm,GaN的相对分子质量为Mr,则该晶体密度为_________ g/cm3(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
②常温下,Ksp[Zn(OH)2]=10-16.6,Ksp[Ga(OH)3]=10-35.1,Ksp[Fe(OH)3]=10-38.5。
③Ga3+、Fe3+在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
| 盐酸浓度/mol/L | 反萃取率/% | |
| Ga3+ | Fe3+ | |
| 2 | 86.9 | 9.4 |
| 4 | 69.1 | 52.1 |
| 6 | 17.5 | 71.3 |
(1)“酸浸”时能提高反应速率的措施有
(2)“酸浸”所得浸出液中Ga3+、Zn2+浓度分别为0.21g/L、65g/L。常温下,为尽可能多地提取Ga3+并确保不混入Zn(OH)2,用CaO“调pH”时须不能大于
(3)“脱铁”和“反萃取”时,所用盐酸的浓度a=
(4)“沉镓”时,若加入NaOH的量过多,会导致Ga3+的沉淀率降低,原因是
(5)利用CVD(化学气相沉积)技术,将热分解得到的Ga2O3与NH3在高温下反应可制得GaN,同时生成另一种产物,该反应化学方程式为
(6)GaN晶体的一种立方晶胞如图下所示。

②该晶胞边长为anm,GaN的相对分子质量为Mr,则该晶体密度为
 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
名校
6 . 一种回收锌电解阳极泥(生要成分为 和
和 ,还有少量猛铅氧化物
,还有少量猛铅氧化物 和
和 )中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题:
)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题: 易溶于水,不溶于乙醇。
易溶于水,不溶于乙醇。
② 时,
时,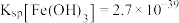
③在较高温度及酸性催化条件下,葡萄糖能发生如下反应: 的最外层电子的电子排布式为
的最外层电子的电子排布式为_______ 。
(2)“还原酸浸”过程中主要反应的化学方程式为_______ ;实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,其原因是_______ 。
(3)结合 溶解度曲线图分析,由
溶解度曲线图分析,由 溶液制得
溶液制得 晶体的“一系列操作”是
晶体的“一系列操作”是_______ ,用_______ (填物质的名称)洗涤、干澡。 与水反应生成二元弱酸
与水反应生成二元弱酸 ,在阴极放电生成
,在阴极放电生成 单质,有利于
单质,有利于 电还原沉积。则
电还原沉积。则 放电的电极反应式为
放电的电极反应式为_______ 。
(5)整个流程中可循环利用的物质是_______ 。
(6)取“沉铁”操作所得的沉淀物置于 水中,常温下充分溶解(忽略溶液体积的变化),其中沉淀物中若含有
水中,常温下充分溶解(忽略溶液体积的变化),其中沉淀物中若含有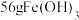 ,最终所得溶液中
,最终所得溶液中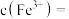
_______  。
。
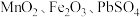 和
和 ,还有少量猛铅氧化物
,还有少量猛铅氧化物 和
和 )中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题:
)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题: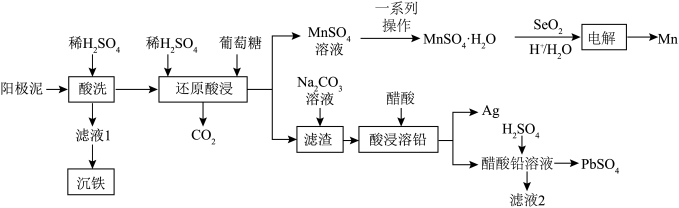
 易溶于水,不溶于乙醇。
易溶于水,不溶于乙醇。②
 时,
时,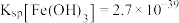
③在较高温度及酸性催化条件下,葡萄糖能发生如下反应:
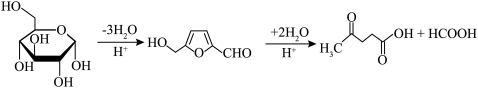
 的最外层电子的电子排布式为
的最外层电子的电子排布式为(2)“还原酸浸”过程中主要反应的化学方程式为
(3)结合
 溶解度曲线图分析,由
溶解度曲线图分析,由 溶液制得
溶液制得 晶体的“一系列操作”是
晶体的“一系列操作”是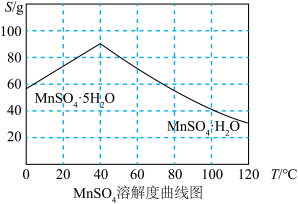
 与水反应生成二元弱酸
与水反应生成二元弱酸 ,在阴极放电生成
,在阴极放电生成 单质,有利于
单质,有利于 电还原沉积。则
电还原沉积。则 放电的电极反应式为
放电的电极反应式为(5)整个流程中可循环利用的物质是
(6)取“沉铁”操作所得的沉淀物置于
 水中,常温下充分溶解(忽略溶液体积的变化),其中沉淀物中若含有
水中,常温下充分溶解(忽略溶液体积的变化),其中沉淀物中若含有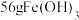 ,最终所得溶液中
,最终所得溶液中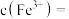
 。
。
您最近一年使用:0次
解题方法
7 . 硫酸镍( ,易溶于水)是一种重要的化工原料,主要应用于石油化工、机械制造、医药、动力电池制造及电镀等行业领域中.利用铜冶炼过程中产生的副产物粗硫酸镍制备
,易溶于水)是一种重要的化工原料,主要应用于石油化工、机械制造、医药、动力电池制造及电镀等行业领域中.利用铜冶炼过程中产生的副产物粗硫酸镍制备 的工艺流程如下:
的工艺流程如下: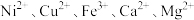 等多种离子;
等多种离子;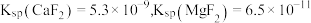 ,离子浓度
,离子浓度 即可认为沉淀完全.
即可认为沉淀完全.
回答下列问题:
(1)“滤渣1”的主要成分是________ (写化学式);
(2)NaHS作“除铜”沉淀剂的缺点是_______ ;
(3)对萃取剂进行皂化是一种强化萃取的常见方法,“萃镍”时加入HBL110萃取剂的同时加入NaOH溶液对萃取剂进行皂化,可以提高镍萃取率,从平衡移动的角度分析原因_____________ .萃取剂皂化率对金属阳离子的萃取率影响如图所示,皂化率最佳取值为_________ .结合图中信息分析,实际生产中将“滤液A”返回至“萃取”工序的原因为__________________ ;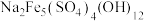 ],“除铁”的离子方程式为
],“除铁”的离子方程式为________ ;
(5)若溶液中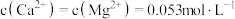 ,“除
,“除 ”时,缓慢滴加NaF溶液,则先产生的沉淀1是
”时,缓慢滴加NaF溶液,则先产生的沉淀1是________ (填化学式),当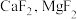 开始共沉淀时,溶液中“沉淀1”是否沉淀完全?
开始共沉淀时,溶液中“沉淀1”是否沉淀完全?____________ (填“是”或“否”);
(6)滴定法测定 产品中镍元素含量:取3.00g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中,滴入几滴紫脲酸胺指示剂,用浓度为
产品中镍元素含量:取3.00g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中,滴入几滴紫脲酸胺指示剂,用浓度为 的
的 标准液滴定,重复操作2~3次,平均消耗
标准液滴定,重复操作2~3次,平均消耗 标准液17.60mL;
标准液17.60mL;
已知:ⅰ. ;ⅱ.紫脲酸胺:紫色试剂,遇
;ⅱ.紫脲酸胺:紫色试剂,遇 显橙黄色。
显橙黄色。
①滴定至终点时溶液颜色变化为___________ ;
②样品中镍元素的质量分数为__________ %(保留3位有效数字)。
 ,易溶于水)是一种重要的化工原料,主要应用于石油化工、机械制造、医药、动力电池制造及电镀等行业领域中.利用铜冶炼过程中产生的副产物粗硫酸镍制备
,易溶于水)是一种重要的化工原料,主要应用于石油化工、机械制造、医药、动力电池制造及电镀等行业领域中.利用铜冶炼过程中产生的副产物粗硫酸镍制备 的工艺流程如下:
的工艺流程如下: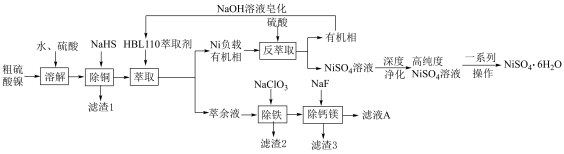
 等多种离子;
等多种离子;②HBL110萃取剂是由酯类有机物B与磺酸类有机物HA按一定比例混合组成,萃取 原理为:
原理为: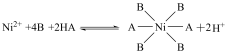 ;
;
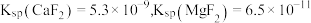 ,离子浓度
,离子浓度 即可认为沉淀完全.
即可认为沉淀完全.回答下列问题:
(1)“滤渣1”的主要成分是
(2)NaHS作“除铜”沉淀剂的缺点是
(3)对萃取剂进行皂化是一种强化萃取的常见方法,“萃镍”时加入HBL110萃取剂的同时加入NaOH溶液对萃取剂进行皂化,可以提高镍萃取率,从平衡移动的角度分析原因
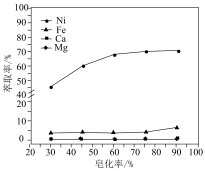
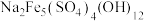 ],“除铁”的离子方程式为
],“除铁”的离子方程式为(5)若溶液中
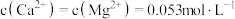 ,“除
,“除 ”时,缓慢滴加NaF溶液,则先产生的沉淀1是
”时,缓慢滴加NaF溶液,则先产生的沉淀1是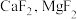 开始共沉淀时,溶液中“沉淀1”是否沉淀完全?
开始共沉淀时,溶液中“沉淀1”是否沉淀完全?(6)滴定法测定
 产品中镍元素含量:取3.00g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中,滴入几滴紫脲酸胺指示剂,用浓度为
产品中镍元素含量:取3.00g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中,滴入几滴紫脲酸胺指示剂,用浓度为 的
的 标准液滴定,重复操作2~3次,平均消耗
标准液滴定,重复操作2~3次,平均消耗 标准液17.60mL;
标准液17.60mL;已知:ⅰ.
 ;ⅱ.紫脲酸胺:紫色试剂,遇
;ⅱ.紫脲酸胺:紫色试剂,遇 显橙黄色。
显橙黄色。①滴定至终点时溶液颜色变化为
②样品中镍元素的质量分数为
您最近一年使用:0次
8 . 镍、钴及其化合物在工业上有广泛的应用。以含镍废料(主要成分为NiO,含少量FeO、 、CoO、BaO和
、CoO、BaO和 )为原料制备
)为原料制备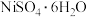 和
和 的工艺流程如下。
的工艺流程如下。
(1)基态Co原子的价层电子的轨道表示式为___________ 。
(2)“滤渣Ⅰ”主要成分是___________ (填化学式)。
(3)“调pH”过程中生成黄钠铁钒沉淀,该反应的离子方程式为___________ 。
(4)“萃取”时需充分振荡,目的是___________ 。“萃取”和“反萃取”可简单表示为: 。在萃取过程中加入适量氨水,其作用是
。在萃取过程中加入适量氨水,其作用是___________ 。“反萃取”需要往有机层中加___________ (填试剂名称)。
(5)常温下,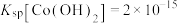 ,若起始时
,若起始时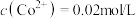 ,“沉钴”过程中应控制pH<
,“沉钴”过程中应控制pH<___________ 。
(6) 在空气中能受热分解,测得剩余固体的质量与起始
在空气中能受热分解,测得剩余固体的质量与起始 的质量的比值(剩余固体的质量分数)随温度变化曲线如图所示。
的质量的比值(剩余固体的质量分数)随温度变化曲线如图所示。 固体置于热解装置中,通入空气流,在
固体置于热解装置中,通入空气流,在___________ ℃(填范围)煅烧至恒重即可得到 。由
。由 制备
制备 总的反应方程式为
总的反应方程式为___________ 。
 、CoO、BaO和
、CoO、BaO和 )为原料制备
)为原料制备 和
和 的工艺流程如下。
的工艺流程如下。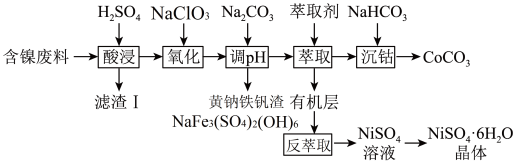
(1)基态Co原子的价层电子的轨道表示式为
(2)“滤渣Ⅰ”主要成分是
(3)“调pH”过程中生成黄钠铁钒沉淀,该反应的离子方程式为
(4)“萃取”时需充分振荡,目的是
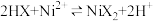 。在萃取过程中加入适量氨水,其作用是
。在萃取过程中加入适量氨水,其作用是(5)常温下,
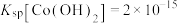 ,若起始时
,若起始时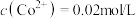 ,“沉钴”过程中应控制pH<
,“沉钴”过程中应控制pH<(6)
 在空气中能受热分解,测得剩余固体的质量与起始
在空气中能受热分解,测得剩余固体的质量与起始 的质量的比值(剩余固体的质量分数)随温度变化曲线如图所示。
的质量的比值(剩余固体的质量分数)随温度变化曲线如图所示。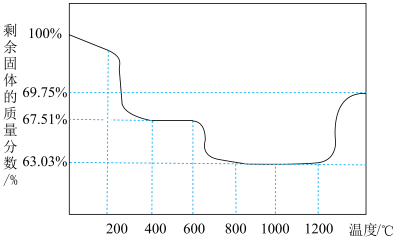
 固体置于热解装置中,通入空气流,在
固体置于热解装置中,通入空气流,在 。由
。由 制备
制备 总的反应方程式为
总的反应方程式为
您最近一年使用:0次
名校
9 . 下列含硫化合物的反应中,离子方程式正确的是
A.将SO2通入NaClO溶液中: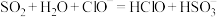 |
B.向硫酸铜溶液中加入NaHS溶液生成黑色沉淀: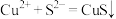 |
C.向硫代硫酸钠溶液中加入硫酸: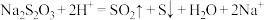 |
D.水垢中的CaSO4用Na2CO3溶液处理: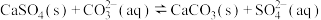 |
您最近一年使用:0次
7日内更新
|
181次组卷
|
2卷引用:安徽省合肥市2024届高三第三次教学质量检测化学试题
10 . 下列实验中,操作、现象、解释或结论均正确的是
序号 | 操作 | 现象 | 解释或结论 |
A | 用NaOH标准溶液滴定稀硫酸待测液时,用温度传感器采集锥形瓶内溶液温度变化 | 记录温度传感器显示的起始温度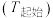 、最高温度 、最高温度 | 用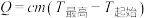 计算反应中的热量变化 计算反应中的热量变化 |
B | 室温下,将等质量镁(足量)分别放入等体积 的HA、HB两种酸溶液中 的HA、HB两种酸溶液中 | 只生成 ,且2分钟后酸HA收集到的 ,且2分钟后酸HA收集到的 更多 更多 | 酸性: |
C |  溶液中加入足量 溶液中加入足量 溶液,再加入 溶液,再加入 溶液 溶液 | 先出现白色沉淀,后变生黑色沉淀 | 相同温度下, |
D | 将己烷与溴水的混合液置于光亮处 | 一段时间后,溴水褪色 | 己烷与 在光照下发生了取代反应 在光照下发生了取代反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次

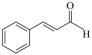 )中是否含有醛基
)中是否含有醛基

