名校
1 . 氟和氯是两种典型的卤族元素。回答下列问题:
(1)氟与氯化学性质相似,写出NaF的电子式:___________ 。根据元素周期律知识,写出氢气和氟气反应的化学方程式(标出反应条件):___________ 。
(2)氧元素的非金属性___________ (填“强于”或“弱于”)氯元素,你的理由是___________ 。根据HF的___________ (选填编号)大于H2O,可推断氟元素的非金属性强于氧元素。
A.酸性 B.熔沸点 C.稳定性 D.键的极性
(3)不同卤素原子之间形成的化合物叫做卤素互化物,如ClF、ICl、BrF3等。ClF是___________ 化合物(填“离子”或“共价”),它遇水发生复分解反应,试写出该反应的化学方程式:___________ 。
(4)盐酸(氢氯酸)和氢氟酸都是一元酸。某温度下,相同pH的盐酸和氢氟酸溶液分别加水稀释,溶液的pH随溶液体积变化的曲线如下图所示。据图判断:
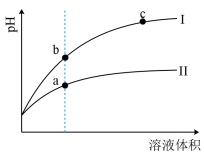
①盐酸稀释时的pH变化曲线为___________ (填“Ⅰ”或“Ⅱ”),溶液的导电性b___________ c(填“>”、“<”或“=”)。
②比较两种溶液中水电离的[H+]:a点___________ b点(填“>”、“<”或“=”)。从电离平衡移动原理解释原因:___________ 。
(1)氟与氯化学性质相似,写出NaF的电子式:
(2)氧元素的非金属性
A.酸性 B.熔沸点 C.稳定性 D.键的极性
(3)不同卤素原子之间形成的化合物叫做卤素互化物,如ClF、ICl、BrF3等。ClF是
(4)盐酸(氢氯酸)和氢氟酸都是一元酸。某温度下,相同pH的盐酸和氢氟酸溶液分别加水稀释,溶液的pH随溶液体积变化的曲线如下图所示。据图判断:

①盐酸稀释时的pH变化曲线为
②比较两种溶液中水电离的[H+]:a点
您最近半年使用:0次
名校
2 . 常温下,pH均为4的稀硫酸和硫酸铝溶液加水稀释时如图所示,下列说法正确的是
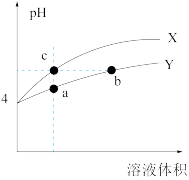

| A.加水稀释前两溶液的导电能力相同 |
| B.a点和b点溶液中n(H+):b>a |
| C.b、c两点的溶液中水电离出的c(H+)相等 |
| D.a、c点对应的两溶液中,稀硫酸中c水(H+)与硫酸铝溶液中c水(H+)的比值比稀释前的比值小 |
您最近半年使用:0次
2021-08-31更新
|
342次组卷
|
3卷引用:河南省南阳市第一中学校2022届高三上学期第一次月考化学试题
名校
3 . 取pH=11的X、Y两种碱溶液各10 mL,将其分别稀释至1000 mL,稀释过程中其pH与溶液体积(V)的关系如图所示。下列说法中,正确的是
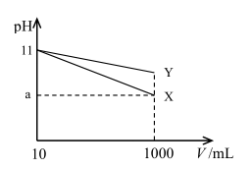
| A.稀释前,X、Y两种碱溶液的物质的量浓度一定相等 |
| B.稀释后,X溶液中c(OH- )比Y溶液中c(OH-)大 |
| C.若a>9,则X、Y都是弱碱 |
| D.用同浓度盐酸中和X、Y两溶液,完全中和时消耗的盐酸体积Vx> Vy |
您最近半年使用:0次
2021-08-01更新
|
2604次组卷
|
13卷引用:2016年广东和广西高中学生化学竞赛试题
2016年广东和广西高中学生化学竞赛试题(已下线)第三章 第二节水的电离和溶液的酸碱性(第2课时 溶液的pH的计算)(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)(已下线)第3章 水溶液中的离子平衡(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)河北省大名县第一中学2021-2022学年高二上学期10月半月考化学试题(已下线)3.2.1 溶液的酸碱性-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)3.2.2 溶液的pH(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)宁夏青铜峡市高级中学2021-2022学年高二下学期开学考试化学试题四川省资阳中学2021-2022学年高二下学期3月月考化学试题大庆市肇州县肇州中学2021-2022学年高二上学期第二次月考化学试题河北省石家庄新乐市第一中学2022-2023学年高二上学期第一次月考化学试题福建省泉州市石狮市石光中学2022-2023学年高二上学期期中考试化学试题湖北省十堰市汉江中学2021-2022学年高二上学期期中考试化学试题江西省南昌十九中2023-2024学年高二上学期期中考试化学试卷
名校
4 . 下列图示与对应的叙述相符的是
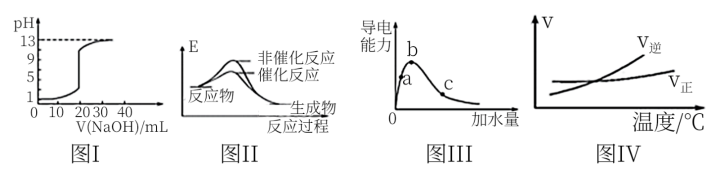

A.图Ⅰ表示常温下,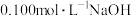 溶液滴定 溶液滴定 、 、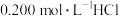 溶液所得到的滴定曲线 溶液所得到的滴定曲线 |
| B.图Ⅱ表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
C.图Ⅲ表示一定质量的冰醋酸加水稀释过程,醋酸溶液电离程度: |
D.根据图Ⅳ可判断可逆反应 的 的 |
您最近半年使用:0次
2021-07-14更新
|
286次组卷
|
4卷引用:广东省湛江市2020-2021学年高二下学期期末调研考试化学试题
5 . 下列图示与对应叙述相符的是
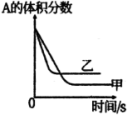 图1 | 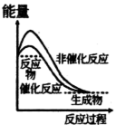 图2 | 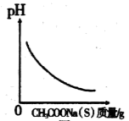 图3 | 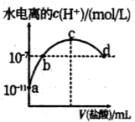 图4 |
A.图1表示压强对可逆反应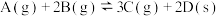 的影响,乙的压强大 的影响,乙的压强大 |
| B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
C.图3表示在 溶液中逐步加入 溶液中逐步加入 固体后,溶液pH的变化 固体后,溶液pH的变化 |
D.图4表示常温下向20mL 0.1mol/L氨水中滴加稀盐酸,c点溶液中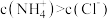 |
您最近半年使用:0次
6 . 下图示出在碳酸-碳酸盐体系( 的分析浓度为1.0×10-2mol·L-1)中,铀的存在物种及相关电极电势随pH的变化关系(E-pH图,以标准氢电极为参比电极)。作为比较,虚线示出H+/H2和O2/H2O两电对的E-pH关系。
的分析浓度为1.0×10-2mol·L-1)中,铀的存在物种及相关电极电势随pH的变化关系(E-pH图,以标准氢电极为参比电极)。作为比较,虚线示出H+/H2和O2/H2O两电对的E-pH关系。
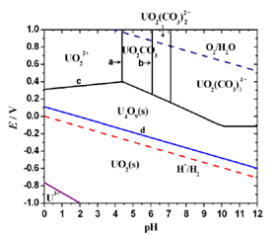
(1)计算在pH分别为4.0和6.0的条件下,碳酸-碳酸盐体系中主要物种的浓度_______ 。(H2CO3:Ka1=4.5×10-7,Ka2=4.7×10-11)
(2)图中a和b分别是pH=4.4和6.1的两条直线。分别写出与a和b相对应的铀的物种发生转化的方程式_________ 。
(3)分别写出与直线c和d相对应的电极反应_____ 、_____ ,并说明其斜率为正或负的原因。
(4)在pH=4.0的缓冲体系中,加入UCl3,写出反应方程式________ 。
(5)在pH=8.0~12之间,体系中UO2(CO3)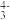 和U4O9(s)能否共存
和U4O9(s)能否共存_______ ?说明理由_______ ;UO2(CO3)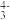 和UO2(s)能否共存
和UO2(s)能否共存________ ?说明理由________ 。
 的分析浓度为1.0×10-2mol·L-1)中,铀的存在物种及相关电极电势随pH的变化关系(E-pH图,以标准氢电极为参比电极)。作为比较,虚线示出H+/H2和O2/H2O两电对的E-pH关系。
的分析浓度为1.0×10-2mol·L-1)中,铀的存在物种及相关电极电势随pH的变化关系(E-pH图,以标准氢电极为参比电极)。作为比较,虚线示出H+/H2和O2/H2O两电对的E-pH关系。
(1)计算在pH分别为4.0和6.0的条件下,碳酸-碳酸盐体系中主要物种的浓度
(2)图中a和b分别是pH=4.4和6.1的两条直线。分别写出与a和b相对应的铀的物种发生转化的方程式
(3)分别写出与直线c和d相对应的电极反应
(4)在pH=4.0的缓冲体系中,加入UCl3,写出反应方程式
(5)在pH=8.0~12之间,体系中UO2(CO3)
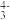 和U4O9(s)能否共存
和U4O9(s)能否共存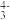 和UO2(s)能否共存
和UO2(s)能否共存
您最近半年使用:0次
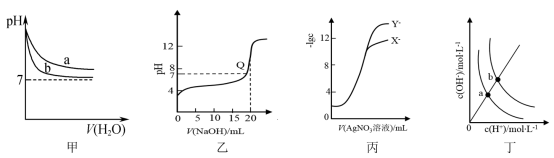
7 . 根据下列图示所得出的结论正确的是

A.图甲表示 和体积相同的 和体积相同的 溶液与氨水稀释过程 溶液与氨水稀释过程 的变化,曲线a对应氨水 的变化,曲线a对应氨水 |
B.图乙是常温下用  溶液滴定 溶液滴定   的滴定曲线,Q点表示酸碱中和滴定终点 的滴定曲线,Q点表示酸碱中和滴定终点 |
C.图丙表示用  溶液滴定浓度均为 溶液滴定浓度均为 的 的 、 、 混合溶液时, 混合溶液时,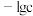 随 随 溶液体积的变化,说明 溶液体积的变化,说明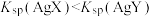 |
D.图丁表示不同温度水溶液中 和 和 的浓度变化,图中a点对应温度高于b点 的浓度变化,图中a点对应温度高于b点 |
您最近半年使用:0次
2021-07-02更新
|
273次组卷
|
3卷引用:江苏省徐州市2020-2021学年高二下学期期末抽测化学试题
名校
解题方法
8 . 下列叙述及对应图示正确的是
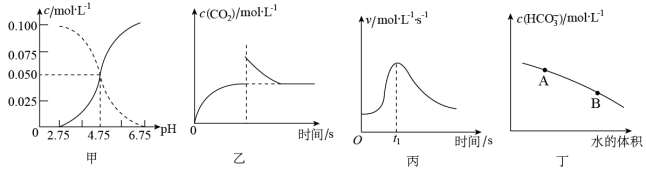

| A.图甲是某温度下c(CH3COOH)+c(CH3COO-)=0.100mol•L-1的醋酸与醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH的关系曲线,pH=3的溶液中:Ka<10-4.75 |
| B.图乙是恒温密闭容器中发生CaCO3(s)=CaO(s)+CO2(g)反应时,c(CO2)随反应时间变化的曲线,t1时刻改变的条件可能是缩小容器的体积 |
| C.图丙是铁条与盐酸反应的反应速率随反应时间变化的曲线,t1时刻溶液的温度最高 |
D.图丁是在0.1mol•L-1Na2CO3溶液中加水稀释,随着加水量的增加,溶液中c(HCO )的变化曲线,则Na2CO3的水解程度A点大于B点 )的变化曲线,则Na2CO3的水解程度A点大于B点 |
您最近半年使用:0次
2021-07-01更新
|
1845次组卷
|
8卷引用:江苏省常州市教育学会2020-2021学年高二下学期期末学业水平监测化学试题
名校
9 . 下列图示与对应的叙述相符合的是
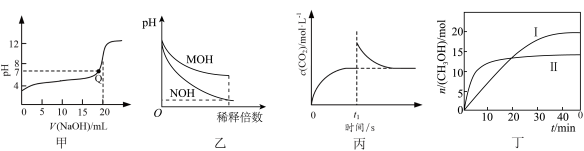

| A.图甲是常温下用0.100 mol/LNaOH溶液滴定20.00 mL 0.1000 mol/L CH3COOH的滴定曲线,Q点表示酸碱中和滴定终点 |
| B.图乙表示常温下稀释pH均为11的MOH溶液和NOH溶液时pH的变化,由图可知溶液的碱性:MOH>NOH |
C.图丙是恒温密闭容器中发生CaCO3(s) CaO(s)+CO2(g)反应时c(CO2)随反应时间变化的曲线,t1时刻改变的条件可能是缩小容器的体积 CaO(s)+CO2(g)反应时c(CO2)随反应时间变化的曲线,t1时刻改变的条件可能是缩小容器的体积 |
D.图丁表示恒容密闭容器中其它条件相同时改变温度,反应CO2(g)+3H2(l)  CH3OH(g)+H2O(g)中,n(CH3OH)随时间变化的曲线,说明反应平衡常数KII>KI CH3OH(g)+H2O(g)中,n(CH3OH)随时间变化的曲线,说明反应平衡常数KII>KI |
您最近半年使用:0次
2021-06-20更新
|
303次组卷
|
4卷引用:江苏省镇江第一中学2020-2021学年高二下学期期末模拟检测化学试题
10 . 根据下列各图曲线表征的信息,得出的结论错误的是
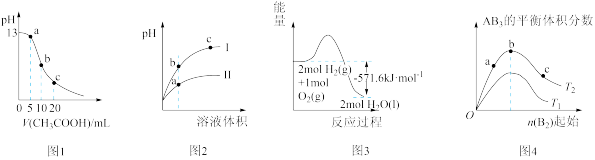

| A.图1表示常温下向体积为10 mL 0.1 mol·L-1的NaOH溶液中逐滴加入0.1 mol·L-1 CH3COOH溶液后溶液的pH变化曲线,则水的电离程度:b点>a点 |
| B.图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a |
| C.图3表示H2与O2发生反应过程中的能量变化,表示H2燃烧热的ΔH=-285.8 kJ·mol-1 |
D.图4表示反应A2(g)+3B2(g) 2AB3(g),达到平衡时A2的转化率大小为:a<b<c 2AB3(g),达到平衡时A2的转化率大小为:a<b<c |
您最近半年使用:0次
2021-06-08更新
|
207次组卷
|
2卷引用:四川省达州市大竹中学2020-2021学年高二下学期4月月考化学试题



