名校
1 . 硫酸和醋酸都是重要的化工原料,在生产、科研中用途广泛。回答下列问题:
(1)①某温度(t℃)时,水的离子积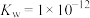 ,则t℃
,则t℃___________ 25℃(填“>”“<”或“=”)。此温度下,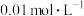 的氨水中
的氨水中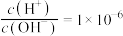 ,则该氨水溶液的pH=
,则该氨水溶液的pH=___________ ;
②将室温下pH=11的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得混合溶液的pH=3,则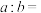
___________ 。
(2)某兴趣小组设计了如下实验,探究不同条件对KI溶液(硫酸酸化)被空气中O2氧化反应速率的影响:
①请完成下表(硫酸、KI溶液体积均为5mL,淀粉溶液用量相同):
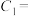
___________ ,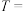
___________ 。
②该实验中通过观察___________ 实验现象判断反应的快慢。为此,该实验中三种溶液混合的顺序不合理的是___________ 。
a.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
b.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
c.先将KI溶液与硫酸溶液混合,然后再加入淀粉溶液
(3)25℃时,某Na2SO4溶液中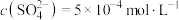 ,取该溶液1mL加水稀释至100mL,则稀释后溶液中
,取该溶液1mL加水稀释至100mL,则稀释后溶液中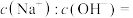
___________ 。
(4)在室温下,蒸馏水稀释0.01mol/LHA(HA为弱酸)溶液时,下列呈减小趋势的是___________。
(1)①某温度(t℃)时,水的离子积
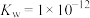 ,则t℃
,则t℃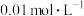 的氨水中
的氨水中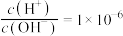 ,则该氨水溶液的pH=
,则该氨水溶液的pH=②将室温下pH=11的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得混合溶液的pH=3,则
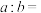
(2)某兴趣小组设计了如下实验,探究不同条件对KI溶液(硫酸酸化)被空气中O2氧化反应速率的影响:
①请完成下表(硫酸、KI溶液体积均为5mL,淀粉溶液用量相同):
| 实验编号 | T/K |  | 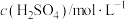 | 实验目的 |
| I | 298 | 1 | 0.1 | 实验I和II探究温度对该反应速率的影响;实验I和III探究反应物浓度对该反应速率的影响 |
| II | 308 |  |  | |
| III | T | 1 | 0.2 |
②该实验中通过观察
a.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
b.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
c.先将KI溶液与硫酸溶液混合,然后再加入淀粉溶液
(3)25℃时,某Na2SO4溶液中
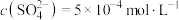 ,取该溶液1mL加水稀释至100mL,则稀释后溶液中
,取该溶液1mL加水稀释至100mL,则稀释后溶液中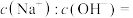
(4)在室温下,蒸馏水稀释0.01mol/LHA(HA为弱酸)溶液时,下列呈减小趋势的是___________。
| A.水的电离程度 | B. |
C.溶液中 和 和 的乘积 的乘积 | D.溶液中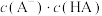 的值 的值 |
您最近一年使用:0次
名校
2 . 下列实验操作或做法正确且能达到目的的是
| 选项 | 实验操作或实验做法 | 实验目的 |
| A | 将过量 通入溴水中,溴水褪色 通入溴水中,溴水褪色 | 证明 具有漂白性 具有漂白性 |
| B | 向 溶液中通入少量的 溶液中通入少量的 生成白色沉淀 生成白色沉淀 | 证明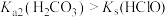 |
| C | 向盛有2  溶液的试管中滴加浓的维生素C溶液,观察颜色变化 溶液的试管中滴加浓的维生素C溶液,观察颜色变化 | 探究维生素C的还原性 |
| D | 向2支盛有5 不同浓度 不同浓度 溶液的试管中同时加入2 溶液的试管中同时加入2 0.2 0.2  溶液,观察实验现象 溶液,观察实验现象 | 探究浓度对化学反应速率的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-26更新
|
250次组卷
|
4卷引用:黑龙江省海伦市第一中学2022-2023学期高三上学期期中考试化学试卷题
黑龙江省海伦市第一中学2022-2023学期高三上学期期中考试化学试卷题(已下线)云南师范大学附属中学2023-2024学年高三上学期开学考试化学试题云南师范大学附属中学2023-2024学年高三上学期开学考试化学试题山东省菏泽市鄄城县第一中学2023-2024学年高三上学期1月月考化学试题
3 . 生活处处有化学,化学知识无处不在。用所学知识解释工业、生产、生活与科研中的相关现象。
(1)写出H2C2O4在溶液中发生第一步电离的方程式:_______ ,写出该步电离常数的表达式Ka1=_______ 。
(2)水的离子积表达式Kw=_______ 。常温下0.01 mol/L HCl 溶液的水电离出的 c(H +)=_______ pH=11的CH3 COONa 溶液中由水电离产生的 c(OH-)=_______ 。
(3)CH3COONa溶液呈碱性的原因_______ (用离子方程式)。
(4)将饱和FeCl3的水溶液加入沸水中可以制备胶体,原因是:_______ (用离子方程式表示)。如果加热制备所得胶体,观察到颜色变化为_______ 。
(5)学过的平衡常数有化学平衡常数(K)、电离平衡常数(Ka\Kb)、水的离子积常数(Kw)、盐的水解常数(Kh),后面还会学习沉淀溶解平衡,其常数叫溶度积Ksp。其实这些常数有很多相似之处。任写一点_______ 。(符合题意的答案,均可给分)
(6)如除去MgCl2溶液中Fe3+需要的除杂试剂是_______ 。
(7)泡沫灭火器中筒体内的硫酸铝酸性溶液与碳酸氢钠碱性溶液混合发生化学反应,将生成的泡沫压出喷嘴, 喷射出去进行灭火的。写出对应的离子方程式_______ 。
(1)写出H2C2O4在溶液中发生第一步电离的方程式:
(2)水的离子积表达式Kw=
(3)CH3COONa溶液呈碱性的原因
(4)将饱和FeCl3的水溶液加入沸水中可以制备胶体,原因是:
(5)学过的平衡常数有化学平衡常数(K)、电离平衡常数(Ka\Kb)、水的离子积常数(Kw)、盐的水解常数(Kh),后面还会学习沉淀溶解平衡,其常数叫溶度积Ksp。其实这些常数有很多相似之处。任写一点
(6)如除去MgCl2溶液中Fe3+需要的除杂试剂是
(7)泡沫灭火器中筒体内的硫酸铝酸性溶液与碳酸氢钠碱性溶液混合发生化学反应,将生成的泡沫压出喷嘴, 喷射出去进行灭火的。写出对应的离子方程式
您最近一年使用:0次
名校
解题方法
4 . 在未来能源领域——“人造太阳”计划中,磷酸二氢钾(KH2PO4)有重要作用,以氯磷灰石(主要成分为Ca5(PO4)3Cl,还含有少量Al2O3、Fe2O3等杂质)为原料制备KH2PO4的一种工艺流程如图所示:

已知:①Ksp[Fe(OH)3]=1.0×10-38
②Ca3(PO4)2与CaHPO4均难溶于水,Ca(H2PO4)2能溶于水。
(1)“酸浸”时发生的化学反应为Ca5(PO4)3Cl+5H2SO4(浓)=5CaSO4+3H3PO4+HCl↑,该反应体现了浓硫酸的______ 性和______ 性。可提高酸浸反应速率的措施有______ 。(写其中一条即可)
(2)反应II的化学方程式为______ 。
(3)滤渣的成分为______ ,若 离子)≤1.0×10-5mol•L-1时表明沉淀完全,计算Fe3+完全沉淀时的pH=
离子)≤1.0×10-5mol•L-1时表明沉淀完全,计算Fe3+完全沉淀时的pH=______ 。
(4)常温下磷酸的电离平衡常数Ka1=7.1×10-3、Ka2=6.3×10-8、Ka3=4.4×10-13,H2CO3的电离常数Ka1=4.3×10-7、Ka2=4.7×10-11,若将磷酸滴入碳酸钠溶液中反应的离子方程式错误的是______ 。
(5)以熔融碳酸钠燃料电池(图1)为电源,KH2PO4可通过图2装置电解制备:


①燃料电池(图1)中电极A上H2参与的电极反应式为______ 。
②电解池中若通电前a、b两室溶液的质量相等,若有2NA个K+通过交换膜,则两室溶液的质量差为______ g。

已知:①Ksp[Fe(OH)3]=1.0×10-38
②Ca3(PO4)2与CaHPO4均难溶于水,Ca(H2PO4)2能溶于水。
(1)“酸浸”时发生的化学反应为Ca5(PO4)3Cl+5H2SO4(浓)=5CaSO4+3H3PO4+HCl↑,该反应体现了浓硫酸的
(2)反应II的化学方程式为
(3)滤渣的成分为
 离子)≤1.0×10-5mol•L-1时表明沉淀完全,计算Fe3+完全沉淀时的pH=
离子)≤1.0×10-5mol•L-1时表明沉淀完全,计算Fe3+完全沉淀时的pH=(4)常温下磷酸的电离平衡常数Ka1=7.1×10-3、Ka2=6.3×10-8、Ka3=4.4×10-13,H2CO3的电离常数Ka1=4.3×10-7、Ka2=4.7×10-11,若将磷酸滴入碳酸钠溶液中反应的离子方程式错误的是
A.H3PO4+CO =HCO =HCO +H2PO +H2PO |
B.2H3PO4+CO =CO2↑+2H2PO =CO2↑+2H2PO |
C.H3PO4+2CO =2HCO =2HCO +HPO +HPO |
D.H3PO4+3CO =3HCO =3HCO +PO +PO |


①燃料电池(图1)中电极A上H2参与的电极反应式为
②电解池中若通电前a、b两室溶液的质量相等,若有2NA个K+通过交换膜,则两室溶液的质量差为
您最近一年使用:0次
2023-05-19更新
|
140次组卷
|
2卷引用:重庆市松树桥中学校2023-2024学年高二上学期半期考试(期中)化学试题
解题方法
5 . I.汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g)⇌2CO2(g) ΔH=−566.0 kJ· mol−1
②N2(g)+O2(g)⇌2NO(g) ΔH=+180.5 k J· mol−1
③2NO(g)+O2(g)⇌2NO2(g) ΔH=−116.5 k J· mol−1
回答下列问题:
(1)CO的燃烧热为_______ 。若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为_______ kJ。
(2)CO将NO2还原为单质的热化学方程式为_______ 。
II.一些硼化合物在工业上有许多用途。以铁硼矿为原料可以制得硼酸及其他硼化合物。回答下列问题:
(3)核电站中可用硼酸(H3BO3)吸收中子,阻断核辐射,硼酸中B的化合价为_______ 。
(4)已知:Ka(H3BO3)=5.8×10-10,Ka(H2CO3)=4.4×10-7,Ka(HCO )=4.7×10-11,向饱和硼酸溶液中滴加0.1 mo l· L-1 Na2CO3溶液,
)=4.7×10-11,向饱和硼酸溶液中滴加0.1 mo l· L-1 Na2CO3溶液,_____ (填“能”或“不能”)观察到气泡逸出。实验室用硼酸处理NaOH灼伤时,会生成 [B(OH)4]-,则硼酸溶于水的电离方程式为_____ 。
(5)以硼酸为原料可制备重要还原剂NaBH4,BH 的电子式为
的电子式为_____ 。NaBH4与BF3在50 ℃~70 ℃反应生成NaBF4和乙硼烷(B2H6),该反应的化学方程式是_____ 。
已知:①2CO(g)+O2(g)⇌2CO2(g) ΔH=−566.0 kJ· mol−1
②N2(g)+O2(g)⇌2NO(g) ΔH=+180.5 k J· mol−1
③2NO(g)+O2(g)⇌2NO2(g) ΔH=−116.5 k J· mol−1
回答下列问题:
(1)CO的燃烧热为
(2)CO将NO2还原为单质的热化学方程式为
II.一些硼化合物在工业上有许多用途。以铁硼矿为原料可以制得硼酸及其他硼化合物。回答下列问题:
(3)核电站中可用硼酸(H3BO3)吸收中子,阻断核辐射,硼酸中B的化合价为
(4)已知:Ka(H3BO3)=5.8×10-10,Ka(H2CO3)=4.4×10-7,Ka(HCO
 )=4.7×10-11,向饱和硼酸溶液中滴加0.1 mo l· L-1 Na2CO3溶液,
)=4.7×10-11,向饱和硼酸溶液中滴加0.1 mo l· L-1 Na2CO3溶液,(5)以硼酸为原料可制备重要还原剂NaBH4,BH
 的电子式为
的电子式为
您最近一年使用:0次



