名校
1 . 硫酸和醋酸都是重要的化工原料,在生产、科研中用途广泛。回答下列问题:
(1)①某温度(t℃)时,水的离子积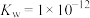 ,则t℃
,则t℃___________ 25℃(填“>”“<”或“=”)。此温度下,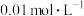 的氨水中
的氨水中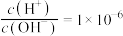 ,则该氨水溶液的pH=
,则该氨水溶液的pH=___________ ;
②将室温下pH=11的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得混合溶液的pH=3,则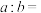
___________ 。
(2)某兴趣小组设计了如下实验,探究不同条件对KI溶液(硫酸酸化)被空气中O2氧化反应速率的影响:
①请完成下表(硫酸、KI溶液体积均为5mL,淀粉溶液用量相同):
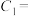
___________ ,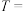
___________ 。
②该实验中通过观察___________ 实验现象判断反应的快慢。为此,该实验中三种溶液混合的顺序不合理的是___________ 。
a.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
b.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
c.先将KI溶液与硫酸溶液混合,然后再加入淀粉溶液
(3)25℃时,某Na2SO4溶液中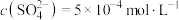 ,取该溶液1mL加水稀释至100mL,则稀释后溶液中
,取该溶液1mL加水稀释至100mL,则稀释后溶液中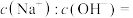
___________ 。
(4)在室温下,蒸馏水稀释0.01mol/LHA(HA为弱酸)溶液时,下列呈减小趋势的是___________。
(1)①某温度(t℃)时,水的离子积
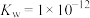 ,则t℃
,则t℃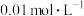 的氨水中
的氨水中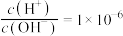 ,则该氨水溶液的pH=
,则该氨水溶液的pH=②将室温下pH=11的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得混合溶液的pH=3,则
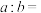
(2)某兴趣小组设计了如下实验,探究不同条件对KI溶液(硫酸酸化)被空气中O2氧化反应速率的影响:
①请完成下表(硫酸、KI溶液体积均为5mL,淀粉溶液用量相同):
| 实验编号 | T/K |  | 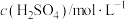 | 实验目的 |
| I | 298 | 1 | 0.1 | 实验I和II探究温度对该反应速率的影响;实验I和III探究反应物浓度对该反应速率的影响 |
| II | 308 |  |  | |
| III | T | 1 | 0.2 |
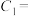
②该实验中通过观察
a.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
b.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
c.先将KI溶液与硫酸溶液混合,然后再加入淀粉溶液
(3)25℃时,某Na2SO4溶液中
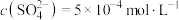 ,取该溶液1mL加水稀释至100mL,则稀释后溶液中
,取该溶液1mL加水稀释至100mL,则稀释后溶液中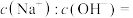
(4)在室温下,蒸馏水稀释0.01mol/LHA(HA为弱酸)溶液时,下列呈减小趋势的是___________。
| A.水的电离程度 | B. |
C.溶液中 和 和 的乘积 的乘积 | D.溶液中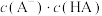 的值 的值 |
您最近一年使用:0次
名校
2 . 下列实验操作或做法正确且能达到目的的是
| 选项 | 实验操作或实验做法 | 实验目的 |
| A | 将过量 通入溴水中,溴水褪色 通入溴水中,溴水褪色 | 证明 具有漂白性 具有漂白性 |
| B | 向 溶液中通入少量的 溶液中通入少量的 生成白色沉淀 生成白色沉淀 | 证明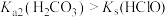 |
| C | 向盛有2  溶液的试管中滴加浓的维生素C溶液,观察颜色变化 溶液的试管中滴加浓的维生素C溶液,观察颜色变化 | 探究维生素C的还原性 |
| D | 向2支盛有5 不同浓度 不同浓度 溶液的试管中同时加入2 溶液的试管中同时加入2 0.2 0.2  溶液,观察实验现象 溶液,观察实验现象 | 探究浓度对化学反应速率的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-26更新
|
244次组卷
|
4卷引用:黑龙江省海伦市第一中学2022-2023学期高三上学期期中考试化学试卷题
黑龙江省海伦市第一中学2022-2023学期高三上学期期中考试化学试卷题(已下线)云南师范大学附属中学2023-2024学年高三上学期开学考试化学试题云南师范大学附属中学2023-2024学年高三上学期开学考试化学试题山东省菏泽市鄄城县第一中学2023-2024学年高三上学期1月月考化学试题
3 . 生活处处有化学,化学知识无处不在。用所学知识解释工业、生产、生活与科研中的相关现象。
(1)写出H2C2O4在溶液中发生第一步电离的方程式:_______ ,写出该步电离常数的表达式Ka1=_______ 。
(2)水的离子积表达式Kw=_______ 。常温下0.01 mol/L HCl 溶液的水电离出的 c(H +)=_______ pH=11的CH3 COONa 溶液中由水电离产生的 c(OH-)=_______ 。
(3)CH3COONa溶液呈碱性的原因_______ (用离子方程式)。
(4)将饱和FeCl3的水溶液加入沸水中可以制备胶体,原因是:_______ (用离子方程式表示)。如果加热制备所得胶体,观察到颜色变化为_______ 。
(5)学过的平衡常数有化学平衡常数(K)、电离平衡常数(Ka\Kb)、水的离子积常数(Kw)、盐的水解常数(Kh),后面还会学习沉淀溶解平衡,其常数叫溶度积Ksp。其实这些常数有很多相似之处。任写一点_______ 。(符合题意的答案,均可给分)
(6)如除去MgCl2溶液中Fe3+需要的除杂试剂是_______ 。
(7)泡沫灭火器中筒体内的硫酸铝酸性溶液与碳酸氢钠碱性溶液混合发生化学反应,将生成的泡沫压出喷嘴, 喷射出去进行灭火的。写出对应的离子方程式_______ 。
(1)写出H2C2O4在溶液中发生第一步电离的方程式:
(2)水的离子积表达式Kw=
(3)CH3COONa溶液呈碱性的原因
(4)将饱和FeCl3的水溶液加入沸水中可以制备胶体,原因是:
(5)学过的平衡常数有化学平衡常数(K)、电离平衡常数(Ka\Kb)、水的离子积常数(Kw)、盐的水解常数(Kh),后面还会学习沉淀溶解平衡,其常数叫溶度积Ksp。其实这些常数有很多相似之处。任写一点
(6)如除去MgCl2溶液中Fe3+需要的除杂试剂是
(7)泡沫灭火器中筒体内的硫酸铝酸性溶液与碳酸氢钠碱性溶液混合发生化学反应,将生成的泡沫压出喷嘴, 喷射出去进行灭火的。写出对应的离子方程式
您最近一年使用:0次
4 . 填空
(1)25℃时,亚碲酸( )的
)的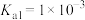 ,
,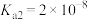 。常温下,
。常温下, 溶液的pH
溶液的pH______ (填“<”“>”或“=”)7。
(2)已知25℃时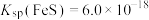 ,要使溶液中
,要使溶液中 沉淀完全[
沉淀完全[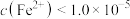 mol⋅L
mol⋅L ],则需控制溶液中
],则需控制溶液中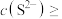
______ 。
(3)室温下,测得用氨水吸收 时,溶液中含碳(氮)各粒子的物质的量分数和pH的关系如图,若所得溶液
时,溶液中含碳(氮)各粒子的物质的量分数和pH的关系如图,若所得溶液 ,则溶液中
,则溶液中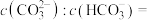
______ (已知) )。
)。
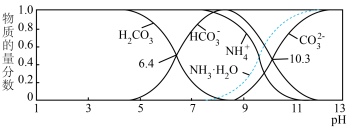
(4)若向浓烧碱溶液中通入 气体,使所得溶液
气体,使所得溶液 ,则此时溶液中的
,则此时溶液中的
______ mol⋅L (室温下,
(室温下, 的
的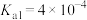 ,
,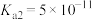 )。
)。
(5)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体 ,其产物之一是
,其产物之一是 。已知常温下碳酸的电离常数
。已知常温下碳酸的电离常数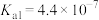 ,
, ,
, 的电离常数
的电离常数 ,则所得的
,则所得的 溶液中
溶液中
______ (填“>”“<”或“=”) 。
。
(6) 是一种液态化合物,将其滴入水中,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味气体逸出,该气体可使品红溶液褪色。
是一种液态化合物,将其滴入水中,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味气体逸出,该气体可使品红溶液褪色。
①根据实验现象写出 和
和 反应的化学方程式:
反应的化学方程式:____________ 。
②利用 制备无水
制备无水 时,可用
时,可用 和
和 混合共热,试解释原因:
混合共热,试解释原因:____________ 。
(1)25℃时,亚碲酸(
 )的
)的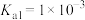 ,
,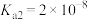 。常温下,
。常温下, 溶液的pH
溶液的pH(2)已知25℃时
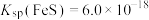 ,要使溶液中
,要使溶液中 沉淀完全[
沉淀完全[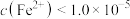 mol⋅L
mol⋅L ],则需控制溶液中
],则需控制溶液中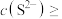
(3)室温下,测得用氨水吸收
 时,溶液中含碳(氮)各粒子的物质的量分数和pH的关系如图,若所得溶液
时,溶液中含碳(氮)各粒子的物质的量分数和pH的关系如图,若所得溶液 ,则溶液中
,则溶液中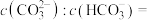
 )。
)。
(4)若向浓烧碱溶液中通入
 气体,使所得溶液
气体,使所得溶液 ,则此时溶液中的
,则此时溶液中的
 (室温下,
(室温下, 的
的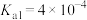 ,
,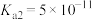 )。
)。(5)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体
 ,其产物之一是
,其产物之一是 。已知常温下碳酸的电离常数
。已知常温下碳酸的电离常数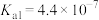 ,
, ,
, 的电离常数
的电离常数 ,则所得的
,则所得的 溶液中
溶液中
 。
。(6)
 是一种液态化合物,将其滴入水中,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味气体逸出,该气体可使品红溶液褪色。
是一种液态化合物,将其滴入水中,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味气体逸出,该气体可使品红溶液褪色。①根据实验现象写出
 和
和 反应的化学方程式:
反应的化学方程式:②利用
 制备无水
制备无水 时,可用
时,可用 和
和 混合共热,试解释原因:
混合共热,试解释原因:
您最近一年使用:0次
5 . CH3COOH是常见的弱酸,现有常温下0.1molL-1的CH3COOH溶液。
(1)若温度不变,加水稀释过程中,下列表达式的数据一定变小的是________ (填字母序号,下同);若该溶液升高温度,下列表达式的数据增大的是________ 。
A c(H+)
B c(H+)c(OH-)
C
D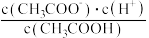
(2)某化学兴趣小组装好了如图所示的实验装置,一支胶头滴管盛有盐酸,另一支胶头滴管盛有同体积、同浓度的醋酸。实验时同时完全捏扁a、b胶头滴管的胶头,观察实验现象

①装置A、B中用红墨水而不用水的目的是________________ 。
②实验刚开始时,发现装置A中的长导管液面上升得比装置B中的要快。则胶头滴管a中盛的是__________ 。 两装置反应结束时(无固体剩余)。静置后两装置中的长导管或面均有所下降,最终液面高度__________ (填“相等”。“A中的高”或“B中的高”).
(3)实验表明,液态时纯硫酸的电离能力强于纯硝酸,纯硫酸的导电性也是显著强于纯水。又知液态纯酸都能像水那样进行自身电离而建立平衡。且在一定温度下都有各自的离子积常数。据此回答:
①25°C时,液态纯硫酸的离子积常数K(H2SO4)_____ 1×10-14(填“>”“<”或“=”).
②在纯硫酸与纯硝酸的液态混合酸中,存在的阴离子主要是__________ 。
(4)在某温度下的水溶液中,c(H+)=10xmolL-1,c(OH-)=10ymolL-1,x与y的关系如图所示:

①该温度下,水的离子积为____________ 。
②该温度下,0.01 molL-1 NaOH溶液中水电离出c(OH-)为____________ 。
(1)若温度不变,加水稀释过程中,下列表达式的数据一定变小的是
A c(H+)
B c(H+)c(OH-)
C

D
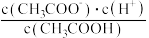
(2)某化学兴趣小组装好了如图所示的实验装置,一支胶头滴管盛有盐酸,另一支胶头滴管盛有同体积、同浓度的醋酸。实验时同时完全捏扁a、b胶头滴管的胶头,观察实验现象

①装置A、B中用红墨水而不用水的目的是
②实验刚开始时,发现装置A中的长导管液面上升得比装置B中的要快。则胶头滴管a中盛的是
(3)实验表明,液态时纯硫酸的电离能力强于纯硝酸,纯硫酸的导电性也是显著强于纯水。又知液态纯酸都能像水那样进行自身电离而建立平衡。且在一定温度下都有各自的离子积常数。据此回答:
①25°C时,液态纯硫酸的离子积常数K(H2SO4)
②在纯硫酸与纯硝酸的液态混合酸中,存在的阴离子主要是
(4)在某温度下的水溶液中,c(H+)=10xmolL-1,c(OH-)=10ymolL-1,x与y的关系如图所示:

①该温度下,水的离子积为
②该温度下,0.01 molL-1 NaOH溶液中水电离出c(OH-)为
您最近一年使用:0次
名校
解题方法
6 . 在未来能源领域——“人造太阳”计划中,磷酸二氢钾(KH2PO4)有重要作用,以氯磷灰石(主要成分为Ca5(PO4)3Cl,还含有少量Al2O3、Fe2O3等杂质)为原料制备KH2PO4的一种工艺流程如图所示:

已知:①Ksp[Fe(OH)3]=1.0×10-38
②Ca3(PO4)2与CaHPO4均难溶于水,Ca(H2PO4)2能溶于水。
(1)“酸浸”时发生的化学反应为Ca5(PO4)3Cl+5H2SO4(浓)=5CaSO4+3H3PO4+HCl↑,该反应体现了浓硫酸的______ 性和______ 性。可提高酸浸反应速率的措施有______ 。(写其中一条即可)
(2)反应II的化学方程式为______ 。
(3)滤渣的成分为______ ,若 离子)≤1.0×10-5mol•L-1时表明沉淀完全,计算Fe3+完全沉淀时的pH=
离子)≤1.0×10-5mol•L-1时表明沉淀完全,计算Fe3+完全沉淀时的pH=______ 。
(4)常温下磷酸的电离平衡常数Ka1=7.1×10-3、Ka2=6.3×10-8、Ka3=4.4×10-13,H2CO3的电离常数Ka1=4.3×10-7、Ka2=4.7×10-11,若将磷酸滴入碳酸钠溶液中反应的离子方程式错误的是______ 。
(5)以熔融碳酸钠燃料电池(图1)为电源,KH2PO4可通过图2装置电解制备:


①燃料电池(图1)中电极A上H2参与的电极反应式为______ 。
②电解池中若通电前a、b两室溶液的质量相等,若有2NA个K+通过交换膜,则两室溶液的质量差为______ g。

已知:①Ksp[Fe(OH)3]=1.0×10-38
②Ca3(PO4)2与CaHPO4均难溶于水,Ca(H2PO4)2能溶于水。
(1)“酸浸”时发生的化学反应为Ca5(PO4)3Cl+5H2SO4(浓)=5CaSO4+3H3PO4+HCl↑,该反应体现了浓硫酸的
(2)反应II的化学方程式为
(3)滤渣的成分为
 离子)≤1.0×10-5mol•L-1时表明沉淀完全,计算Fe3+完全沉淀时的pH=
离子)≤1.0×10-5mol•L-1时表明沉淀完全,计算Fe3+完全沉淀时的pH=(4)常温下磷酸的电离平衡常数Ka1=7.1×10-3、Ka2=6.3×10-8、Ka3=4.4×10-13,H2CO3的电离常数Ka1=4.3×10-7、Ka2=4.7×10-11,若将磷酸滴入碳酸钠溶液中反应的离子方程式错误的是
A.H3PO4+CO =HCO =HCO +H2PO +H2PO |
B.2H3PO4+CO =CO2↑+2H2PO =CO2↑+2H2PO |
C.H3PO4+2CO =2HCO =2HCO +HPO +HPO |
D.H3PO4+3CO =3HCO =3HCO +PO +PO |


①燃料电池(图1)中电极A上H2参与的电极反应式为
②电解池中若通电前a、b两室溶液的质量相等,若有2NA个K+通过交换膜,则两室溶液的质量差为
您最近一年使用:0次
2023-05-19更新
|
138次组卷
|
2卷引用:重庆市松树桥中学校2023-2024学年高二上学期半期考试(期中)化学试题
名校
7 . Ⅰ. 在染料、造纸、制革、化学合成等工业中作为还原剂,在酿造、饮料行业中用作杀菌剂,还可用于生产糖精、香料等。其水溶液中含硫微粒随pH的分布曲线如图所示。
在染料、造纸、制革、化学合成等工业中作为还原剂,在酿造、饮料行业中用作杀菌剂,还可用于生产糖精、香料等。其水溶液中含硫微粒随pH的分布曲线如图所示。
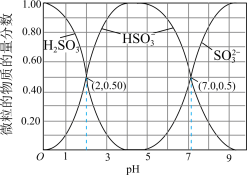
请回答以下问题:
(1)下列说法正确的是_______。
(2)若向 溶液中滴入NaOH溶液使pH恰好为7,此时测得
溶液中滴入NaOH溶液使pH恰好为7,此时测得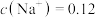 mol∙L−1,则溶液中
mol∙L−1,则溶液中
_______ mol∙L−1;
(3)已知几种酸的Ka如下表所示,下列化学方程式正确的是_______。
Ⅱ.工业上可用纯碱吸收二氧化硫法制备 ,流程如下图所示。
,流程如下图所示。
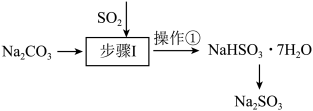
(4)步骤I中边搅拌边向 溶液中通入
溶液中通入 制备
制备 溶液,结合
溶液,结合 的分布系数图,确定停止通入
的分布系数图,确定停止通入 的最佳pH范围是
的最佳pH范围是_______ ,操作①的名称为_______ ;
(5)某小组同学用0.1000 mol∙L−1的酸性 溶液测定产品中
溶液测定产品中 的含量,具体流程:
的含量,具体流程:
①称量1 g样品,溶解,配置成250 mL的溶液;
②用滴定管量取25.00 mL样品溶液于锥形瓶中,用酸性 溶液滴定;
溶液滴定;
③消耗 溶液体积为20.00 mL;
溶液体积为20.00 mL;
试计算样品中 的纯度
的纯度_______ 。
(6)连二亚硫酸钠( )俗称保险粉,是一种强还原剂。工业常用惰性电极电解酸性亚硫酸氢钠溶液制备连二亚硫酸钠,原理及装置如图所示,a电极反应为
)俗称保险粉,是一种强还原剂。工业常用惰性电极电解酸性亚硫酸氢钠溶液制备连二亚硫酸钠,原理及装置如图所示,a电极反应为_______ 。

 在染料、造纸、制革、化学合成等工业中作为还原剂,在酿造、饮料行业中用作杀菌剂,还可用于生产糖精、香料等。其水溶液中含硫微粒随pH的分布曲线如图所示。
在染料、造纸、制革、化学合成等工业中作为还原剂,在酿造、饮料行业中用作杀菌剂,还可用于生产糖精、香料等。其水溶液中含硫微粒随pH的分布曲线如图所示。
请回答以下问题:
(1)下列说法正确的是_______。
A. 溶液显碱性 溶液显碱性 |
B. 时,溶液中 时,溶液中 |
C. 溶液中 溶液中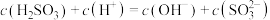 |
D. 溶液中 溶液中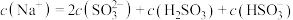 |
 溶液中滴入NaOH溶液使pH恰好为7,此时测得
溶液中滴入NaOH溶液使pH恰好为7,此时测得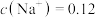 mol∙L−1,则溶液中
mol∙L−1,则溶液中
(3)已知几种酸的Ka如下表所示,下列化学方程式正确的是_______。
| 碳酸 | 次氯酸 | 醋酸 |
 |  | 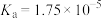 |
 |
A.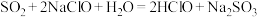 |
B.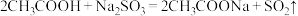 |
C. |
D. |
Ⅱ.工业上可用纯碱吸收二氧化硫法制备
 ,流程如下图所示。
,流程如下图所示。
(4)步骤I中边搅拌边向
 溶液中通入
溶液中通入 制备
制备 溶液,结合
溶液,结合 的分布系数图,确定停止通入
的分布系数图,确定停止通入 的最佳pH范围是
的最佳pH范围是(5)某小组同学用0.1000 mol∙L−1的酸性
 溶液测定产品中
溶液测定产品中 的含量,具体流程:
的含量,具体流程:①称量1 g样品,溶解,配置成250 mL的溶液;
②用滴定管量取25.00 mL样品溶液于锥形瓶中,用酸性
 溶液滴定;
溶液滴定;③消耗
 溶液体积为20.00 mL;
溶液体积为20.00 mL;试计算样品中
 的纯度
的纯度(6)连二亚硫酸钠(
 )俗称保险粉,是一种强还原剂。工业常用惰性电极电解酸性亚硫酸氢钠溶液制备连二亚硫酸钠,原理及装置如图所示,a电极反应为
)俗称保险粉,是一种强还原剂。工业常用惰性电极电解酸性亚硫酸氢钠溶液制备连二亚硫酸钠,原理及装置如图所示,a电极反应为
您最近一年使用:0次
21-22高二上·湖北黄冈·阶段练习
8 . 化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备 ,进一步处理得到产品
,进一步处理得到产品 和
和 ,实验流程如图:
,实验流程如图:

回答下列问题:
(1)在氨盐水中通 常使用下图装置,其雾化装置的优点是
常使用下图装置,其雾化装置的优点是_______ 。

(2)生成 的总反应的离子方程式为
的总反应的离子方程式为_______ 。
(3)向母液中加入 粉末,存在
粉末,存在 过程。为使
过程。为使 沉淀充分析出并分离,根据
沉淀充分析出并分离,根据 和
和 溶解度曲线,需采用的操作为
溶解度曲线,需采用的操作为_______ 、_______ 、洗涤、干燥。
(4)工业中可以利用碳酸钠溶液吸收反应②中产生的氯气,写出含
 的溶液恰好吸收
的溶液恰好吸收
 的离子方程式
的离子方程式_______ 。(已知常温下
 ,
,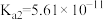 ;
;
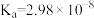 )
)
(5)某化学兴趣小组利用以下装置模拟合成氨并制备少量氨水。

已知:加热(85℃) 和
和 饱和溶液可以制取
饱和溶液可以制取
①为使 中分液漏斗内的稀盐酸顺利滴下,
中分液漏斗内的稀盐酸顺利滴下,_______ 。
②为了完成实验,装置从左到右接口的连接顺序是_______ _______;
_______;_______
③小组中甲同学认为 装置不太合理,实验中会产生倒吸。乙同学认真分析后认为该装置无需改进,他的理由是
装置不太合理,实验中会产生倒吸。乙同学认真分析后认为该装置无需改进,他的理由是_______ ;
 ,进一步处理得到产品
,进一步处理得到产品 和
和 ,实验流程如图:
,实验流程如图:
回答下列问题:
(1)在氨盐水中通
 常使用下图装置,其雾化装置的优点是
常使用下图装置,其雾化装置的优点是
(2)生成
 的总反应的离子方程式为
的总反应的离子方程式为(3)向母液中加入
 粉末,存在
粉末,存在 过程。为使
过程。为使 沉淀充分析出并分离,根据
沉淀充分析出并分离,根据 和
和 溶解度曲线,需采用的操作为
溶解度曲线,需采用的操作为(4)工业中可以利用碳酸钠溶液吸收反应②中产生的氯气,写出含

 的溶液恰好吸收
的溶液恰好吸收
 的离子方程式
的离子方程式
 ,
,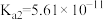 ;
;
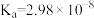 )
)(5)某化学兴趣小组利用以下装置模拟合成氨并制备少量氨水。

已知:加热(85℃)
 和
和 饱和溶液可以制取
饱和溶液可以制取
①为使
 中分液漏斗内的稀盐酸顺利滴下,
中分液漏斗内的稀盐酸顺利滴下,②为了完成实验,装置从左到右接口的连接顺序是_______
 _______;
_______;③小组中甲同学认为
 装置不太合理,实验中会产生倒吸。乙同学认真分析后认为该装置无需改进,他的理由是
装置不太合理,实验中会产生倒吸。乙同学认真分析后认为该装置无需改进,他的理由是
您最近一年使用:0次
解题方法
9 . I.汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g)⇌2CO2(g) ΔH=−566.0 kJ· mol−1
②N2(g)+O2(g)⇌2NO(g) ΔH=+180.5 k J· mol−1
③2NO(g)+O2(g)⇌2NO2(g) ΔH=−116.5 k J· mol−1
回答下列问题:
(1)CO的燃烧热为_______ 。若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为_______ kJ。
(2)CO将NO2还原为单质的热化学方程式为_______ 。
II.一些硼化合物在工业上有许多用途。以铁硼矿为原料可以制得硼酸及其他硼化合物。回答下列问题:
(3)核电站中可用硼酸(H3BO3)吸收中子,阻断核辐射,硼酸中B的化合价为_______ 。
(4)已知:Ka(H3BO3)=5.8×10-10,Ka(H2CO3)=4.4×10-7,Ka(HCO )=4.7×10-11,向饱和硼酸溶液中滴加0.1 mo l· L-1 Na2CO3溶液,
)=4.7×10-11,向饱和硼酸溶液中滴加0.1 mo l· L-1 Na2CO3溶液,_____ (填“能”或“不能”)观察到气泡逸出。实验室用硼酸处理NaOH灼伤时,会生成 [B(OH)4]-,则硼酸溶于水的电离方程式为_____ 。
(5)以硼酸为原料可制备重要还原剂NaBH4,BH 的电子式为
的电子式为_____ 。NaBH4与BF3在50 ℃~70 ℃反应生成NaBF4和乙硼烷(B2H6),该反应的化学方程式是_____ 。
已知:①2CO(g)+O2(g)⇌2CO2(g) ΔH=−566.0 kJ· mol−1
②N2(g)+O2(g)⇌2NO(g) ΔH=+180.5 k J· mol−1
③2NO(g)+O2(g)⇌2NO2(g) ΔH=−116.5 k J· mol−1
回答下列问题:
(1)CO的燃烧热为
(2)CO将NO2还原为单质的热化学方程式为
II.一些硼化合物在工业上有许多用途。以铁硼矿为原料可以制得硼酸及其他硼化合物。回答下列问题:
(3)核电站中可用硼酸(H3BO3)吸收中子,阻断核辐射,硼酸中B的化合价为
(4)已知:Ka(H3BO3)=5.8×10-10,Ka(H2CO3)=4.4×10-7,Ka(HCO
 )=4.7×10-11,向饱和硼酸溶液中滴加0.1 mo l· L-1 Na2CO3溶液,
)=4.7×10-11,向饱和硼酸溶液中滴加0.1 mo l· L-1 Na2CO3溶液,(5)以硼酸为原料可制备重要还原剂NaBH4,BH
 的电子式为
的电子式为
您最近一年使用:0次



