2023·上海·模拟预测
1 . 0.1 mol·L NaOH溶液分别滴入20 mL 0.1 mol·L
NaOH溶液分别滴入20 mL 0.1 mol·L HX溶液与20 mL 0.1 mol·L
HX溶液与20 mL 0.1 mol·L HCl溶液中,其pH随滴入NaOH溶液体积变化的图像如图所示。下列说法正确的是
HCl溶液中,其pH随滴入NaOH溶液体积变化的图像如图所示。下列说法正确的是

 NaOH溶液分别滴入20 mL 0.1 mol·L
NaOH溶液分别滴入20 mL 0.1 mol·L HX溶液与20 mL 0.1 mol·L
HX溶液与20 mL 0.1 mol·L HCl溶液中,其pH随滴入NaOH溶液体积变化的图像如图所示。下列说法正确的是
HCl溶液中,其pH随滴入NaOH溶液体积变化的图像如图所示。下列说法正确的是
A.b点: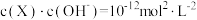 | B.c点: |
| C.a、d点溶液混合后为酸性 | D.水的电离程度:d>c>b>a |
您最近一年使用:0次
2022高二上·安徽阜阳·竞赛
解题方法
2 . 我们将有离子参与的反应叫做离子反应,下列离子方程式中正确的是
A.足量的碳酸氢钠与氢氧化钙溶液反应:HCO +Ca2++OH-=CaCO3↓+H2O +Ca2++OH-=CaCO3↓+H2O |
| B.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C.将使84消毒液有刺鼻性气味的气体通入水中:Cl2+H2O=H++Cl-+HClO |
D.将高铁酸钠(Na2FeO4)加入水中:4FeO +10H2O=4Fe(OH)3(胶体)+3O2↑+8OH- +10H2O=4Fe(OH)3(胶体)+3O2↑+8OH- |
您最近一年使用:0次
名校
解题方法
3 . 硫代硫酸钠( )是一种解毒药,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性环境中易分解。
)是一种解毒药,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性环境中易分解。
I. 的制备。制备原理为:
的制备。制备原理为: 。
。
(1)用化学用语解释通入 之前,混合溶液呈碱性的主要原因是:
之前,混合溶液呈碱性的主要原因是: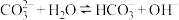 ,
,___________ 。
(2)为了保证硫代硫酸钠的产量,实验中通入的 ,能否过量
,能否过量___________ (填“能”或“否”);测定该混合溶液 的操作方法:
的操作方法:___________ 。
II.探究 与金属阳离子的反应。
与金属阳离子的反应。
资料:i.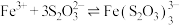 (紫黑色)
(紫黑色)
ⅱ. 为白色沉淀,
为白色沉淀, 可溶于过量的
可溶于过量的 溶液
溶液
(3)根据实验①的现象,初步判断最终 被
被 还原为
还原为 。该反应的离子方程式:
。该反应的离子方程式:___________ 。试从化学反应速率和平衡的角度解释实验①的现象:___________ 。
(4)进一步探究 和
和 反应。
反应。
实验③中白色絮状沉淀最后变为黑色沉淀(Ag2S)的化学方程式如下,填入合适的物质和系数: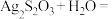
___________ 。
(5)根据以上实验可知: 与金属离子反应的多样性与
与金属离子反应的多样性与_______ 和_____ 有关。
 )是一种解毒药,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性环境中易分解。
)是一种解毒药,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性环境中易分解。I.
 的制备。制备原理为:
的制备。制备原理为: 。
。(1)用化学用语解释通入
 之前,混合溶液呈碱性的主要原因是:
之前,混合溶液呈碱性的主要原因是: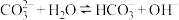 ,
,(2)为了保证硫代硫酸钠的产量,实验中通入的
 ,能否过量
,能否过量 的操作方法:
的操作方法:II.探究
 与金属阳离子的反应。
与金属阳离子的反应。资料:i.
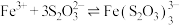 (紫黑色)
(紫黑色)ⅱ.
 为白色沉淀,
为白色沉淀, 可溶于过量的
可溶于过量的 溶液
溶液| 装置 | 编号 | 试剂X | 实验现象 |
 | ① |  溶液 溶液 | 混合后溶液先变成紫黑色, 后溶液几乎变为无色 后溶液几乎变为无色 |
| ② |  溶液 溶液 | 先生成白色絮状沉淀,振荡后,沉淀溶解,得到无色溶液 |
 被
被 还原为
还原为 。该反应的离子方程式:
。该反应的离子方程式:(4)进一步探究
 和
和 反应。
反应。| 装置 | 编号 | 试剂X | 实验现象 |
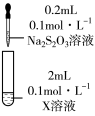 | ③ |  溶液 溶液 | 先生成白色絮状沉淀,沉淀很快变为黄色、棕色,最后为黑色沉淀。 |
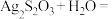
(5)根据以上实验可知:
 与金属离子反应的多样性与
与金属离子反应的多样性与
您最近一年使用:0次
4 . 卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如图:
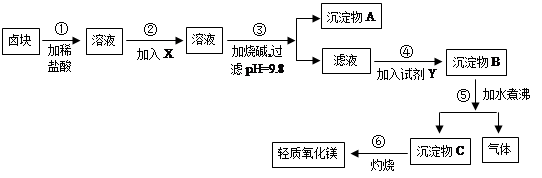
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1和表2提供的资料,填写空白:
(1)在步骤②中加入的试剂X(从表2中选择)是___ 而不是双氧水,其原因是________________ 。
写出加入X发生反应的离子方程式_______________________________ 。
(2)在步骤③中控制pH=9.8,其目的是_______________________________ 。
(3)沉淀物A的成分为_____________ ,试剂Y(从表2中选择)应该是________ 。
(4)在步骤⑤中发生反应的化学方程式是_______________________________ 。
(5)若在实验室中完成步骤⑥,则沉淀物C必需在______ (填仪器名称)中灼烧。

已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1和表2提供的资料,填写空白:
| 表1 生成氢氧化物沉淀的pH | 表2 化学试剂价格表 | ||||
| 物质 | 开始沉淀 | 沉淀完全 | 试剂 | 价格(元/吨) | |
| Fe(OH)3 | 2.7 | 3.7 | 漂液(含25.2% NaClO) | 450 | |
| Fe(OH)2 | 7.6 | 9.6 | 双氧水(含30% H2O2) | 2400 | |
| Mn(OH)2 | 8.3 | 9.8 | 烧碱(含98% NaOH) | 2100 | |
| Mg(OH)2 | 10.0 | 11.1 | 纯碱(含99.5% Na2CO3) | 600 | |
写出加入X发生反应的离子方程式
(2)在步骤③中控制pH=9.8,其目的是
(3)沉淀物A的成分为
(4)在步骤⑤中发生反应的化学方程式是
(5)若在实验室中完成步骤⑥,则沉淀物C必需在
您最近一年使用:0次
解题方法
5 . 金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如下:
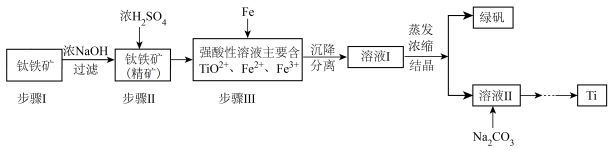
已知:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O
(1)步骤I中发生反应的离子方程式:____________________ 、_____________________ 。
(2)已知:TiO2+易水解,只能存在于强酸性溶液中。
25 ℃时,难溶电解质溶解度(s)与pH关系如图,TiO(OH)2溶度积Ksp=1×10-29
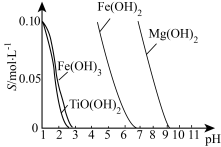
①步骤Ⅲ加入铁屑原因是____________________ 。
②TiO2+水解的离子方程式为______________ 。向溶液II中加入Na2CO3粉末的作用是_______ 。当溶液pH接近_____ 时,TiO(OH)2已沉淀完全。
(3)TiCl4 Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于
Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于_______ ℃即可。
(4)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。写出阳极上所发生的反应式:___________________ 。


已知:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O
(1)步骤I中发生反应的离子方程式:
(2)已知:TiO2+易水解,只能存在于强酸性溶液中。
25 ℃时,难溶电解质溶解度(s)与pH关系如图,TiO(OH)2溶度积Ksp=1×10-29

①步骤Ⅲ加入铁屑原因是
②TiO2+水解的离子方程式为
(3)TiCl4
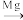 Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于
Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |

您最近一年使用:0次



