真题
解题方法
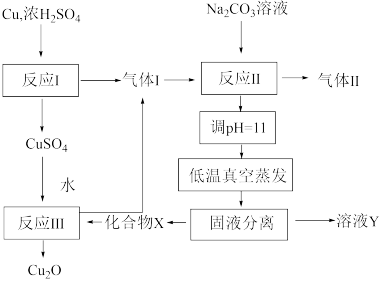
1 . 一种制备 的工艺路线如图所示,反应Ⅱ所得溶液
的工艺路线如图所示,反应Ⅱ所得溶液 在3~4之间,反应Ⅲ需及时补加
在3~4之间,反应Ⅲ需及时补加 以保持反应在
以保持反应在 条件下进行。常温下,
条件下进行。常温下, 的电离平衡常数
的电离平衡常数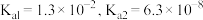 。下列说法正确的是
。下列说法正确的是
 的工艺路线如图所示,反应Ⅱ所得溶液
的工艺路线如图所示,反应Ⅱ所得溶液 在3~4之间,反应Ⅲ需及时补加
在3~4之间,反应Ⅲ需及时补加 以保持反应在
以保持反应在 条件下进行。常温下,
条件下进行。常温下, 的电离平衡常数
的电离平衡常数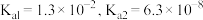 。下列说法正确的是
。下列说法正确的是
| A.反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应 |
B.低温真空蒸发主要目的是防止 被氧化 被氧化 |
| C.溶液Y可循环用于反应Ⅱ所在操作单元吸收气体Ⅰ |
D.若 产量不变,参与反应Ⅲ的 产量不变,参与反应Ⅲ的 与 与 物质的量之比 物质的量之比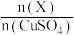 增大时,需补加 增大时,需补加 的量减少 的量减少 |
您最近半年使用:0次
2023·上海·模拟预测
2 . 0.1 mol·L NaOH溶液分别滴入20 mL 0.1 mol·L
NaOH溶液分别滴入20 mL 0.1 mol·L HX溶液与20 mL 0.1 mol·L
HX溶液与20 mL 0.1 mol·L HCl溶液中,其pH随滴入NaOH溶液体积变化的图像如图所示。下列说法正确的是
HCl溶液中,其pH随滴入NaOH溶液体积变化的图像如图所示。下列说法正确的是

 NaOH溶液分别滴入20 mL 0.1 mol·L
NaOH溶液分别滴入20 mL 0.1 mol·L HX溶液与20 mL 0.1 mol·L
HX溶液与20 mL 0.1 mol·L HCl溶液中,其pH随滴入NaOH溶液体积变化的图像如图所示。下列说法正确的是
HCl溶液中,其pH随滴入NaOH溶液体积变化的图像如图所示。下列说法正确的是
A.b点: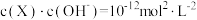 | B.c点: |
| C.a、d点溶液混合后为酸性 | D.水的电离程度:d>c>b>a |
您最近半年使用:0次
解题方法
3 . 高纯氟化镁具备优异的光学性质和抗腐蚀性被广泛应用于高端领域。某研究小组利用镁片(含 及少量惰性杂质)制备高纯氟化镁流程如下,请回答:
及少量惰性杂质)制备高纯氟化镁流程如下,请回答:

已知:
①甲醇沸点: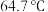
②该实验条件得到的氟化镁并不是晶型沉淀,其颗粒细小,常常吸附水分成黏稠胶状。
(1)利用图1装置可检测镁与甲醇反应速率。仪器A的名称___________ 。

(2)写出氟化反应涉及的化学方程式___________ 。
(3)下列有关说法不正确的是___________。
(4)步骤Ⅱ的一系列操作目的是为获得固体A.从下列选项中选择合理的仪器和操作,补全如下步骤[“_______”上填写一件最关键仪器 ,“(_______)”内填写一种操作 ,均用字母表示]________ 。
取仪器A中的溶液,用___________(___________)→用___________(蒸馏减少溶剂)→用___________(___________)→用漏斗(过滤得到固体A)
【仪器】a.烧杯;b.铜质保温漏斗;c.漏斗;d.空气冷凝管;e.直形冷凝管;f.球形冷凝管
【操作】g。过滤;h.趁热过滤;i.冷却结晶;j。蒸发结晶
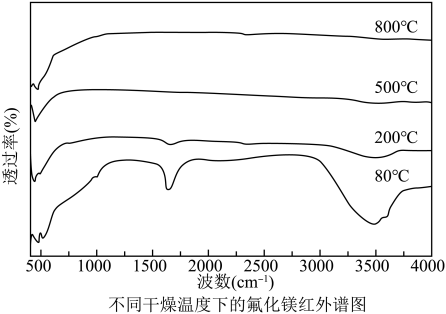
(5)步骤Ⅴ:产品在不同温度下干燥 ,对其进行红外光谱分析如下图,已知羟基引起的吸收峰在
,对其进行红外光谱分析如下图,已知羟基引起的吸收峰在 波数处请选择最合适的温度
波数处请选择最合适的温度___________ 。(填“ 、
、 、
、 或
或 ”)
”)
 及少量惰性杂质)制备高纯氟化镁流程如下,请回答:
及少量惰性杂质)制备高纯氟化镁流程如下,请回答:
已知:
①甲醇沸点:
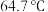
②该实验条件得到的氟化镁并不是晶型沉淀,其颗粒细小,常常吸附水分成黏稠胶状。
(1)利用图1装置可检测镁与甲醇反应速率。仪器A的名称

(2)写出氟化反应涉及的化学方程式
(3)下列有关说法不正确的是___________。
A.步骤Ⅰ:反应温度不选择 ,主要由于在 ,主要由于在 反应过于剧烈难以控制。 反应过于剧烈难以控制。 |
| B.步骤Ⅱ:待镁片上不再有微小气泡生成时,可进行步骤Ⅱ。 |
C.步骤Ⅲ:制备悬浊液B,应先将 通入高纯水达到饱和,再加到固体A中。 通入高纯水达到饱和,再加到固体A中。 |
| D.步骤Ⅳ:在进行氟化反应时,应做好防护措施和配备应急药品。 |
取仪器A中的溶液,用___________(___________)→用___________(蒸馏减少溶剂)→用___________(___________)→用漏斗(过滤得到固体A)
【仪器】a.烧杯;b.铜质保温漏斗;c.漏斗;d.空气冷凝管;e.直形冷凝管;f.球形冷凝管
【操作】g。过滤;h.趁热过滤;i.冷却结晶;j。蒸发结晶
(5)步骤Ⅴ:产品在不同温度下干燥
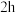 ,对其进行红外光谱分析如下图,已知羟基引起的吸收峰在
,对其进行红外光谱分析如下图,已知羟基引起的吸收峰在 波数处请选择最合适的温度
波数处请选择最合适的温度 、
、 、
、 或
或 ”)
”)
您最近半年使用:0次
2023-04-14更新
|
902次组卷
|
2卷引用:浙江省绍兴市2023届高三二模考试化学试题
解题方法
4 . 在含单质碘的 溶液中存在可逆反应:
溶液中存在可逆反应: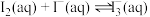 ,为测定该反应的平衡常数K进行如下实验,实验步骤如下:
,为测定该反应的平衡常数K进行如下实验,实验步骤如下:
I.在装有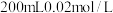 的
的 溶液的碘量瓶中加入足量
溶液的碘量瓶中加入足量 ,充分搅拌溶解,待过量的固体碘沉于瓶底后,取
,充分搅拌溶解,待过量的固体碘沉于瓶底后,取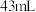 上层清液,用
上层清液,用 萃取,充分振荡、静置、分液,得到
萃取,充分振荡、静置、分液,得到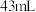 萃取后的水溶液、
萃取后的水溶液、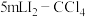 溶液。
溶液。
II.取萃取后的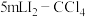 溶液于碘量瓶中,加水充分振荡,再加入质量分数为
溶液于碘量瓶中,加水充分振荡,再加入质量分数为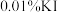 溶液,充分振荡后,静置5分钟,用
溶液,充分振荡后,静置5分钟,用 的
的 标准溶液滴定至淡黄色时,注入
标准溶液滴定至淡黄色时,注入 的淀粉溶液,平行滴定3次,平均消耗
的淀粉溶液,平行滴定3次,平均消耗 溶液。
溶液。
III.将萃取后的水溶液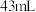 移入碘量瓶中,用
移入碘量瓶中,用 的
的 标准溶液滴定至淡黄色时,注入
标准溶液滴定至淡黄色时,注入 的淀粉溶液,平行滴定3次,平均消耗
的淀粉溶液,平行滴定3次,平均消耗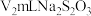 溶液。
溶液。
已知:i.
ii. 与
与 难溶于
难溶于
iii.室温下,达到溶解平衡后, 在
在 层和水层中的分配比
层和水层中的分配比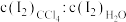 为86∶1
为86∶1
回答下列问题:
(1)下列萃取分液操作中没有用到的仪器有_______(填标号)。
(2) 易溶于
易溶于 的原因是
的原因是_______ 。
(3)滴定过程中 标准溶液应装在
标准溶液应装在_______ 滴定管(填“酸式”或“碱式”),滴定终点的现象是_______ 。
(4)步骤II中加入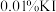 溶液的目的是
溶液的目的是_______ 。
(5)步骤III测得萃取后的水溶液中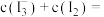
_______  ,平衡常数
,平衡常数
_______ (列出计算式即可)。
(6)下列关于实验误差分析的说法正确的是_______(填标号)。
 溶液中存在可逆反应:
溶液中存在可逆反应: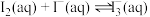 ,为测定该反应的平衡常数K进行如下实验,实验步骤如下:
,为测定该反应的平衡常数K进行如下实验,实验步骤如下:I.在装有
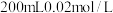 的
的 溶液的碘量瓶中加入足量
溶液的碘量瓶中加入足量 ,充分搅拌溶解,待过量的固体碘沉于瓶底后,取
,充分搅拌溶解,待过量的固体碘沉于瓶底后,取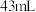 上层清液,用
上层清液,用 萃取,充分振荡、静置、分液,得到
萃取,充分振荡、静置、分液,得到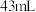 萃取后的水溶液、
萃取后的水溶液、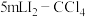 溶液。
溶液。II.取萃取后的
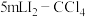 溶液于碘量瓶中,加水充分振荡,再加入质量分数为
溶液于碘量瓶中,加水充分振荡,再加入质量分数为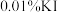 溶液,充分振荡后,静置5分钟,用
溶液,充分振荡后,静置5分钟,用 的
的 标准溶液滴定至淡黄色时,注入
标准溶液滴定至淡黄色时,注入 的淀粉溶液,平行滴定3次,平均消耗
的淀粉溶液,平行滴定3次,平均消耗 溶液。
溶液。III.将萃取后的水溶液
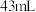 移入碘量瓶中,用
移入碘量瓶中,用 的
的 标准溶液滴定至淡黄色时,注入
标准溶液滴定至淡黄色时,注入 的淀粉溶液,平行滴定3次,平均消耗
的淀粉溶液,平行滴定3次,平均消耗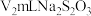 溶液。
溶液。已知:i.

ii.
 与
与 难溶于
难溶于
iii.室温下,达到溶解平衡后,
 在
在 层和水层中的分配比
层和水层中的分配比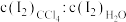 为86∶1
为86∶1回答下列问题:
(1)下列萃取分液操作中没有用到的仪器有_______(填标号)。
A. | B. | C. | D. |
 易溶于
易溶于 的原因是
的原因是(3)滴定过程中
 标准溶液应装在
标准溶液应装在(4)步骤II中加入
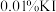 溶液的目的是
溶液的目的是(5)步骤III测得萃取后的水溶液中
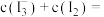
 ,平衡常数
,平衡常数
(6)下列关于实验误差分析的说法正确的是_______(填标号)。
A.步骤I中碘量瓶若没有充分振荡,则导致所测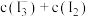 值偏大 值偏大 |
| B.步骤I中吸取上层清液时,不慎吸入碘固体,则测得的K偏小 |
| C.步骤II中滴定前滴定管有气泡,滴定后气泡消失,则测得的K偏大 |
| D.步骤III中滴定终点时俯视读数,则测得的K偏小 |
您最近半年使用:0次
名校
解题方法
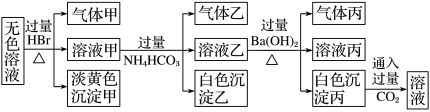
5 . 某无色溶液中可能含有以下离子中的一种或几种:Na+、Ag+、Fe3+、NH 、Al3+、CO
、Al3+、CO 、AlO
、AlO 、S2O
、S2O 、SO
、SO 。现取该溶液进行有关实验,实验结果如图所示:
。现取该溶液进行有关实验,实验结果如图所示:
下列说法不正确的是
 、Al3+、CO
、Al3+、CO 、AlO
、AlO 、S2O
、S2O 、SO
、SO 。现取该溶液进行有关实验,实验结果如图所示:
。现取该溶液进行有关实验,实验结果如图所示:
下列说法不正确的是
| A.淡黄色沉淀甲不可能为AgBr |
| B.气体甲可能是混合气体 |
C.综合上述信息可以确定肯定存在的离子有:Na+、AlO 、S2O 、S2O |
D.由溶液甲生成气体乙的途径只有:Al3++3HCO =Al(OH)3↓+3CO2↑ =Al(OH)3↓+3CO2↑ |
您最近半年使用:0次
2022高二上·安徽阜阳·竞赛
解题方法
6 . 我们将有离子参与的反应叫做离子反应,下列离子方程式中正确的是
A.足量的碳酸氢钠与氢氧化钙溶液反应:HCO +Ca2++OH-=CaCO3↓+H2O +Ca2++OH-=CaCO3↓+H2O |
| B.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C.将使84消毒液有刺鼻性气味的气体通入水中:Cl2+H2O=H++Cl-+HClO |
D.将高铁酸钠(Na2FeO4)加入水中:4FeO +10H2O=4Fe(OH)3(胶体)+3O2↑+8OH- +10H2O=4Fe(OH)3(胶体)+3O2↑+8OH- |
您最近半年使用:0次
名校
解题方法
7 . 硫代硫酸钠( )是一种解毒药,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性环境中易分解。
)是一种解毒药,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性环境中易分解。
I. 的制备。制备原理为:
的制备。制备原理为: 。
。
(1)用化学用语解释通入 之前,混合溶液呈碱性的主要原因是:
之前,混合溶液呈碱性的主要原因是: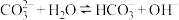 ,
,___________ 。
(2)为了保证硫代硫酸钠的产量,实验中通入的 ,能否过量
,能否过量___________ (填“能”或“否”);测定该混合溶液 的操作方法:
的操作方法:___________ 。
II.探究 与金属阳离子的反应。
与金属阳离子的反应。
资料:i.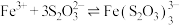 (紫黑色)
(紫黑色)
ⅱ. 为白色沉淀,
为白色沉淀, 可溶于过量的
可溶于过量的 溶液
溶液
(3)根据实验①的现象,初步判断最终 被
被 还原为
还原为 。该反应的离子方程式:
。该反应的离子方程式:___________ 。试从化学反应速率和平衡的角度解释实验①的现象:___________ 。
(4)进一步探究 和
和 反应。
反应。
实验③中白色絮状沉淀最后变为黑色沉淀(Ag2S)的化学方程式如下,填入合适的物质和系数: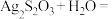
___________ 。
(5)根据以上实验可知: 与金属离子反应的多样性与
与金属离子反应的多样性与_______ 和_____ 有关。
 )是一种解毒药,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性环境中易分解。
)是一种解毒药,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性环境中易分解。I.
 的制备。制备原理为:
的制备。制备原理为: 。
。(1)用化学用语解释通入
 之前,混合溶液呈碱性的主要原因是:
之前,混合溶液呈碱性的主要原因是: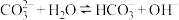 ,
,(2)为了保证硫代硫酸钠的产量,实验中通入的
 ,能否过量
,能否过量 的操作方法:
的操作方法:II.探究
 与金属阳离子的反应。
与金属阳离子的反应。资料:i.
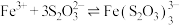 (紫黑色)
(紫黑色)ⅱ.
 为白色沉淀,
为白色沉淀, 可溶于过量的
可溶于过量的 溶液
溶液| 装置 | 编号 | 试剂X | 实验现象 |
 | ① |  溶液 溶液 | 混合后溶液先变成紫黑色, 后溶液几乎变为无色 后溶液几乎变为无色 |
| ② |  溶液 溶液 | 先生成白色絮状沉淀,振荡后,沉淀溶解,得到无色溶液 |
 被
被 还原为
还原为 。该反应的离子方程式:
。该反应的离子方程式:(4)进一步探究
 和
和 反应。
反应。| 装置 | 编号 | 试剂X | 实验现象 |
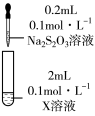 | ③ |  溶液 溶液 | 先生成白色絮状沉淀,沉淀很快变为黄色、棕色,最后为黑色沉淀。 |
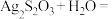
(5)根据以上实验可知:
 与金属离子反应的多样性与
与金属离子反应的多样性与
您最近半年使用:0次
名校
解题方法
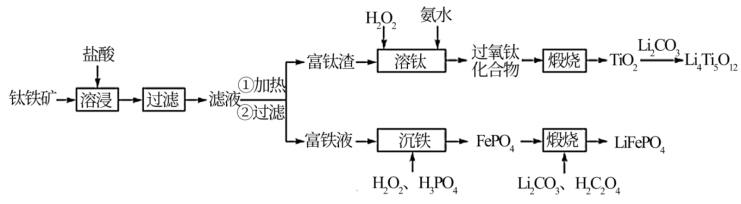
8 . 以钛铁矿(主要成分为FeO·TiO2,还含有MgO、CaO、SiO2等杂质)为原料合成锂离子电池的电极材料钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)的工艺流程如下:
回答下列问题:
(1)“溶浸”后溶液中的金属阳离子主要包括Mg2+、TiOCl+___________ 。“滤液”经加热水解后转化为富钛渣(钛元素主要以TiO2·2H2O形式存在),写出上述转变的离子方程式:___________ 。
(2)“溶钛”过程反应温度不能太高,其原因是___________ 。
(3)“沉铁”步骤反应的化学方程式为___________ ,“沉铁”后的滤液经处理后可返回___________ 工序循环利用。
(4)“煅烧”制备LiFePO4过程中,Li2CO3和H2C2O4的理论投入量的物质的量之比为___________ 。
(5)以Li4Ti5O12和LiFePO4作电极组成电池,充电时发生反应:Li4Ti5O12+LiFePO4=Li4+xTi5O12+Li1-xFePO4(0<x<1),阳极的电极反应式为___________ 。
(6)从废旧LiFePO4电极中可回收锂元素。用硝酸充分溶浸废旧LiFePO4电极,测得浸取液中c(Li+)=4mol·L-1,加入等体积的碳酸钠溶液将Li+转化为Li2CO3沉淀 ,若沉淀中的锂元素占浸取液中锂元素总量的90%,则反应后的溶液中CO 的浓度为
的浓度为___________ mol·L-1[已知Ksp(Li2CO3)=1.6×10-3,假设反应后溶液体积为反应前两溶液之和]。

回答下列问题:
(1)“溶浸”后溶液中的金属阳离子主要包括Mg2+、TiOCl+
(2)“溶钛”过程反应温度不能太高,其原因是
(3)“沉铁”步骤反应的化学方程式为
(4)“煅烧”制备LiFePO4过程中,Li2CO3和H2C2O4的理论投入量的物质的量之比为
(5)以Li4Ti5O12和LiFePO4作电极组成电池,充电时发生反应:Li4Ti5O12+LiFePO4=Li4+xTi5O12+Li1-xFePO4(0<x<1),阳极的电极反应式为
(6)从废旧LiFePO4电极中可回收锂元素。用硝酸充分溶浸废旧LiFePO4电极,测得浸取液中c(Li+)=4mol·L-1,加入等体积的碳酸钠溶液将Li+转化为Li2CO3沉淀 ,若沉淀中的锂元素占浸取液中锂元素总量的90%,则反应后的溶液中CO
 的浓度为
的浓度为
您最近半年使用:0次
2021-08-06更新
|
1468次组卷
|
4卷引用:九师联盟2021届高三下学期5月“考前练兵”联考理综化学试题
九师联盟2021届高三下学期5月“考前练兵”联考理综化学试题宁夏回族自治区银川一中2022届高三二模理科综合化学试题湖南省株洲市第八中学021-2022学年高三下学期5月月考化学试题(已下线)专题01 工艺流程专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)
名校
9 . 研究含硒工业废水的处理工艺,对控制水体中硒超标具有重要意义。
(1)已知:H2SeO3为二元弱酸,Ka1(H2SeO3)=3.5×10-3,Ka2(H2SeO3)=5.0×10-8。用离子交换树脂处理含Na2SeO3浓度较高的废水时,发生的交换反应为SeO +2RCl=R2SeO3+2Cl-(R为离子交换树脂的树脂骨架)。经离子交换法处理后,废水的pH将
+2RCl=R2SeO3+2Cl-(R为离子交换树脂的树脂骨架)。经离子交换法处理后,废水的pH将___ (填“增大”“减小”或“不变”)。
(2)木炭包覆纳米零价铁除硒法是一种改良的含硒废水处理方法。
已知木炭具有一定的还原性,以木炭和FeCl3·6H2O为原料,在N2氛围中迅速升温至600 ℃,保持2 h,过程中木炭包覆纳米零价铁。制备木炭包覆纳米零价铁过程中,木炭的作用有吸附和___ 。木炭包覆纳米零价铁在碱性废水中形成许多微电池,加速SeO 的还原过程。SeO
的还原过程。SeO 在微电池正极上转化为单质Se。
在微电池正极上转化为单质Se。
(3)绿锈[FeⅡaFeⅢb(OH)cXd](X代表阴离子,Ⅱ、Ⅲ表示铁元素的价态)中铁元素以结构态和游离态两种形式存在。由于结构态的双金属氢氧化物层间存在较大的空隙,形成了巨大的比表面积,同时结构态的FeⅡ还原能力优于游离态的FeⅡ,使得绿锈成为一种良好的除硒剂。
①结构态的绿锈具有优异的吸附性能,而且游离态的Fe3+还易水解生成Fe(OH)3胶体进一步吸附SeO 。写出Fe3+水解的离子方程式:
。写出Fe3+水解的离子方程式:___ 。
②不同FeⅡ/FeⅢ组成的绿锈对SeO 去除效果的影响结果如图1所示。随着绿锈组成中FeⅡ/FeⅢ比值的增大,绿锈的除硒效果先减小后增大的原因可能是
去除效果的影响结果如图1所示。随着绿锈组成中FeⅡ/FeⅢ比值的增大,绿锈的除硒效果先减小后增大的原因可能是___ 。

③废水的初始pH会对绿锈去除SeO 的效果产生影响,关系如图2所示。当初始pH增大至11时,SeO
的效果产生影响,关系如图2所示。当初始pH增大至11时,SeO 的去除效果突然迅速减小的原因是
的去除效果突然迅速减小的原因是___ 。
(1)已知:H2SeO3为二元弱酸,Ka1(H2SeO3)=3.5×10-3,Ka2(H2SeO3)=5.0×10-8。用离子交换树脂处理含Na2SeO3浓度较高的废水时,发生的交换反应为SeO
 +2RCl=R2SeO3+2Cl-(R为离子交换树脂的树脂骨架)。经离子交换法处理后,废水的pH将
+2RCl=R2SeO3+2Cl-(R为离子交换树脂的树脂骨架)。经离子交换法处理后,废水的pH将(2)木炭包覆纳米零价铁除硒法是一种改良的含硒废水处理方法。
已知木炭具有一定的还原性,以木炭和FeCl3·6H2O为原料,在N2氛围中迅速升温至600 ℃,保持2 h,过程中木炭包覆纳米零价铁。制备木炭包覆纳米零价铁过程中,木炭的作用有吸附和
 的还原过程。SeO
的还原过程。SeO 在微电池正极上转化为单质Se。
在微电池正极上转化为单质Se。(3)绿锈[FeⅡaFeⅢb(OH)cXd](X代表阴离子,Ⅱ、Ⅲ表示铁元素的价态)中铁元素以结构态和游离态两种形式存在。由于结构态的双金属氢氧化物层间存在较大的空隙,形成了巨大的比表面积,同时结构态的FeⅡ还原能力优于游离态的FeⅡ,使得绿锈成为一种良好的除硒剂。
①结构态的绿锈具有优异的吸附性能,而且游离态的Fe3+还易水解生成Fe(OH)3胶体进一步吸附SeO
 。写出Fe3+水解的离子方程式:
。写出Fe3+水解的离子方程式:②不同FeⅡ/FeⅢ组成的绿锈对SeO
 去除效果的影响结果如图1所示。随着绿锈组成中FeⅡ/FeⅢ比值的增大,绿锈的除硒效果先减小后增大的原因可能是
去除效果的影响结果如图1所示。随着绿锈组成中FeⅡ/FeⅢ比值的增大,绿锈的除硒效果先减小后增大的原因可能是
③废水的初始pH会对绿锈去除SeO
 的效果产生影响,关系如图2所示。当初始pH增大至11时,SeO
的效果产生影响,关系如图2所示。当初始pH增大至11时,SeO 的去除效果突然迅速减小的原因是
的去除效果突然迅速减小的原因是
您最近半年使用:0次
名校
解题方法
10 . 某固体X,可能含有BaCl2、NaHCO3、Fe2O3、Cu、NaAlO2中的一种或几种,进行如下实验:①取一定量样品溶于水中,得到固体A和溶液B;②向A中加入足量稀盐酸,得到澄清溶液C。下列说法不正确 的是
| A.固体A可能溶于NaOH溶液 |
| B.溶液C能与NaHCO3溶液反应产生沉淀 |
| C.向溶液C中加入KSCN溶液,若不变色,则混合物X不含Fe2O3 |
| D.向溶液B中加入NaOH溶液,若出现白色沉淀,则X中必定有BaCl2和NaHCO3 |
您最近半年使用:0次
2020-05-27更新
|
2248次组卷
|
5卷引用:浙江省宁波市2020届高三适应性考试(二模)化学试题
浙江省宁波市2020届高三适应性考试(二模)化学试题(已下线)第一节 铁及其化合物(二)-2020-2021学年高一化学必修第一册课时同步练(新人教)浙江省杭州市学军中学2021届高三11月模拟测试化学试题(已下线)考点04 离子反应-备战2022年高考化学一轮复习考点帮(浙江专用)江西省景德镇市2023-2024学年高二上学期1月期末化学试题



