真题
名校
1 . 聚合硫酸铁[Fe(OH)SO4]n能用作净水剂(絮凝剂),可由绿矾(FeSO4·7H2O)和KClO3在水溶液中反应得到。下列说法不正确 的是
| A.KClO3作氧化剂,每生成1 mol [Fe(OH)SO4]n消耗6/n mol KClO3 |
| B.生成聚合硫酸铁后,水溶液的pH增大 |
| C.聚合硫酸铁可在水中形成氢氧化铁胶体而净水 |
| D.在相同条件下,Fe3+比[Fe(OH)]2+的水解能力更强 |
您最近一年使用:0次
2019-04-12更新
|
5899次组卷
|
36卷引用:广东省佛山市第一中学2020-2021学年高二上学期期中考试化学(选考)试题
广东省佛山市第一中学2020-2021学年高二上学期期中考试化学(选考)试题2019年4月浙江省普通高校招生选考科目考试化学试题福建省华安一中2018-2019学年高二下学期期末考试化学试题湖南省长沙市第一中学2020届高三第一次月考化学试题江西省宜春市奉新县第一中学2020届高三上学期第二次月考化学试题黑龙江省牡丹江市第一高级中学2020届高三10月月考化学试题河北省邯郸市2019-2020学年高三上学期期中考试化学试题2020届高考化学小题狂练(全国通用版)专练5 氧化还原反应辽宁省抚顺市第一中学2020届高三上学期期中考试化学试题江西省吉安市五校2019-2020学年高二上学期第二次联考化学试题2020届高三化学化学二轮复习——高考常考题:氧化还原反应的实际应用【精编选择25题】专题1.3 氧化还原反应(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专题六 元素化合物的性质、应用及转化(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训(已下线)小题必刷08 氧化还原反应的规律及应用——2021年高考化学一轮复习小题必刷(通用版)安徽省池州市第一中学2020-2021学年高二12月月考化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练上海交通大学附属中学2021届高三下学期3月月考化学试题(已下线)课时17 铁及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)3.3.1 盐类的水解-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)专题05.元素及其化合物-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)考向26 盐类的水解-备战2022年高考化学一轮复习考点微专题(已下线)考点04 氧化还原反应-备战2022年高考化学学霸纠错(全国通用)(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)湖南省长沙市雅礼中学2022-2023学年高三上学期第五次月考化学试题第三章 金属及其化合物 第13讲 铁及其重要化合物湖南省株洲市第四中学2023届高三第六次月考化学试题(已下线)题型27 铁及其化合物的性质、用途及相关计算重庆市万州第二高级中学2022-2023学年高三下学期5月月考化学试题新疆喀什地区伽师县2022-2023学年高三上学期11月期中考试化学试题(已下线)2019年高考浙江卷化学试题变式题(单选题21-25)北京市第八十中学2024届高三上学期10月月考化学试题化学江苏省扬州市宝应区2023-2024学年曹甸高级中学高三上学期9月化学试卷
16-17高二下·河北衡水·期末
真题
名校
2 . 常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
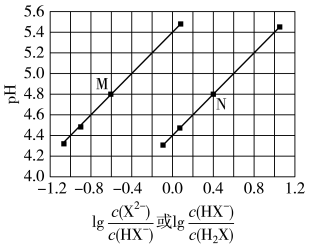

| A.Ka2(H2X)的数量级为10–6 |
B.曲线N表示pH与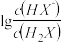 的变化关系 的变化关系 |
| C.NaHX溶液中c(H+)>c(OH-) |
| D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+) |
您最近一年使用:0次
2017-08-09更新
|
17069次组卷
|
70卷引用:广东省深圳中学2020届高三3月份教学质量监测卷理综化学试题
(已下线)广东省深圳中学2020届高三3月份教学质量监测卷理综化学试题广东省深圳中学2020年高中毕业班教学质量监测卷理科综合化学试题广东省广州市第一一三中学2020-2021学年高二上学期第二阶段考试化学(选考)试题广东省中山大学附属中学2023-2024学年高三上学期8月阶段性检测化学试题河北省安平中学2016-2017学年高二下学期期末考试化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅰ卷精编版)黑龙江省哈尔滨市第六中学2017-2018学年高二12月月考化学试题黑龙江省哈尔滨六中2017-2018学年高二12月月考化学试卷辽宁省沈阳市东北育才学校2017-2018学年高二上学期期中考试化学试题云南民族大学附属中学2017-2018学年高二下学期第一次月考化学试题(已下线)《考前20天终极攻略》6月4日 专项四 化学坐标曲线图分析(已下线)《考前20天终极攻略》-5月23日 溶液中的离子平衡(已下线)解密12 盐类的水解——备战2018年高考化学之高频考点解密2018-2019学年鲁科版高中化学选修四:第3章检测题(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第5讲 数形结合思想的应用【教学案】【全国百强校】四川省棠湖中学2019届高三上学期第三次月考理综-化学试题【全国百强校】山西省晋中市平遥县平遥中学2019届高三上学期12月月考化学试题河南省辉县市一中2018-2019学年高二上学期第二次阶段性考试化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高二下学期期中考试化学试题安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题河北安平中学2020届高三上学期第二次月考化学试题天津市耀华中学2019-2020学年度高二上学学期期中考试化学试题2019年秋高三化学复习强化练习—— 电解质溶液中的曲线问题江西省上饶中学2019-2020学年高二上学期期中考试(零班、培优班)化学试题吉林省长春市田家炳实验中学2019-2020学年高二上学期期末考试化学试题辽宁省锦州市滨海实验中学2019-2020学年高三上学期期末考试化学试题备考突破2020高三化学专题强化集训——电解质溶液中的曲线问题辽宁省锦州市滨海实验中学2020届高三模拟考试理综化学试题重庆市江北中学2019-2020学年高二上学期期末模拟考试化学试题四川省泸县第四中学2020届高三下学期第一次在线月考理综化学试题(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训云南省大理白族自治州祥云县第一中学2020届高三下学期4月月考理综化学试题河北省沧州市盐山中学2019-2020学年高二上学期期末考试(B)化学试题(已下线)考点11 弱电解质的电离及溶液pH-2020年高考化学命题预测与模拟试题分类精编(已下线)2020年高考化学押题预测卷02(新课标Ⅲ卷)--《2020年高考押题预测卷》河北衡水中学2020届高三下学期三月份教学质量监测理科综合化学试题四川省成都市第七中学2020年高中毕业班教学质量监测卷理科综合化学试题湖南省长沙市礼雅中学2020届高三下学期三月份网络教学质量监测理科综合化学试题贵州省贵阳市第一中学2020届高三教学质量监测理科综合化学试题安徽省合肥市第一中学2019-2020学年高二上学期段二(期中)考试化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第2节 弱电解质的电离盐类的水解(已下线)第03章 物质在水溶液中的行为 (B卷能力提升卷) -2020-2021学年高二化学选择性必修1同步单元AB卷(新教材鲁科版)(已下线)易错18 电解质溶液图像-备战2021年高考化学一轮复习易错题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 过高考 3年真题强化闯关河南省焦作市博爱县英才学校2020-2021学年高二上学期11月月考化学试题甘肃省白银市会宁县第一中学2020-2021学年高二上学期第二次月考化学试题四川省成都市龙泉中学2021届高三上学期1月月考理综化学试题江西省抚州市金溪县第一中学2020-2021学年高二上学期第二次月考化学试题(已下线)专题12 水溶液中离子平衡(攻克各种图像问题)-2021年高考化学必做热点专题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)河北省尚义一中2020-2021学年高二下学期期中考试化学试题四川省遂宁市射洪中学2020—2021学年高二下学期第三次月考化学试题(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点25 盐类的水解-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时44 滴定曲线、分布系数曲线的分析-2022年高考化学一轮复习小题多维练(全国通用)湖北省武汉市华中师范大学第一附属中学2020届高三3月份网络教学质量监测卷理综化学试题重庆育才中学2021-2022学年高二上学期第三次定时练习化学试题山西省太原市第五中学2021-2022学年高二上学期12月月考化学试题(已下线)考点28 盐类的水解-备战2023年高考化学一轮复习考点帮(全国通用)江西省抚州市金溪县第一中学2021-2022学年高二下学期第二次月考化学试题(已下线)专题06 水溶液中的离子平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题21 电解质溶液图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题11 水溶液中的离子平衡图像(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(已下线)专题四 电解质溶液图象(讲)湖南省张家界市民族中学2023-2024学年高二上学期第二次月考化学试题山西省实验中学2023-2024学年高二上学期期中考试化学试题内蒙古呼伦贝尔市海拉尔第二中学2023-2024学年高二上学期期末考试化学试题浙江省杭州市源清中学2023-2024学年高二上学期期末考试化学试题江西省宜春市宜丰中学2023-2024学年高一上学期1月期末化学试题
解题方法
3 . 金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如下:
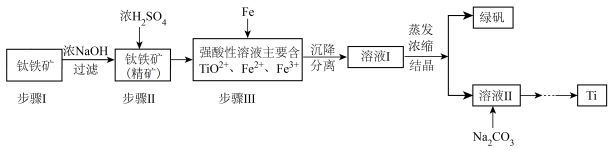
已知:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O
(1)步骤I中发生反应的离子方程式:____________________ 、_____________________ 。
(2)已知:TiO2+易水解,只能存在于强酸性溶液中。
25 ℃时,难溶电解质溶解度(s)与pH关系如图,TiO(OH)2溶度积Ksp=1×10-29
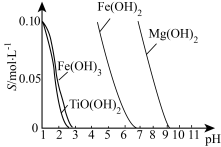
①步骤Ⅲ加入铁屑原因是____________________ 。
②TiO2+水解的离子方程式为______________ 。向溶液II中加入Na2CO3粉末的作用是_______ 。当溶液pH接近_____ 时,TiO(OH)2已沉淀完全。
(3)TiCl4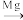 Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于
Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于_______ ℃即可。
(4)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。写出阳极上所发生的反应式:___________________ 。


已知:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O
(1)步骤I中发生反应的离子方程式:
(2)已知:TiO2+易水解,只能存在于强酸性溶液中。
25 ℃时,难溶电解质溶解度(s)与pH关系如图,TiO(OH)2溶度积Ksp=1×10-29

①步骤Ⅲ加入铁屑原因是
②TiO2+水解的离子方程式为
(3)TiCl4
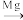 Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于
Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |

您最近一年使用:0次
14-15高三上·广东汕头·期中
解题方法
4 . 明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:

回答下列问题:
(1)明矾净水的原理是(用离子方程表示)_________________________________ 。
(2)操作Ⅰ是_____________ ,操作Ⅱ是蒸发浓缩、_______________ 、过滤、_____ 、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是(只用一种试剂)_________________ 。
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下Fe2+转化为Fe3+,MnO4-转化为Mn2+)_________________________________________________ 。
已知:生成氢氧化物沉淀的pH如下表所示
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释调pH=3的目的_______________________________________ 。
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:_______________ 。滤渣2含有的物质是___________ 。

回答下列问题:
(1)明矾净水的原理是(用离子方程表示)
(2)操作Ⅰ是
(3)检验滤液A中是否存在Fe2+的试剂是(只用一种试剂)
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下Fe2+转化为Fe3+,MnO4-转化为Mn2+)
已知:生成氢氧化物沉淀的pH如下表所示
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释调pH=3的目的
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:
您最近一年使用:0次



