真题
解题方法
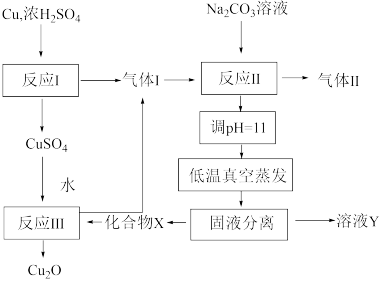
1 . 一种制备 的工艺路线如图所示,反应Ⅱ所得溶液
的工艺路线如图所示,反应Ⅱ所得溶液 在3~4之间,反应Ⅲ需及时补加
在3~4之间,反应Ⅲ需及时补加 以保持反应在
以保持反应在 条件下进行。常温下,
条件下进行。常温下, 的电离平衡常数
的电离平衡常数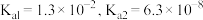 。下列说法正确的是
。下列说法正确的是
 的工艺路线如图所示,反应Ⅱ所得溶液
的工艺路线如图所示,反应Ⅱ所得溶液 在3~4之间,反应Ⅲ需及时补加
在3~4之间,反应Ⅲ需及时补加 以保持反应在
以保持反应在 条件下进行。常温下,
条件下进行。常温下, 的电离平衡常数
的电离平衡常数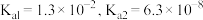 。下列说法正确的是
。下列说法正确的是
| A.反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应 |
B.低温真空蒸发主要目的是防止 被氧化 被氧化 |
| C.溶液Y可循环用于反应Ⅱ所在操作单元吸收气体Ⅰ |
D.若 产量不变,参与反应Ⅲ的 产量不变,参与反应Ⅲ的 与 与 物质的量之比 物质的量之比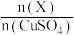 增大时,需补加 增大时,需补加 的量减少 的量减少 |
您最近一年使用:0次
2023·上海·模拟预测
2 . 0.1 mol·L NaOH溶液分别滴入20 mL 0.1 mol·L
NaOH溶液分别滴入20 mL 0.1 mol·L HX溶液与20 mL 0.1 mol·L
HX溶液与20 mL 0.1 mol·L HCl溶液中,其pH随滴入NaOH溶液体积变化的图像如图所示。下列说法正确的是
HCl溶液中,其pH随滴入NaOH溶液体积变化的图像如图所示。下列说法正确的是

 NaOH溶液分别滴入20 mL 0.1 mol·L
NaOH溶液分别滴入20 mL 0.1 mol·L HX溶液与20 mL 0.1 mol·L
HX溶液与20 mL 0.1 mol·L HCl溶液中,其pH随滴入NaOH溶液体积变化的图像如图所示。下列说法正确的是
HCl溶液中,其pH随滴入NaOH溶液体积变化的图像如图所示。下列说法正确的是
A.b点: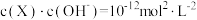 | B.c点: |
| C.a、d点溶液混合后为酸性 | D.水的电离程度:d>c>b>a |
您最近一年使用:0次
解题方法
3 . 高纯氟化镁具备优异的光学性质和抗腐蚀性被广泛应用于高端领域。某研究小组利用镁片(含 及少量惰性杂质)制备高纯氟化镁流程如下,请回答:
及少量惰性杂质)制备高纯氟化镁流程如下,请回答:

已知:
①甲醇沸点: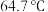
②该实验条件得到的氟化镁并不是晶型沉淀,其颗粒细小,常常吸附水分成黏稠胶状。
(1)利用图1装置可检测镁与甲醇反应速率。仪器A的名称___________ 。

(2)写出氟化反应涉及的化学方程式___________ 。
(3)下列有关说法不正确的是___________。
(4)步骤Ⅱ的一系列操作目的是为获得固体A.从下列选项中选择合理的仪器和操作,补全如下步骤[“_______”上填写一件最关键仪器 ,“(_______)”内填写一种操作 ,均用字母表示]________ 。
取仪器A中的溶液,用___________(___________)→用___________(蒸馏减少溶剂)→用___________(___________)→用漏斗(过滤得到固体A)
【仪器】a.烧杯;b.铜质保温漏斗;c.漏斗;d.空气冷凝管;e.直形冷凝管;f.球形冷凝管
【操作】g。过滤;h.趁热过滤;i.冷却结晶;j。蒸发结晶
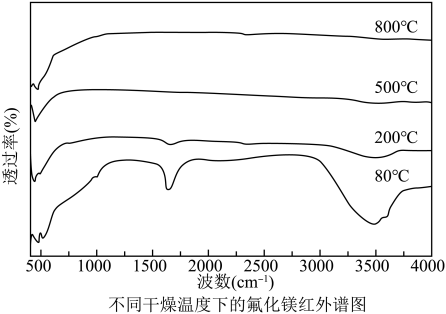
(5)步骤Ⅴ:产品在不同温度下干燥 ,对其进行红外光谱分析如下图,已知羟基引起的吸收峰在
,对其进行红外光谱分析如下图,已知羟基引起的吸收峰在 波数处请选择最合适的温度
波数处请选择最合适的温度___________ 。(填“ 、
、 、
、 或
或 ”)
”)
 及少量惰性杂质)制备高纯氟化镁流程如下,请回答:
及少量惰性杂质)制备高纯氟化镁流程如下,请回答:
已知:
①甲醇沸点:
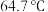
②该实验条件得到的氟化镁并不是晶型沉淀,其颗粒细小,常常吸附水分成黏稠胶状。
(1)利用图1装置可检测镁与甲醇反应速率。仪器A的名称

(2)写出氟化反应涉及的化学方程式
(3)下列有关说法不正确的是___________。
A.步骤Ⅰ:反应温度不选择 ,主要由于在 ,主要由于在 反应过于剧烈难以控制。 反应过于剧烈难以控制。 |
| B.步骤Ⅱ:待镁片上不再有微小气泡生成时,可进行步骤Ⅱ。 |
C.步骤Ⅲ:制备悬浊液B,应先将 通入高纯水达到饱和,再加到固体A中。 通入高纯水达到饱和,再加到固体A中。 |
| D.步骤Ⅳ:在进行氟化反应时,应做好防护措施和配备应急药品。 |
取仪器A中的溶液,用___________(___________)→用___________(蒸馏减少溶剂)→用___________(___________)→用漏斗(过滤得到固体A)
【仪器】a.烧杯;b.铜质保温漏斗;c.漏斗;d.空气冷凝管;e.直形冷凝管;f.球形冷凝管
【操作】g。过滤;h.趁热过滤;i.冷却结晶;j。蒸发结晶
(5)步骤Ⅴ:产品在不同温度下干燥
 ,对其进行红外光谱分析如下图,已知羟基引起的吸收峰在
,对其进行红外光谱分析如下图,已知羟基引起的吸收峰在 波数处请选择最合适的温度
波数处请选择最合适的温度 、
、 、
、 或
或 ”)
”)
您最近一年使用:0次
2023-04-14更新
|
913次组卷
|
2卷引用:浙江省绍兴市2023届高三二模考试化学试题
解题方法
4 . 在含单质碘的 溶液中存在可逆反应:
溶液中存在可逆反应: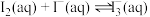 ,为测定该反应的平衡常数K进行如下实验,实验步骤如下:
,为测定该反应的平衡常数K进行如下实验,实验步骤如下:
I.在装有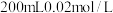 的
的 溶液的碘量瓶中加入足量
溶液的碘量瓶中加入足量 ,充分搅拌溶解,待过量的固体碘沉于瓶底后,取
,充分搅拌溶解,待过量的固体碘沉于瓶底后,取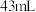 上层清液,用
上层清液,用 萃取,充分振荡、静置、分液,得到
萃取,充分振荡、静置、分液,得到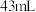 萃取后的水溶液、
萃取后的水溶液、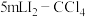 溶液。
溶液。
II.取萃取后的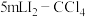 溶液于碘量瓶中,加水充分振荡,再加入质量分数为
溶液于碘量瓶中,加水充分振荡,再加入质量分数为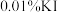 溶液,充分振荡后,静置5分钟,用
溶液,充分振荡后,静置5分钟,用 的
的 标准溶液滴定至淡黄色时,注入
标准溶液滴定至淡黄色时,注入 的淀粉溶液,平行滴定3次,平均消耗
的淀粉溶液,平行滴定3次,平均消耗 溶液。
溶液。
III.将萃取后的水溶液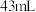 移入碘量瓶中,用
移入碘量瓶中,用 的
的 标准溶液滴定至淡黄色时,注入
标准溶液滴定至淡黄色时,注入 的淀粉溶液,平行滴定3次,平均消耗
的淀粉溶液,平行滴定3次,平均消耗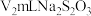 溶液。
溶液。
已知:i.
ii. 与
与 难溶于
难溶于
iii.室温下,达到溶解平衡后, 在
在 层和水层中的分配比
层和水层中的分配比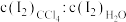 为86∶1
为86∶1
回答下列问题:
(1)下列萃取分液操作中没有用到的仪器有_______(填标号)。
(2) 易溶于
易溶于 的原因是
的原因是_______ 。
(3)滴定过程中 标准溶液应装在
标准溶液应装在_______ 滴定管(填“酸式”或“碱式”),滴定终点的现象是_______ 。
(4)步骤II中加入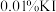 溶液的目的是
溶液的目的是_______ 。
(5)步骤III测得萃取后的水溶液中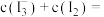
_______  ,平衡常数
,平衡常数
_______ (列出计算式即可)。
(6)下列关于实验误差分析的说法正确的是_______(填标号)。
 溶液中存在可逆反应:
溶液中存在可逆反应: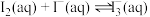 ,为测定该反应的平衡常数K进行如下实验,实验步骤如下:
,为测定该反应的平衡常数K进行如下实验,实验步骤如下:I.在装有
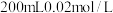 的
的 溶液的碘量瓶中加入足量
溶液的碘量瓶中加入足量 ,充分搅拌溶解,待过量的固体碘沉于瓶底后,取
,充分搅拌溶解,待过量的固体碘沉于瓶底后,取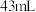 上层清液,用
上层清液,用 萃取,充分振荡、静置、分液,得到
萃取,充分振荡、静置、分液,得到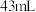 萃取后的水溶液、
萃取后的水溶液、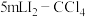 溶液。
溶液。II.取萃取后的
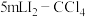 溶液于碘量瓶中,加水充分振荡,再加入质量分数为
溶液于碘量瓶中,加水充分振荡,再加入质量分数为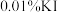 溶液,充分振荡后,静置5分钟,用
溶液,充分振荡后,静置5分钟,用 的
的 标准溶液滴定至淡黄色时,注入
标准溶液滴定至淡黄色时,注入 的淀粉溶液,平行滴定3次,平均消耗
的淀粉溶液,平行滴定3次,平均消耗 溶液。
溶液。III.将萃取后的水溶液
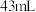 移入碘量瓶中,用
移入碘量瓶中,用 的
的 标准溶液滴定至淡黄色时,注入
标准溶液滴定至淡黄色时,注入 的淀粉溶液,平行滴定3次,平均消耗
的淀粉溶液,平行滴定3次,平均消耗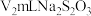 溶液。
溶液。已知:i.

ii.
 与
与 难溶于
难溶于
iii.室温下,达到溶解平衡后,
 在
在 层和水层中的分配比
层和水层中的分配比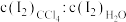 为86∶1
为86∶1回答下列问题:
(1)下列萃取分液操作中没有用到的仪器有_______(填标号)。
A. | B. | C. | D. |
 易溶于
易溶于 的原因是
的原因是(3)滴定过程中
 标准溶液应装在
标准溶液应装在(4)步骤II中加入
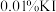 溶液的目的是
溶液的目的是(5)步骤III测得萃取后的水溶液中
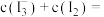
 ,平衡常数
,平衡常数
(6)下列关于实验误差分析的说法正确的是_______(填标号)。
A.步骤I中碘量瓶若没有充分振荡,则导致所测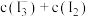 值偏大 值偏大 |
| B.步骤I中吸取上层清液时,不慎吸入碘固体,则测得的K偏小 |
| C.步骤II中滴定前滴定管有气泡,滴定后气泡消失,则测得的K偏大 |
| D.步骤III中滴定终点时俯视读数,则测得的K偏小 |
您最近一年使用:0次
名校
解题方法
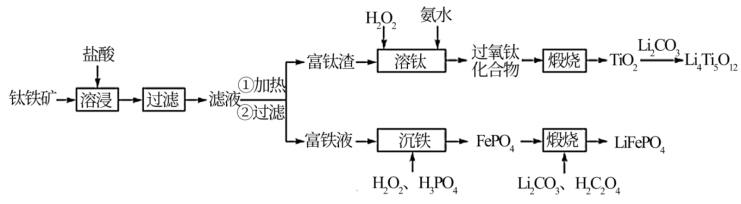
5 . 以钛铁矿(主要成分为FeO·TiO2,还含有MgO、CaO、SiO2等杂质)为原料合成锂离子电池的电极材料钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)的工艺流程如下:
回答下列问题:
(1)“溶浸”后溶液中的金属阳离子主要包括Mg2+、TiOCl+___________ 。“滤液”经加热水解后转化为富钛渣(钛元素主要以TiO2·2H2O形式存在),写出上述转变的离子方程式:___________ 。
(2)“溶钛”过程反应温度不能太高,其原因是___________ 。
(3)“沉铁”步骤反应的化学方程式为___________ ,“沉铁”后的滤液经处理后可返回___________ 工序循环利用。
(4)“煅烧”制备LiFePO4过程中,Li2CO3和H2C2O4的理论投入量的物质的量之比为___________ 。
(5)以Li4Ti5O12和LiFePO4作电极组成电池,充电时发生反应:Li4Ti5O12+LiFePO4=Li4+xTi5O12+Li1-xFePO4(0<x<1),阳极的电极反应式为___________ 。
(6)从废旧LiFePO4电极中可回收锂元素。用硝酸充分溶浸废旧LiFePO4电极,测得浸取液中c(Li+)=4mol·L-1,加入等体积的碳酸钠溶液将Li+转化为Li2CO3沉淀 ,若沉淀中的锂元素占浸取液中锂元素总量的90%,则反应后的溶液中CO 的浓度为
的浓度为___________ mol·L-1[已知Ksp(Li2CO3)=1.6×10-3,假设反应后溶液体积为反应前两溶液之和]。

回答下列问题:
(1)“溶浸”后溶液中的金属阳离子主要包括Mg2+、TiOCl+
(2)“溶钛”过程反应温度不能太高,其原因是
(3)“沉铁”步骤反应的化学方程式为
(4)“煅烧”制备LiFePO4过程中,Li2CO3和H2C2O4的理论投入量的物质的量之比为
(5)以Li4Ti5O12和LiFePO4作电极组成电池,充电时发生反应:Li4Ti5O12+LiFePO4=Li4+xTi5O12+Li1-xFePO4(0<x<1),阳极的电极反应式为
(6)从废旧LiFePO4电极中可回收锂元素。用硝酸充分溶浸废旧LiFePO4电极,测得浸取液中c(Li+)=4mol·L-1,加入等体积的碳酸钠溶液将Li+转化为Li2CO3沉淀 ,若沉淀中的锂元素占浸取液中锂元素总量的90%,则反应后的溶液中CO
 的浓度为
的浓度为
您最近一年使用:0次
2021-08-06更新
|
1479次组卷
|
4卷引用:九师联盟2021届高三下学期5月“考前练兵”联考理综化学试题
九师联盟2021届高三下学期5月“考前练兵”联考理综化学试题宁夏回族自治区银川一中2022届高三二模理科综合化学试题湖南省株洲市第八中学021-2022学年高三下学期5月月考化学试题(已下线)专题01 工艺流程专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)
名校
解题方法
6 . 某固体X,可能含有BaCl2、NaHCO3、Fe2O3、Cu、NaAlO2中的一种或几种,进行如下实验:①取一定量样品溶于水中,得到固体A和溶液B;②向A中加入足量稀盐酸,得到澄清溶液C。下列说法不正确 的是
| A.固体A可能溶于NaOH溶液 |
| B.溶液C能与NaHCO3溶液反应产生沉淀 |
| C.向溶液C中加入KSCN溶液,若不变色,则混合物X不含Fe2O3 |
| D.向溶液B中加入NaOH溶液,若出现白色沉淀,则X中必定有BaCl2和NaHCO3 |
您最近一年使用:0次
2020-05-27更新
|
2269次组卷
|
5卷引用:浙江省宁波市2020届高三适应性考试(二模)化学试题
浙江省宁波市2020届高三适应性考试(二模)化学试题浙江省杭州市学军中学2021届高三11月模拟测试化学试题(已下线)考点04 离子反应-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第一节 铁及其化合物(二)-2020-2021学年高一化学必修第一册课时同步练(新人教)江西省景德镇市2023-2024学年高二上学期1月期末化学试题
解题方法
7 . 25℃,改变0.01mol/L CH3COONa溶液的pH,溶液中CH3COOH、CH3COO-、H+、OH-浓度的对数值1gc与溶液pH的变化关系如图所示。下列叙述不正确 的是
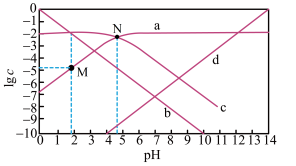

| A.d线表示OH- |
| B.pH=6时,c(CH3COOH)>c(CH3COO-)>c(H+) |
| C.点M的纵坐标与点N的横坐标数值相等,符号相反 |
| D.0.01mol·L-1 CH3COONa的pH约等于线c与线d交点处的横坐标值 |
您最近一年使用:0次
真题
解题方法
8 . 某兴趣小组在定量分析了镁渣[含有MgCO3、Mg(OH)2、CaCO3、Al2O3、Fe2O3和SiO2]中Mg含量的基础上,按如下流程制备六水合氯化镁(MgCl2·6H2O)。

相关信息如下:
①700℃只发生MgCO3和Mg(OH)2的分解反应。
②NH4Cl溶液仅与体系中的MgO反应,且反应程度不大。
③“蒸氨”是将氨从固液混合物中蒸出来,且须控制合适的蒸出量。
请回答:
(1) 下列说法正确的是________ 。
A.步骤Ⅰ,煅烧样品的容器可以用坩埚,不能用烧杯和锥形瓶
B.步骤Ⅲ,蒸氨促进平衡正向移动,提高MgO的溶解量
C.步骤Ⅲ,可以将固液混合物C先过滤,再蒸氨
D.步骤Ⅳ,固液分离操作可采用常压过滤,也可采用减压过滤
(2) 步骤Ⅲ,需要搭建合适的装置,实现蒸氨、吸收和指示于一体(用硫酸溶液吸收氨气)。
①选择必须的仪器,并按连接顺序排列(填写代表仪器的字母,不考虑夹持和橡皮管连接):热源→________ 。

②为了指示蒸氨操作完成,在一定量硫酸溶液中加指示剂。请给出并说明蒸氨可以停止时的现象________ 。
(3) 溶液F经盐酸酸化、蒸发、结晶、过滤、洗涤和低温干燥得到产品。取少量产品溶于水后发现溶液呈碱性。
①含有的杂质是________ 。
②从操作上分析引入杂质的原因是________ 。
(4) 有同学采用盐酸代替步骤Ⅱ中的NH4Cl溶液处理固体B,然后除杂,制备MgCl2溶液。已知金属离子形成氢氧化物沉淀的pH范围:
请给出合理的操作排序(从下列操作中选取,按先后次序列出字母,操作可重复使用):固体B→a→( ) →( ) →( ) →( ) →( ) →( ) →MgCl2溶液→产品。
a.用盐酸溶解 b.调pH=3.0 c.调pH=5.0 d.调pH=8.5
e.调pH=11.0 f.过滤 g.洗涤

相关信息如下:
①700℃只发生MgCO3和Mg(OH)2的分解反应。
②NH4Cl溶液仅与体系中的MgO反应,且反应程度不大。
③“蒸氨”是将氨从固液混合物中蒸出来,且须控制合适的蒸出量。
请回答:
(1) 下列说法正确的是
A.步骤Ⅰ,煅烧样品的容器可以用坩埚,不能用烧杯和锥形瓶
B.步骤Ⅲ,蒸氨促进平衡正向移动,提高MgO的溶解量
C.步骤Ⅲ,可以将固液混合物C先过滤,再蒸氨
D.步骤Ⅳ,固液分离操作可采用常压过滤,也可采用减压过滤
(2) 步骤Ⅲ,需要搭建合适的装置,实现蒸氨、吸收和指示于一体(用硫酸溶液吸收氨气)。
①选择必须的仪器,并按连接顺序排列(填写代表仪器的字母,不考虑夹持和橡皮管连接):热源→

②为了指示蒸氨操作完成,在一定量硫酸溶液中加指示剂。请给出并说明蒸氨可以停止时的现象
(3) 溶液F经盐酸酸化、蒸发、结晶、过滤、洗涤和低温干燥得到产品。取少量产品溶于水后发现溶液呈碱性。
①含有的杂质是
②从操作上分析引入杂质的原因是
(4) 有同学采用盐酸代替步骤Ⅱ中的NH4Cl溶液处理固体B,然后除杂,制备MgCl2溶液。已知金属离子形成氢氧化物沉淀的pH范围:
| 金属离子 | pH | |
| 开始沉淀 | 完全沉淀 | |
| Al3+ | 3.0 | 4.7 |
| Fe3+ | 1.1 | 2.8 |
| Ca2+ | 11.3 | - |
| Mg2+ | 8.4 | 10.9 |
a.用盐酸溶解 b.调pH=3.0 c.调pH=5.0 d.调pH=8.5
e.调pH=11.0 f.过滤 g.洗涤
您最近一年使用:0次
2019-04-12更新
|
3935次组卷
|
6卷引用:2019年4月浙江省普通高校招生选考科目考试化学试题
2019年4月浙江省普通高校招生选考科目考试化学试题(已下线)专题10.3 化学实验方案的设计与评价 (讲)-《2020年高考一轮复习讲练测》(已下线)专题10.3 化学实验方案的设计与评价 (练)-《2020年高考一轮复习讲练测》(已下线)2021年高考化学押题预测卷(湖南卷)02(含考试版、答题卡、参考答案、全解全析)(已下线)专题21.化学工艺流程分析-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)2019年高考浙江卷化学试题变式题(实验题)
真题
名校
9 . 聚合硫酸铁[Fe(OH)SO4]n能用作净水剂(絮凝剂),可由绿矾(FeSO4·7H2O)和KClO3在水溶液中反应得到。下列说法不正确 的是
| A.KClO3作氧化剂,每生成1 mol [Fe(OH)SO4]n消耗6/n mol KClO3 |
| B.生成聚合硫酸铁后,水溶液的pH增大 |
| C.聚合硫酸铁可在水中形成氢氧化铁胶体而净水 |
| D.在相同条件下,Fe3+比[Fe(OH)]2+的水解能力更强 |
您最近一年使用:0次
2019-04-12更新
|
5899次组卷
|
36卷引用:2019年4月浙江省普通高校招生选考科目考试化学试题
2019年4月浙江省普通高校招生选考科目考试化学试题湖南省长沙市第一中学2020届高三第一次月考化学试题江西省宜春市奉新县第一中学2020届高三上学期第二次月考化学试题黑龙江省牡丹江市第一高级中学2020届高三10月月考化学试题河北省邯郸市2019-2020学年高三上学期期中考试化学试题2020届高考化学小题狂练(全国通用版)专练5 氧化还原反应辽宁省抚顺市第一中学2020届高三上学期期中考试化学试题2020届高三化学化学二轮复习——高考常考题:氧化还原反应的实际应用【精编选择25题】专题1.3 氧化还原反应(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专题六 元素化合物的性质、应用及转化(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训(已下线)小题必刷08 氧化还原反应的规律及应用——2021年高考化学一轮复习小题必刷(通用版)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练上海交通大学附属中学2021届高三下学期3月月考化学试题(已下线)课时17 铁及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题05.元素及其化合物-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)考向26 盐类的水解-备战2022年高考化学一轮复习考点微专题(已下线)考点04 氧化还原反应-备战2022年高考化学学霸纠错(全国通用)(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)湖南省长沙市雅礼中学2022-2023学年高三上学期第五次月考化学试题第三章 金属及其化合物 第13讲 铁及其重要化合物湖南省株洲市第四中学2023届高三第六次月考化学试题(已下线)题型27 铁及其化合物的性质、用途及相关计算重庆市万州第二高级中学2022-2023学年高三下学期5月月考化学试题新疆喀什地区伽师县2022-2023学年高三上学期11月期中考试化学试题(已下线)2019年高考浙江卷化学试题变式题(单选题21-25)北京市第八十中学2024届高三上学期10月月考化学试题化学江苏省扬州市宝应区2023-2024学年曹甸高级中学高三上学期9月化学试卷福建省华安一中2018-2019学年高二下学期期末考试化学试题江西省吉安市五校2019-2020学年高二上学期第二次联考化学试题广东省佛山市第一中学2020-2021学年高二上学期期中考试化学(选考)试题安徽省池州市第一中学2020-2021学年高二12月月考化学试题(已下线)3.3.1 盐类的水解-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)
10 . 氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂。一种由海绵铜(Cu和少量CuO等)为原料制备CuCl的工艺流程如下:
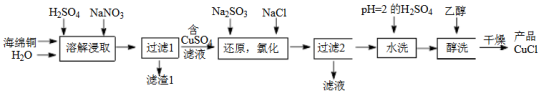
(1)“溶解浸取”时,需将海绵铜粉碎成细颗粒,其目的是___________ 。
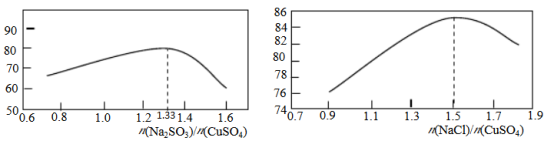
(2)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图所示:
①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离子方程式为___________ 。
②当n(Na2SO3)/n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是___________ 。
③当1.0<n(NaCl)/n(CuSO4)<1.5时,比值越大CuCl产率越大,其原因是___________ 。
(3)“粗产品”用pH=2的H2SO4水洗,若不慎用稀硝酸进行稀释,则对产品有何影响___________ 。
(4)用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为______________________ 。
(5)某同学拟测定产品中氯化亚铜的质量分数。实验过程如下:准确称取制备的氯化亚铜产品1.600g,将其置于足量的FeCl3溶液中,待样品全部溶解后,加入适量稀硫酸,用0.2000mol·L-1的KMnO4标准溶液滴定到终点,消耗KMnO4溶液15.00mL,反应中MnO4-被还原为Mn2+,则产品中氯化亚铜的质量分数为______________________ 。

(1)“溶解浸取”时,需将海绵铜粉碎成细颗粒,其目的是

(2)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图所示:
①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离子方程式为
②当n(Na2SO3)/n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是
③当1.0<n(NaCl)/n(CuSO4)<1.5时,比值越大CuCl产率越大,其原因是
(3)“粗产品”用pH=2的H2SO4水洗,若不慎用稀硝酸进行稀释,则对产品有何影响
(4)用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为
(5)某同学拟测定产品中氯化亚铜的质量分数。实验过程如下:准确称取制备的氯化亚铜产品1.600g,将其置于足量的FeCl3溶液中,待样品全部溶解后,加入适量稀硫酸,用0.2000mol·L-1的KMnO4标准溶液滴定到终点,消耗KMnO4溶液15.00mL,反应中MnO4-被还原为Mn2+,则产品中氯化亚铜的质量分数为
您最近一年使用:0次



