1 . 目前很多工厂实现了烟气的脱硫脱硝和氨氮废水的无害化处理,回答下列问题:
(1)某小组同学在实验室里尝试模拟工厂处理氨氮废水(主要含NH )的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH
)的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH 转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO
转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO )的浓度也随之变大,写出该反应的离子方程式:
)的浓度也随之变大,写出该反应的离子方程式:___ 。
②乙同学在实验室模拟工业上的“吹脱法”测定废水的含氮量,设计了以下实验:精确称取wg废水样品,注入如所图示的仪器中,然后逐滴加入足量10%NaOH溶液,通入水蒸气。将样品液中的氨全部蒸出,用V1mLc1mol·L-1盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2mol•L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
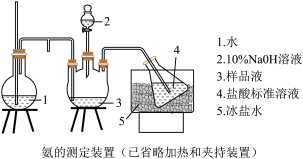
NH4Cl的电子式为___ 。盛放样品液的仪器是___ (填名称);圆底烧瓶中长玻璃导管的作用是___ ;冰盐水的作用是___ 。
(2)某工厂利用NaClO2/(NH4)2CO3溶液脱除烟气中的SO2和NO。①保持溶液中NaClO2的浓度不变,研究(NH4)2CO3的浓度对NO和SO2脱除效率的影响[已知:(NH4)2CO3溶液显碱性;NaClO2的氧化性随pH增加而下降,酸性条件下会生成ClO2]。实验结果如图所示,随着(NH4)2CO3溶液浓度的增大造成NO脱除效率下降的主要原因是___ 。
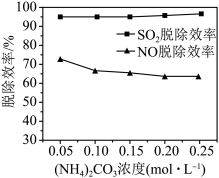
②NO脱除效率总是小于SO2脱除效率的主要原因是___ 。(写出一点)
(3)某工厂采用微生物硝化法处理氨氮废水,过程如图:
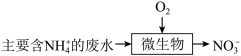
下列有关说法正确的是___ (填标号)。
①微生物硝化法处理废水后会导致水体的pH升高
②若微生物保持活性的pH范围为7~9,则适宜用来调节水体pH的是CO2
③不能采用电解法在阴极将NH 直接转化为NO
直接转化为NO
(1)某小组同学在实验室里尝试模拟工厂处理氨氮废水(主要含NH
 )的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH
)的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH 转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO
转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO )的浓度也随之变大,写出该反应的离子方程式:
)的浓度也随之变大,写出该反应的离子方程式:②乙同学在实验室模拟工业上的“吹脱法”测定废水的含氮量,设计了以下实验:精确称取wg废水样品,注入如所图示的仪器中,然后逐滴加入足量10%NaOH溶液,通入水蒸气。将样品液中的氨全部蒸出,用V1mLc1mol·L-1盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2mol•L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。

NH4Cl的电子式为
(2)某工厂利用NaClO2/(NH4)2CO3溶液脱除烟气中的SO2和NO。①保持溶液中NaClO2的浓度不变,研究(NH4)2CO3的浓度对NO和SO2脱除效率的影响[已知:(NH4)2CO3溶液显碱性;NaClO2的氧化性随pH增加而下降,酸性条件下会生成ClO2]。实验结果如图所示,随着(NH4)2CO3溶液浓度的增大造成NO脱除效率下降的主要原因是

②NO脱除效率总是小于SO2脱除效率的主要原因是
(3)某工厂采用微生物硝化法处理氨氮废水,过程如图:

下列有关说法正确的是
①微生物硝化法处理废水后会导致水体的pH升高
②若微生物保持活性的pH范围为7~9,则适宜用来调节水体pH的是CO2
③不能采用电解法在阴极将NH
 直接转化为NO
直接转化为NO
您最近一年使用:0次
名校
2 . 室温下,下列实验方案能达到探究目的的是
| 选项 | 探究目的 | 探究方案 |
| A | 证明丁烯醛中含碳碳双键 | 向丁烯醛 中加入 中加入酸性高锰酸钾溶液,观察溶液颜色变化 |
| B | 比较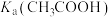 和 和 的大小 的大小 | 向 溶液中滴加 溶液中滴加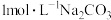 溶液,观察是否产生气泡 溶液,观察是否产生气泡 |
| C | 比较 与 与 氧化性强弱 氧化性强弱 | 向 溶液中滴入硫酸酸化的 溶液中滴入硫酸酸化的 溶液,观察溶液颜色变化 |
| D | 探究浓度对 溶液水解程度的影响 溶液水解程度的影响 | 向 的 的 溶液中滴加酚酞溶液 溶液中滴加酚酞溶液观察现象,再加入少量  固体,观察颜色变化 固体,观察颜色变化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 下列方案设计、现象和结论都正确的是
| 实验 | 目的 | 方案设计 | 现象和结论 |
| ① | 探究压强对 与 与 平衡的影响 平衡的影响 | 快速压缩装有 、 、 平衡混合气体的针筒 平衡混合气体的针筒 | 如果气体颜色变深,则增大压强,平衡向生成 的方向移动 的方向移动 |
| ② | 探究 与 与 氧化性的强弱 氧化性的强弱 | 向 和 和 的混合溶液中滴入 的混合溶液中滴入 酸化的 酸化的 溶液 溶液 | 溶液变红,说明氧化性: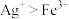 |
| ③ | 验证 溶液中存在水解平衡 溶液中存在水解平衡 | 取2  溶液于试管中,加2滴酚酞,再加入少量 溶液于试管中,加2滴酚酞,再加入少量 固体 固体 | 如果溶液红色变浅,则 溶液中存在水解平衡 溶液中存在水解平衡 |
| ④ | 相同温度下,比较 与 与 的酸性强弱 的酸性强弱 | 向等体积的水中分别通入 、 、 至饱和,再用 至饱和,再用 计测定两种溶液的 计测定两种溶液的 | 如果通 后所得溶液的 后所得溶液的 小,则 小,则 的酸性比弱 的酸性比弱 |
| A.① | B.② | C.③ | D.④ |
您最近一年使用:0次
名校
4 . FeCl3(易升华)是常见的化学试剂。某学习小组开展了与FeCl3相关的系列实验。回答下列问题:
Ⅰ.铁粉制备FeCl3(实验装置如图所示)

(1)仪器a的名称为_______ ;装置中F的作用:_______ 。
(2)硬质玻璃管直接接入收集器的优点是_______ 。
Ⅱ.探究FeCl3溶液与Cu的反应
(3)配制FeCl3溶液时加入少量盐酸的原因是_______ 。
(4)向FeCl3溶液中滴加几滴KSCN溶液,溶液颜色变红,再加入过量Cu粉,发现溶液的红色褪去。用离子方程式解释红色褪去的原因:_______ 。
(5)已知(4)中除了红色褪去,还产生了白色沉淀。小组成员查阅得知CuCl和CuSCN均为白色沉淀。为探究白色沉淀的主要成分,小组成员完成了以下实验:向4 mL 0.1mol/L FeCl3溶液中加入过量Cu粉,静置,取上层清液于试管中,滴加3滴KSCN溶液,有白色沉淀生成。由此现象可知此白色沉淀为_______ (填化学式)。
小组成员进一步查阅资料发现,Cu2+与SCN-可发生如下两种反应。
反应i:Cu2++ 4SCN- =[ Cu(SCN)4]2 -(淡黄色)
反应ii:2Cu2+ + 4SCN-= 2CuSCN↓+ (SCN)2
设计实验如下:
由此现象可知,反应速率较快的为_______ (填“反应i”或“反应ii”)。 小组成员得出结论,反应ii不是CuSCN产生的主要原因。
(6)根据上述分析可知,Cu2+、Fe2+和SCN-可直接发生反应,生成CuSCN和Fe3+,写出反应的离子方程式:_______ 。
Ⅰ.铁粉制备FeCl3(实验装置如图所示)

(1)仪器a的名称为
(2)硬质玻璃管直接接入收集器的优点是
Ⅱ.探究FeCl3溶液与Cu的反应
(3)配制FeCl3溶液时加入少量盐酸的原因是
(4)向FeCl3溶液中滴加几滴KSCN溶液,溶液颜色变红,再加入过量Cu粉,发现溶液的红色褪去。用离子方程式解释红色褪去的原因:
(5)已知(4)中除了红色褪去,还产生了白色沉淀。小组成员查阅得知CuCl和CuSCN均为白色沉淀。为探究白色沉淀的主要成分,小组成员完成了以下实验:向4 mL 0.1mol/L FeCl3溶液中加入过量Cu粉,静置,取上层清液于试管中,滴加3滴KSCN溶液,有白色沉淀生成。由此现象可知此白色沉淀为
小组成员进一步查阅资料发现,Cu2+与SCN-可发生如下两种反应。
反应i:Cu2++ 4SCN- =[ Cu(SCN)4]2 -(淡黄色)
反应ii:2Cu2+ + 4SCN-= 2CuSCN↓+ (SCN)2
设计实验如下:
| 操作 | 现象 |
| 在盛有2 mL 0.1mol·L-1 CuSO4溶液的试管中滴加KSCN溶液 | 溶液很快由蓝色变为绿色,未观察到白色沉淀; 2h后溶液为绿色,未观察到白色沉淀;24h后,溶液绿色变浅,试管底部有白色沉淀 |
(6)根据上述分析可知,Cu2+、Fe2+和SCN-可直接发生反应,生成CuSCN和Fe3+,写出反应的离子方程式:
您最近一年使用:0次
10-11高三上·湖南长沙·阶段练习
5 . 下列对有关化学反应过程或实验现象的解释中,正确的是
| A.Cl2的水溶液可以导电,说明Cl2是电解质 |
| B.在少量Fe(NO3)2试样的水溶液中,滴加稀H2SO4酸化,再滴加KSCN溶液变成血红色,说明Fe(NO3)2试样已经变质 |
| C.向淀粉碘化钾的溶液中加入氯水,溶液变为蓝色,说明Cl2的氧化性强于I2 |
| D.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后,溶液褪色,说明BaCl2溶液有酸性 |
您最近一年使用:0次
解题方法
6 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,是工业上重要的还原性漂白剂,也是重要的食品抗氧化剂。某学习小组模拟工业流程设计实验制取保险粉。
已知:Na2S2O4是白色固体,还原性比Na2SO3强,易与酸反应(2S2O42-+4H+=3SO2↑+S↓+2H2O)。
(一)锌粉法
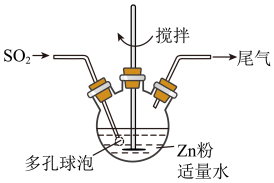
步骤1:按如图方式,温度控制在40~45℃,当三颈瓶中溶液pH在3~3.5时,停止通入SO2,反应后得到ZnS2O4溶液。
步骤2:将得到的ZnS2O4溶液加入NaOH溶液中,过滤,滤渣为Zn(OH)2,向滤液中加入一定量食盐,立即析出Na2S2O4•2H2O晶体。
步骤3:,经过滤,用乙醇洗涤,用120~140℃的热风干燥得到Na2S2O4。
(二)甲酸钠法
步骤4:按上图方式,将装置中的Zn粉和水换成HCOONa、Na2CO3溶液和乙醇。温度控制在70~83℃,持续通入SO2,维持溶液pH在4~6,经5~8小时充分反应后迅速降温45~55℃,立即析出无水Na2S2O4。
步骤5:经过滤,用乙醇洗涤,干燥得到Na2S2O4。
回答下列问题:
(1)步骤1容器中发生反应的化学方程式是______ ;容器中多孔球泡的作用是______ 。
(2)步骤2中“向滤液中加入一定量食盐,立即析出Na2S2O4•2H2O晶体”的原理是(用必要的化学用语和文字说明)______ 。
(3)两种方法中控制温度的加热方式是______ 。
(4)根据上述实验过程判断,Na2S2O4在水、乙醇中的溶解性为:______ 。
(5)甲酸钠法中生成Na2S2O4的总反应为______ 。
(6)两种方法相比较,锌粉法产品纯度高,可能的原因是______ 。
(7)限用以下给出的试剂,设计实验证明甲酸钠法制得的产品中含有Na2SO4。
稀盐酸、稀硫酸、稀硝酸、AgNO3溶液、BaCl2溶液______ 。
已知:Na2S2O4是白色固体,还原性比Na2SO3强,易与酸反应(2S2O42-+4H+=3SO2↑+S↓+2H2O)。
(一)锌粉法
步骤1:按如图方式,温度控制在40~45℃,当三颈瓶中溶液pH在3~3.5时,停止通入SO2,反应后得到ZnS2O4溶液。

步骤2:将得到的ZnS2O4溶液加入NaOH溶液中,过滤,滤渣为Zn(OH)2,向滤液中加入一定量食盐,立即析出Na2S2O4•2H2O晶体。
步骤3:,经过滤,用乙醇洗涤,用120~140℃的热风干燥得到Na2S2O4。
(二)甲酸钠法
步骤4:按上图方式,将装置中的Zn粉和水换成HCOONa、Na2CO3溶液和乙醇。温度控制在70~83℃,持续通入SO2,维持溶液pH在4~6,经5~8小时充分反应后迅速降温45~55℃,立即析出无水Na2S2O4。
步骤5:经过滤,用乙醇洗涤,干燥得到Na2S2O4。
回答下列问题:
(1)步骤1容器中发生反应的化学方程式是
(2)步骤2中“向滤液中加入一定量食盐,立即析出Na2S2O4•2H2O晶体”的原理是(用必要的化学用语和文字说明)
(3)两种方法中控制温度的加热方式是
(4)根据上述实验过程判断,Na2S2O4在水、乙醇中的溶解性为:
(5)甲酸钠法中生成Na2S2O4的总反应为
(6)两种方法相比较,锌粉法产品纯度高,可能的原因是
(7)限用以下给出的试剂,设计实验证明甲酸钠法制得的产品中含有Na2SO4。
稀盐酸、稀硫酸、稀硝酸、AgNO3溶液、BaCl2溶液
您最近一年使用:0次
7 . 下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 往 溶液中滴加几滴浓硫酸,溶液由橙色变为黄色 溶液中滴加几滴浓硫酸,溶液由橙色变为黄色 |  呈橙色, 呈橙色, 呈黄色 呈黄色 |
| B | 将浓硫酸加入蔗糖中形成多孔炭 | 浓硫酸具有强氧化性和脱水性 |
| C | 低温石英(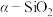 )制作石英手表 )制作石英手表 |  属于共价晶体,熔点高 属于共价晶体,熔点高 |
| D | 用钨钢钻头给混凝土墙面钻孔 | 合金硬度比其组成的纯金属低 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
8 . 根据下列实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由 水解引起的 水解引起的 |
| B | 室温下,用pH试纸测定浓度均为0.1mol/L的NaClO溶液、CH3COONa溶液pH | NaClO溶液的pH较大 | 酸性:HClO<CH3COOH |
| C | 向1mL 0.1mol/LNaOH溶液中滴入2滴0.1mol/L MgCl2溶液,再滴入2滴0.1mol/L CuSO4溶液 | 沉淀颜色变化:白色—蓝色 | Ksp:Cu(OH)2<Mg(OH)2 |
| D | 分别向两支试管中加入同浓度、同体积的草酸溶液,再分别加入同体积、不同浓度的酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色时间不同 | 浓度不同反应速率不同 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-16更新
|
359次组卷
|
2卷引用:福建省厦门第一中学2022-2023学年高三上学期12月月考化学试题
2023高三·全国·专题练习
解题方法
9 .  时,在
时,在 溶液中滴入
溶液中滴入 溶液,含磷元素的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与
溶液,含磷元素的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是

 时,在
时,在 溶液中滴入
溶液中滴入 溶液,含磷元素的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与
溶液,含磷元素的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
A. 的数量级为 的数量级为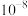 |
B. 时,溶液中主要含磷元素的离子浓度大小关系为 时,溶液中主要含磷元素的离子浓度大小关系为 |
C. 的数量级为 的数量级为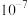 |
D. 溶液显碱性,若向溶液中加入足量的 溶液显碱性,若向溶液中加入足量的 溶液,溶液则显酸性 溶液,溶液则显酸性 |
您最近一年使用:0次
10 . 关于非金属含氧酸及其盐的性质,下列说法正确的是
A.浓 具有强氧化性,稀 具有强氧化性,稀 不具有氧化性 不具有氧化性 |
B.加热 固体与浓 固体与浓 的混合物可制备 的混合物可制备 ,说明 ,说明 的酸性比 的酸性比 的强 的强 |
C. 的氧化性随溶液 的氧化性随溶液 的减小而增强 的减小而增强 |
D.浓 和浓 和浓 敞口置于空气中浓度均减小,其原因相同 敞口置于空气中浓度均减小,其原因相同 |
您最近一年使用:0次
2021-09-04更新
|
371次组卷
|
4卷引用:河南省2022届高三入学考试化学试题



