名校
解题方法
1 . 高锰酸钾生产过程中产生的废锰矿(主要成分为 和
和 )可用于制备
)可用于制备 固体,工艺流程如下:
固体,工艺流程如下:

该工艺条件下金属离子开始沉淀和完全沉淀的pH如下表所示:
回答以下问题:
(1)加入的 与
与 反应为
反应为 和
和 ,“调pH”步骤中,应调节pH范围为
,“调pH”步骤中,应调节pH范围为___________ ,滤渣3的主要成分为:___________
(2)取4.00 g 固体样品溶于适量水中,加硫酸酸化,用过量
固体样品溶于适量水中,加硫酸酸化,用过量 (难溶于水)将其完全氧化为
(难溶于水)将其完全氧化为 ,过滤,洗涤。洗涤滤液并入滤液后,用
,过滤,洗涤。洗涤滤液并入滤液后,用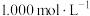
 溶液滴定至终点,消耗溶液50.00 mL。发生的反应为:
溶液滴定至终点,消耗溶液50.00 mL。发生的反应为: ,计算样品中
,计算样品中 的质量分数
的质量分数___________ (写出计算过程)。
 和
和 )可用于制备
)可用于制备 固体,工艺流程如下:
固体,工艺流程如下:
该工艺条件下金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |
| 开始沉淀pH | 2.10 | 9.27 |
| 完全沉淀pH | 3.20 | 10.87 |
(1)加入的
 与
与 反应为
反应为 和
和 ,“调pH”步骤中,应调节pH范围为
,“调pH”步骤中,应调节pH范围为(2)取4.00 g
 固体样品溶于适量水中,加硫酸酸化,用过量
固体样品溶于适量水中,加硫酸酸化,用过量 (难溶于水)将其完全氧化为
(难溶于水)将其完全氧化为 ,过滤,洗涤。洗涤滤液并入滤液后,用
,过滤,洗涤。洗涤滤液并入滤液后,用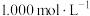
 溶液滴定至终点,消耗溶液50.00 mL。发生的反应为:
溶液滴定至终点,消耗溶液50.00 mL。发生的反应为: ,计算样品中
,计算样品中 的质量分数
的质量分数
您最近一年使用:0次
解题方法
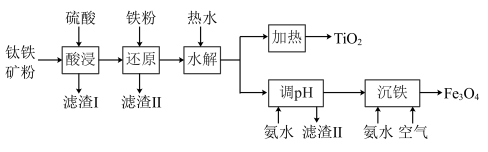
2 . 钛被誉为“现代金属”和“战略金属”。工业上以钛铁矿[主要成分为偏针钛酸亚铁( ),含Fe、Si、Al的氧化物等杂质]制备
),含Fe、Si、Al的氧化物等杂质]制备 和
和 ,工艺流程如图。
,工艺流程如图。
已知:25℃时,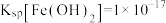 ,
,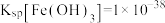 ,
,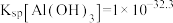 ;当溶液中离子浓度小于
;当溶液中离子浓度小于 时,认为沉淀完全;“水解”时反应为
时,认为沉淀完全;“水解”时反应为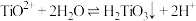 。
。
回答下列问题:
(1)制备 。
。
①“酸浸”时Ti元素转化为 ,
, 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
②“酸浸”过程中,在不同温度下Ti元素的浸出率变化情况如图所示。温度超过80℃时,浸出率下降的原因是_______ 。
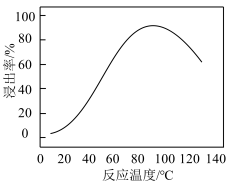
(2)制备 。
。
①“调pH”时,pH的理论最小值是_______ 。
②“沉铁”时发生反应的化学方程式为_______ 。
(3) 纯度测定。
纯度测定。
取 样品0.2000g,用酸溶解后再用还原剂将
样品0.2000g,用酸溶解后再用还原剂将 还原为
还原为 ,并配成25.0mL溶液。用0.1000
,并配成25.0mL溶液。用0.1000
 标准溶液将
标准溶液将 恰好完全氧化为
恰好完全氧化为 ,消耗0.1000
,消耗0.1000
 标准溶液23.00mL。该样品中
标准溶液23.00mL。该样品中 的质量分数为
的质量分数为_______ (写出计算过程)。
 ),含Fe、Si、Al的氧化物等杂质]制备
),含Fe、Si、Al的氧化物等杂质]制备 和
和 ,工艺流程如图。
,工艺流程如图。
已知:25℃时,
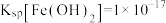 ,
,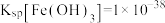 ,
,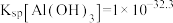 ;当溶液中离子浓度小于
;当溶液中离子浓度小于 时,认为沉淀完全;“水解”时反应为
时,认为沉淀完全;“水解”时反应为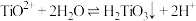 。
。回答下列问题:
(1)制备
 。
。①“酸浸”时Ti元素转化为
 ,
, 发生反应的离子方程式为
发生反应的离子方程式为②“酸浸”过程中,在不同温度下Ti元素的浸出率变化情况如图所示。温度超过80℃时,浸出率下降的原因是

(2)制备
 。
。①“调pH”时,pH的理论最小值是
②“沉铁”时发生反应的化学方程式为
(3)
 纯度测定。
纯度测定。取
 样品0.2000g,用酸溶解后再用还原剂将
样品0.2000g,用酸溶解后再用还原剂将 还原为
还原为 ,并配成25.0mL溶液。用0.1000
,并配成25.0mL溶液。用0.1000
 标准溶液将
标准溶液将 恰好完全氧化为
恰好完全氧化为 ,消耗0.1000
,消耗0.1000
 标准溶液23.00mL。该样品中
标准溶液23.00mL。该样品中 的质量分数为
的质量分数为
您最近一年使用:0次
名校
3 . 乙酸乙酯是良好的有机溶剂和食用香料,可用冰乙酸和乙醇作原料、 作为催化剂制备,过程如下:
作为催化剂制备,过程如下:
Ⅰ.制备 。一种利用废旧镀锌铁皮制备
。一种利用废旧镀锌铁皮制备 的流程如下图:
的流程如下图:

(1)“碱洗”时加入 溶液除
溶液除 ,写出生成
,写出生成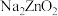 的离子方程式
的离子方程式___________ 。
(2)“氧化”时加入的 需稍过量,除了使
需稍过量,除了使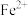 充分反应外,还可能的原因是
充分反应外,还可能的原因是___________ 。
(3) 含量的测定。制备乙酸乙酯所用
含量的测定。制备乙酸乙酯所用 要求纯度在99.5%(质量分数)以上。称取
要求纯度在99.5%(质量分数)以上。称取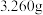 样品,加入稀盐酸充分溶解后配成
样品,加入稀盐酸充分溶解后配成 溶液,从中取
溶液,从中取 溶液,加入
溶液,加入 (Na2H2Y)标准溶液,用氨水调节pH后,加热使之充分反应。冷却,加入指示剂,用
(Na2H2Y)标准溶液,用氨水调节pH后,加热使之充分反应。冷却,加入指示剂,用 标准溶液滴定过量的EDTA,消耗
标准溶液滴定过量的EDTA,消耗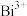 标准溶液
标准溶液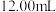 。计算判断该样品纯度是否符合要求
。计算判断该样品纯度是否符合要求___________ (写出计算过程)。已知: 。
。
Ⅱ.制备乙酸乙酯。向三口瓶中加入一定量无水乙醇和 ,在恒压滴液漏斗中加入无水乙醇和冰乙酸。滴加混合液体,80~90℃条件下反应45分钟,改用蒸馏装置蒸馏至不再有馏出液为止。粗品经碱洗、水洗、干燥后得产品。
,在恒压滴液漏斗中加入无水乙醇和冰乙酸。滴加混合液体,80~90℃条件下反应45分钟,改用蒸馏装置蒸馏至不再有馏出液为止。粗品经碱洗、水洗、干燥后得产品。
(4)补充完整蒸馏操作:安装蒸馏装置,加入待蒸馏的物质和沸石,___________ ,收集馏分。
(5)用 替代浓硫酸作该反应催化剂的优点是
替代浓硫酸作该反应催化剂的优点是___________ 。
 作为催化剂制备,过程如下:
作为催化剂制备,过程如下:Ⅰ.制备
 。一种利用废旧镀锌铁皮制备
。一种利用废旧镀锌铁皮制备 的流程如下图:
的流程如下图:
(1)“碱洗”时加入
 溶液除
溶液除 ,写出生成
,写出生成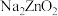 的离子方程式
的离子方程式(2)“氧化”时加入的
 需稍过量,除了使
需稍过量,除了使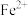 充分反应外,还可能的原因是
充分反应外,还可能的原因是(3)
 含量的测定。制备乙酸乙酯所用
含量的测定。制备乙酸乙酯所用 要求纯度在99.5%(质量分数)以上。称取
要求纯度在99.5%(质量分数)以上。称取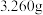 样品,加入稀盐酸充分溶解后配成
样品,加入稀盐酸充分溶解后配成 溶液,从中取
溶液,从中取 溶液,加入
溶液,加入 (Na2H2Y)标准溶液,用氨水调节pH后,加热使之充分反应。冷却,加入指示剂,用
(Na2H2Y)标准溶液,用氨水调节pH后,加热使之充分反应。冷却,加入指示剂,用 标准溶液滴定过量的EDTA,消耗
标准溶液滴定过量的EDTA,消耗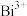 标准溶液
标准溶液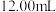 。计算判断该样品纯度是否符合要求
。计算判断该样品纯度是否符合要求 。
。Ⅱ.制备乙酸乙酯。向三口瓶中加入一定量无水乙醇和
 ,在恒压滴液漏斗中加入无水乙醇和冰乙酸。滴加混合液体,80~90℃条件下反应45分钟,改用蒸馏装置蒸馏至不再有馏出液为止。粗品经碱洗、水洗、干燥后得产品。
,在恒压滴液漏斗中加入无水乙醇和冰乙酸。滴加混合液体,80~90℃条件下反应45分钟,改用蒸馏装置蒸馏至不再有馏出液为止。粗品经碱洗、水洗、干燥后得产品。(4)补充完整蒸馏操作:安装蒸馏装置,加入待蒸馏的物质和沸石,
(5)用
 替代浓硫酸作该反应催化剂的优点是
替代浓硫酸作该反应催化剂的优点是
您最近一年使用:0次
4 . 一定条件下将锰冶炼烟尘灰(主要成分 )、黄铁矿(主要成分
)、黄铁矿(主要成分 )与足量硫酸溶液混合,通过反应
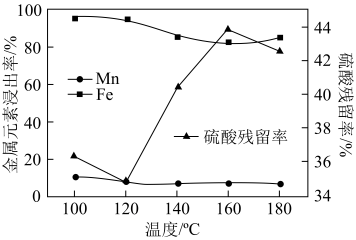
)与足量硫酸溶液混合,通过反应 可将锰和铁浸出。其它条件相同,温度对Mn、Fe浸出率及硫酸残留率(反应后溶液中剩余硫酸与加入硫酸的比例)影响如图所示。
可将锰和铁浸出。其它条件相同,温度对Mn、Fe浸出率及硫酸残留率(反应后溶液中剩余硫酸与加入硫酸的比例)影响如图所示。
(1) 基态核外电子排布式为
基态核外电子排布式为___________ 。
(2)温度高于120℃时, 的残留率增大的原因之一是
的残留率增大的原因之一是 与
与 反应,该反应的离子方程式为
反应,该反应的离子方程式为___________ 。
(3)温度高于120℃时,残留固体中 的含量减少,但铁元素浸出率却下降的原因是
的含量减少,但铁元素浸出率却下降的原因是___________ 。
(4)向浸出液先加入 ,后加入
,后加入 调节pH,可得到纯化
调节pH,可得到纯化 溶液。
溶液。
已知:室温下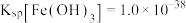 ,
, ,
, 。假设加入
。假设加入 后溶液中
后溶液中 ,若溶液中某离子浓度小于
,若溶液中某离子浓度小于 ,则认为该离子完全沉淀。
,则认为该离子完全沉淀。
①先加入 再调节pH的原因是
再调节pH的原因是___________ 。
②浓氨水调节溶液的pH范围为___________ 。
(5) 溶液经电解可得到
溶液经电解可得到 。生成
。生成 的电极反应式为
的电极反应式为___________ 。
 )、黄铁矿(主要成分
)、黄铁矿(主要成分 )与足量硫酸溶液混合,通过反应
)与足量硫酸溶液混合,通过反应 可将锰和铁浸出。其它条件相同,温度对Mn、Fe浸出率及硫酸残留率(反应后溶液中剩余硫酸与加入硫酸的比例)影响如图所示。
可将锰和铁浸出。其它条件相同,温度对Mn、Fe浸出率及硫酸残留率(反应后溶液中剩余硫酸与加入硫酸的比例)影响如图所示。
(1)
 基态核外电子排布式为
基态核外电子排布式为(2)温度高于120℃时,
 的残留率增大的原因之一是
的残留率增大的原因之一是 与
与 反应,该反应的离子方程式为
反应,该反应的离子方程式为(3)温度高于120℃时,残留固体中
 的含量减少,但铁元素浸出率却下降的原因是
的含量减少,但铁元素浸出率却下降的原因是(4)向浸出液先加入
 ,后加入
,后加入 调节pH,可得到纯化
调节pH,可得到纯化 溶液。
溶液。已知:室温下
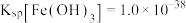 ,
, ,
, 。假设加入
。假设加入 后溶液中
后溶液中 ,若溶液中某离子浓度小于
,若溶液中某离子浓度小于 ,则认为该离子完全沉淀。
,则认为该离子完全沉淀。①先加入
 再调节pH的原因是
再调节pH的原因是②浓氨水调节溶液的pH范围为
(5)
 溶液经电解可得到
溶液经电解可得到 。生成
。生成 的电极反应式为
的电极反应式为
您最近一年使用:0次
名校
5 . 硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。
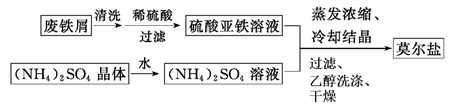
(1)制备莫尔盐的流程如下:
①用热的Na2CO3溶液清洗废铁屑的目的是__________ 。
②其中最后一步用少量无水乙醇洗涤晶体目的是________ 。
(2)现取0.4gCu2S和CuS的混合物在酸性溶液中用40mL0.150mol·L-1KMnO4溶液处理,发生反应如下:8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O,
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O,
反应后煮沸溶液,赶尽SO2,剩余的KMnO4用0.2mol·L-1(NH4)2Fe(SO4)2溶液来滴定,完全反应消耗(NH4)2Fe(SO4)2溶液VmL。已知:MnO4-+Fe2++H+→Mn2++Fe3++H2O(未配平)
①滴定终点的现象为________ 。
②若V=35,试计算混合物中CuS的质量分数________ (写出计算过程)。
(1)制备莫尔盐的流程如下:
①用热的Na2CO3溶液清洗废铁屑的目的是
②其中最后一步用少量无水乙醇洗涤晶体目的是
(2)现取0.4gCu2S和CuS的混合物在酸性溶液中用40mL0.150mol·L-1KMnO4溶液处理,发生反应如下:8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O,
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O,
反应后煮沸溶液,赶尽SO2,剩余的KMnO4用0.2mol·L-1(NH4)2Fe(SO4)2溶液来滴定,完全反应消耗(NH4)2Fe(SO4)2溶液VmL。已知:MnO4-+Fe2++H+→Mn2++Fe3++H2O(未配平)
①滴定终点的现象为
②若V=35,试计算混合物中CuS的质量分数
您最近一年使用:0次



