21-22高三下·福建宁德·阶段练习
1 . 某实验小组通过以下实验,探究镀件表面镀铜的最佳条件。
【查阅资料】①Cu2++2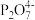
 [Cu(P2O7)2]6-K=1×109
[Cu(P2O7)2]6-K=1×109
②Cu+在溶液中不稳定,容易发生歧化。
【实验设计】用CuSO4·5H2O、Na4P2O7·10H2O(焦磷酸钠)、添加剂配制一定浓度的电镀液,分别用纯铜和镀件作为两极材料,探究电镀液的pH、电流密度、电极板间距对层的影响。
(1)要配制一定体积40g/L的CuSO4溶液,以下仪器不需要用到的是_______ (填仪器名称)。
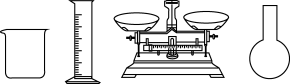
(2)镀件表面的油污可用_______ 清洗。
(3)电镀时阴极上发生的主要反应的电极反应式为_______ 。
【实验结果与数据分析】
ⅰ.其他条件不变时,电位10min,pH对电镀的影响如下表:
(4)实验3中,铜镀层的沉积速率v(Cu)=_______ mol/min(保留两位有效数字)。
(5)实验1和实验4中,酸性或碱性较强时,镀层出现斑驳的可能原因是_______ 。
ⅱ.电流密度、电极板间距与镀膜质量的关系

(6)电流密度小于0.50A/dm2时镀膜质量随电流密度增大而增大的原因是_______ 。
(7)本实验电镀的最佳条件是pH为8.5、_______ 、_______ 。
(8)使用最佳条件电镀时,在阳极附近的电镀液中出现红色固体沉积物,其可能原因用离子方程式表示为_______ ,通空气搅拌可防止红色固体沉积物形成。
【查阅资料】①Cu2++2
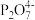
 [Cu(P2O7)2]6-K=1×109
[Cu(P2O7)2]6-K=1×109②Cu+在溶液中不稳定,容易发生歧化。
【实验设计】用CuSO4·5H2O、Na4P2O7·10H2O(焦磷酸钠)、添加剂配制一定浓度的电镀液,分别用纯铜和镀件作为两极材料,探究电镀液的pH、电流密度、电极板间距对层的影响。
(1)要配制一定体积40g/L的CuSO4溶液,以下仪器不需要用到的是

(2)镀件表面的油污可用
(3)电镀时阴极上发生的主要反应的电极反应式为
【实验结果与数据分析】
ⅰ.其他条件不变时,电位10min,pH对电镀的影响如下表:
| 实验信号 | pH值 | 镀膜质量/g | 镀层外观 |
| 1 | 3 | 0.0136 | 表面斑驳 |
| 2 | 7 | 0.0258 | 光亮,不光滑 |
| 3 | 8.5 | 0.0356 | 光亮,光滑 |
| 4 | 10 | 0.0216 | 表面部分斑驳 |
(5)实验1和实验4中,酸性或碱性较强时,镀层出现斑驳的可能原因是
ⅱ.电流密度、电极板间距与镀膜质量的关系

(6)电流密度小于0.50A/dm2时镀膜质量随电流密度增大而增大的原因是
(7)本实验电镀的最佳条件是pH为8.5、
(8)使用最佳条件电镀时,在阳极附近的电镀液中出现红色固体沉积物,其可能原因用离子方程式表示为
您最近一年使用:0次
2022·河南·三模
2 . 电镀废液中含有Cu2+、Mg2+、Ca2+、Ni2+和Fe3+,某专利申请用下列方法从该类废液中制备高纯度的铜粉。

已知导体和其接触的溶液的界面上会形成一定的电位差,被称作电极电位。如反应Cu2+(氧化态)+2e-=Cu(还原态)的标准电极电位表示为Cu2+/Cu=0.34,该值越大氧化态的氧化性越强,越小还原态的还原性越强。两个电对间的电极电位差别越大,二者之间的氧化还原反应越易发生。某些电对的电极电位如下表所示:
回答下列问题:
(1)蒸发浓缩后的溶液中,Cu2+的物质的量浓度≥_______ (结果保留两位小数)。分离固液混合物时,需要用真空抽滤的方法提高过滤的速度和效果,其原因是_______ 。
(2)溶液的氧化还原电位越高,其氧化能力同样越强。溶液的氧化还原电位,与溶液中离子等微粒的种类及其浓度相关,实验测得Cu2+与SO2反应体系的氧化还原电位与铜粉的回收率和纯度的关系如下表所示:
①由此可知,制备过程中进行电位检测时,要把溶液的氧化还原电位控制在_______ mV左右。
②专利申请书指出,反应液的反应历程为Cu2+首先被还原为Cu+,Cu+再歧化为Cu和Cu2+。反应历程不是Cu2+直接被还原为Cu的原因是_______ 。反应生成Cu+的离子方程式是_______ 。
(3)废液2中含有的金属离子除Mg2+、Ca2+外还有_______ 。为了使这些离子均除去,使水得到进一步的净化,应该在调节溶液pH使其他杂质离子沉淀后,再使Ca2+转化为_______ (填化学式)而除去。

已知导体和其接触的溶液的界面上会形成一定的电位差,被称作电极电位。如反应Cu2+(氧化态)+2e-=Cu(还原态)的标准电极电位表示为Cu2+/Cu=0.34,该值越大氧化态的氧化性越强,越小还原态的还原性越强。两个电对间的电极电位差别越大,二者之间的氧化还原反应越易发生。某些电对的电极电位如下表所示:
| Fe3+/Fe2+ | Cu2+/Cu+ | Cu2+/Cu |  /SO2 /SO2 | Fe2+/Fe | Ni2+/Ni | Mg2+/Mg | Ca2+/Ca |
| 0.77 | 0.52 | 0.34 | 0.17 | -0.44 | -0.23 | -2.38 | -2.76 |
(1)蒸发浓缩后的溶液中,Cu2+的物质的量浓度≥
(2)溶液的氧化还原电位越高,其氧化能力同样越强。溶液的氧化还原电位,与溶液中离子等微粒的种类及其浓度相关,实验测得Cu2+与SO2反应体系的氧化还原电位与铜粉的回收率和纯度的关系如下表所示:
| 反应液的电位(mV) | 360 | 340 | 320 | 300 | 280 | 260 |
| 铜粉的回收率(%) | 86.5 | 90.2 | 95.6 | 97.2 | 97.3 | 97.4 |
| 产品的纯度(%) | 99.9 | 99.9 | 99.9 | 99.9 | 99.9 | 99.9 |
②专利申请书指出,反应液的反应历程为Cu2+首先被还原为Cu+,Cu+再歧化为Cu和Cu2+。反应历程不是Cu2+直接被还原为Cu的原因是
(3)废液2中含有的金属离子除Mg2+、Ca2+外还有
您最近一年使用:0次
2020高二·浙江·学业考试
名校
解题方法
3 . 过碳酸钠(2Na2CO3•3H2O2)能杀灭新冠病毒,是一种良好的消毒剂,也可作为漂白剂、去污剂。下列说法不正确 的是
| A.过碳酸钠具有强氧化性 |
| B.过碳酸钠的水溶液呈碱性,能促进油污水解 |
| C.二氧化锰、铁离子或高温会减弱过碳酸钠的漂白效果 |
| D.过碳酸钠溶液与过量的亚硫酸钠溶液反应的化学方程式:2Na2CO3•3H2O2+Na2SO3=2Na2CO3+Na2SO4+O2↑+3H2O |
您最近一年使用:0次
2020-07-24更新
|
674次组卷
|
10卷引用:考点13 钠及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)
(已下线)考点13 钠及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)四川省遂宁市射洪中学校2021-2022学年高二下学期期中考试化学试题浙江省嘉兴市海盐第二高级中学2021-2022学年高二下学期3月阶段检测化学试题(已下线)考点13 钠及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题七 氧化还原反应浙江省2020年7月普通高中学业水平考试化学试题浙江省上海外国语大学附属宏达高级中学2020-2021学年高二10月月考化学试题(已下线)【浙江新东方】双师304高一下浙江省台州市路桥区东方理想学校2020-2021学年高一下学期5月月考化学试题陕西省西安市蓝田县乡镇高中联考2023-2024学年高二上学期11月期中化学试题
2022·重庆·模拟预测
名校
解题方法
4 . 碱式氯化铜[CuaClb(OH)c·xH2O]是一种重要的无机杀虫剂,它的制备流程如下,下列有关说法正确的是


| A.FeCl3的作用是增强盐酸的氧化性 |
| B.加入少量CuO目的是为了除去Fe3+ |
| C.石灰乳可用纯碱代替 |
| D.若制备1mol的CuCl2,理论上消耗11.2L空气 |
您最近一年使用:0次
2022-04-09更新
|
782次组卷
|
6卷引用:秘籍10 金属元素及化合物的相互转化与推断-备战2022年高考化学抢分秘籍(全国通用)
(已下线)秘籍10 金属元素及化合物的相互转化与推断-备战2022年高考化学抢分秘籍(全国通用)(已下线)专题13 物质的反应和转化-2022年高考真题模拟题分项汇编(已下线)微专题15 铜及其化合物的性质、制备与实验探究-备战2023年高考化学一轮复习考点微专题(已下线)第10讲 金属材料及金属矿物的开发利用(讲)-2023年高考化学一轮复习讲练测(全国通用)重庆市2022届高三模拟调研卷(三)化学试题湖南省株洲市第一中学2021-2022学年高三下学期期中考试化学试题
21-22高三上·广东·阶段练习
解题方法
5 . “劳动是一切幸福的源泉”,下列劳动项目与所述化学知识没有关联的是
| 选项 | 劳动项目 | 化学知识 |
| A | 用84消毒液进行环境消毒 | 含氯消毒剂具有氧化性 |
| B | 垃圾分类 | “可回收物”中的玻璃能被氢氟酸腐蚀 |
| C | 用热的纯碱溶液洗去油污 | 热的纯碱溶液能与油脂反应生成可溶于水的物质 |
| D | 用明矾净水 | 明矾水解产生的氢氧化铝胶体可使水中细小颗粒絮凝 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022·广东·一模
名校
解题方法
6 . 劳动最光荣,奋斗最幸福。下列劳动项目与所述的化学知识没有关联的是
| 选项 | 劳动项目 | 化学知识 |
| A | 医疗服务:疫苗冷藏存放 | 适当低温可防止蛋白质变性 |
| B | 家务劳动:用食醋清理水壶里的水垢 | 醋酸酸性比碳酸强 |
| C | 工业劳动:焊接金属时用 溶液除锈 溶液除锈 |  加热易分解 加热易分解 |
| D | 学农活动:撒熟石灰改良酸性土壤 |  具有碱性 具有碱性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-31更新
|
1128次组卷
|
9卷引用:押广东卷化学第6题 物质的组成、性质与转化-备战2022年高考化学临考题号押题(广东卷)
(已下线)押广东卷化学第6题 物质的组成、性质与转化-备战2022年高考化学临考题号押题(广东卷)(已下线)专题05 元素及化合物的性质-备战2023年高考化学母题题源解密(广东卷)广东省2021-2022学年高三下学期一模化学试题广东省普通高中2022届高三学业水平选择考化学模拟测试(一)(已下线)化学-2022年高考押题预测卷01(广东卷)陕西省安康中学2023届高三第一次检测性考试化学试题天津市第三中学2022-2023学年高三上学期12月月考化学试题广东省梅州市梅州五校2022-2023学年高二下学期4月期中联考化学试题辽宁省沈阳市新民市高级中学2023-2024学年高三上学期10月月考化学试题
2016·全国·高考真题
真题
名校
7 . 化学在生活中有着广泛的应用,下列对应关系错误的是( )
| 化学性质 | 实际应用 | |
| A. | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
| B. | 铁比铜金属性强 | FeCl3腐蚀Cu刻制印刷电路板 |
| C. | 次氯酸盐具有氧化性 | 漂白粉漂白织物 |
| D. | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-01-30更新
|
11338次组卷
|
64卷引用:卷01 化学与STSE-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)
(已下线)卷01 化学与STSE-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)【中等生百日捷进提升系列-基础练测】专题2.10 金属及其化合物(已下线)《考前20天终极攻略》-5月16日 化学与STSE(已下线)解密06 非金属及其化合物(教师版)——备战2018年高考化学之高频考点解密(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第2讲 氧及其化合物【教学案】(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第2讲 氯及其化合物 (题型专练)(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第2讲 氯及其化合物 (教学案)(已下线)2019高考备考二轮复习精品资料-专题6 非金属及其化合物(教学案)(已下线)专题一 化学与STSE(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训(已下线)小题必刷17 碳、硅与无机非金属材料——2021年高考化学一轮复习小题必刷(通用版)(已下线)考向08 金属材料 金属的冶炼-备战2022年高考化学一轮复习考点微专题(已下线)考向11 氯及其化合物-备战2022年高考化学一轮复习考点微专题广东省大联考2021-2022学年高一下学期期中检测化学试题(已下线)章末综合评价(四)2016年全国普通高等学校招生统一考试化学(新课标3卷精编版)2017届江西省九江第一中学高三7月暑期阶段性测试化学试题2017届河北沧州市第一中学高三上学期第一次月考化学试题2017届湖北省荆州中学高三上学期8月摸底化学试卷2016-2017学年山西省山西大学附中高二上9月月考化学卷2017届黑龙江省哈尔滨六中高三上9月月考化学试卷2017届广西钦州港经济开发区中学高三上9月月考化学试卷2017届河北省定兴第三中学高三上学期第一次月考化学试卷2017届宁夏育才中学高三上学期第二次月考化学试卷2017届甘肃省兰州一中高三上学期期中化学试卷2017届宁夏银川一中高三上月考四化学试卷河南省洛阳市第一高级中学2016-2017学年高一6月月考化学试题河南省安阳市第三十五中学2016-2017学年高二下学期期末考试化学试题河北省大名县第一中学2018届高三(普通班)上学期第一次月考化学试题贵州省遵义航天高级中学2018届高三第一次模拟考试(9月月考)理科综合化学试题黑龙江省哈尔滨市第十八中学2018届高三第一次月考化学试题河北省鸡泽县第一中学2018届高三上学期第一次月考化学试题内蒙古巴彦淖尔市第一中学2018届高三12月月考理科综合化学试题【全国市级联考】湖南省五市十校2018年上学期高一期中考试化学试题四川省眉山市眉山中学2018-2019学年高二上学期10月月考理科综合化学试题【全国百强校】重庆市巴蜀中学2019届高三上学期期中复习化学试题【市级联考】吉林省东辽市2019届高三上学期期中考试化学试题辽宁省沈阳市东北育才学校2019届高三上学期第三次模拟化学试题山东省微山县第二中学2019届高三上学期第三学段教学质量监测化学试题山西省长治市城区第二中学校2018-2019学年高二上学期期末考试化学试题2016年全国普通高等学校招生统一考试化学(全国3卷参考版)云南省师范大学附属中学2018~2019学年高一下学期3月考试化学试题【全国百强校】黑龙江省哈尔滨市第三中学校2020届高三上学期第一次验收考试化学试题黑龙江省齐齐哈尔市第八中学2020届高三10月月考化学试题(已下线)浙江省教育绿色评价联盟2020届高三10月适应性考试化学试题云南省玉溪第一中学2019-2020学年高二上学期第二次月考化学试题河北省承德市第一中学2019-2020学年高二下学期3月疫情期间直播课堂检测化学试题(已下线)【南昌新东方】2019 八一、洪都 高一下 第一次月考(已下线)【南昌新东方】2019 八一中学、洪都中学、麻丘高中等七校高一下期中湖南省长沙市长郡中学2020届高三4月份教学质量监测理综化学试题黑龙江省鹤岗市第一中学2021届高三上学期第一次月考(开学考试)化学试题河南省郑州市第一中学2021届高三上学期开学测试化学试题辽宁师范大学附属中学2019-2020学年高二下学期期末考试化学试题鲁科版(2019)高一必修第一册第3章 物质的性质与转化 总结检测高一必修第二册(人教2019版)第五章 素养检测(已下线)江西省南昌市八一中学、洪都中学、麻丘高中等七校2018-2019学年高一下学期期中考试化学试题湖南省邵阳市邵东县创新实验学校2021届高三上学期第一次月考化学试题广东省深圳、汕头、潮州、揭阳名校2021届高三12月联考化学试题甘肃省武威第十八中学2021届高三上学期第四次诊断检测(期末)化学试题广西桂林市第十八中学2020-2021学年高一下学期开学考试化学试题甘肃省武威市第六中学2020届高三上学期第三次阶段性复习过关考试化学试题安徽师范大学附属中学2021-2022学年高三上学期11月考试化学试题福建省厦门市湖滨中学2021-2022学年高三上学期期中考试化学试题陕西省黄陵中学2021-2022学年高三上学期期中考试化学试题四川省宜宾市第四中学校2023-2024学年高一上学期1月期末化学试题
2022·安徽·模拟预测
8 . 人民日报曾提出“废渣不废,废水金贵”,为实现资源的阶梯应用,科研工作者以镍黄渣为原料,采用以下工艺流程可制备纯净的NiCO3,相应的滤渣用于回收其他金属。已知:镍黄渣中含NiSO4,还包括铜、铁、锌、钙、镁、铝、铬、锰、钴等金属杂质离子及不溶物。
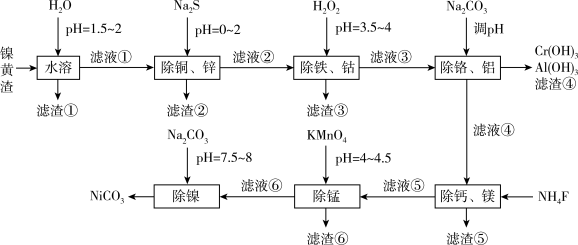
已知该工艺条件下,溶液中金属离子以氢氧化物形式开始沉淀和完全沉淀的pH如下表所示:
(已知:大多数金属离子的配位数等于它电荷数的两倍)
回答下列问题:
(1)已知实验温度下Ksp(ZnS)=2.1×10-25、Ksp (CuS)=6.3×10-35,“除铜、锌”时,当溶液中离子浓度小于1.0×10-5mol·L-1时,认为该离子已经沉淀完全,则滤液②中Cu2+的浓度不大于_______ (假设其他离子不反应)。
(2)“除铁、钴”时,H2O2可以将Co2+氧化为Co3+,由流程分析滤渣③成分是_______ 。
(3)“除铬、铝”时,理论上应调节溶液pH范围为_______ ,其中除去Al3+的离子方程式为_______ 。
(4)“除钙、镁”所得滤渣⑤在酸性条件下的溶解度增大的原因(从平衡移动的角度解释)_______ 。
(5)“除锰”时,Mn2+的氧化产物可用于实验室制备氯气,写出“除锰”反应的离子方程式:_______ 。
(6)“沉镍”时,控制终点pH=7.5~8,其主要目的是_______ 。碳酸镍可用于催化剂、电镀、陶瓷器着色等,它受热易分解,不溶于水,易溶于氨水或稀酸,写出碳酸镍溶于氨水的离子方程式:_______ 。

已知该工艺条件下,溶液中金属离子以氢氧化物形式开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Fe3+ | Fe2+ | Ni2+ | Co2+ | Co3+ | Al3+ | Cr3+ | Mn2+ |
| 开始沉淀pH | 1.9 | 7.0 | 8.1 | 7.6 | 0.56 | 4.0 | 4.3 | 7.8 |
| 完全沉淀pH | 3.2 | 9.0 | 9.5 | 9.2 | 1.1 | 5.2 | 5.4 | 10.4 |
回答下列问题:
(1)已知实验温度下Ksp(ZnS)=2.1×10-25、Ksp (CuS)=6.3×10-35,“除铜、锌”时,当溶液中离子浓度小于1.0×10-5mol·L-1时,认为该离子已经沉淀完全,则滤液②中Cu2+的浓度不大于
(2)“除铁、钴”时,H2O2可以将Co2+氧化为Co3+,由流程分析滤渣③成分是
(3)“除铬、铝”时,理论上应调节溶液pH范围为
(4)“除钙、镁”所得滤渣⑤在酸性条件下的溶解度增大的原因(从平衡移动的角度解释)
(5)“除锰”时,Mn2+的氧化产物可用于实验室制备氯气,写出“除锰”反应的离子方程式:
(6)“沉镍”时,控制终点pH=7.5~8,其主要目的是
您最近一年使用:0次



