1 . 向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成的pH列于下表(已知:偏铝酸钡易溶于水)。以下推断正确的是


| 氢氧化物 | 溶液pH | |
| 开始沉淀 | 沉淀完全 | |
| Fe(OH)3 | 2.3 | 3.4 |
| Al(OH)3 | 3.3 | 5.2 |
| A.OA段产生的沉淀为BaSO4和Fe(OH)3 |
| B.据图计算原溶液中c(Cl-)=c(SO42-) |
| C.AB段可能发生的反应是:2SO42-+ 2Ba2+ + Al3+ +3OH-=2BaSO4↓+Al(OH)3↓ |
| D.C点溶液呈碱性是因为AlO2-水解,离子方程式为:AlO2-+2H2O=Al(OH)3 +OH- |
您最近一年使用:0次
2018-10-28更新
|
640次组卷
|
2卷引用:【校级联考】江西省赣州教育发展联盟2018-2019学年高二上学期12月联考化学试题
名校
2 . 下列关于化学平衡常数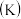 ,电离平衡常数
,电离平衡常数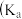 或
或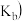 ,水解平衡常数
,水解平衡常数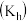 ,沉淀溶解平衡常数
,沉淀溶解平衡常数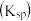 ,水的离子积常数
,水的离子积常数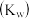 的叙述中错误的是
的叙述中错误的是

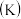 ,电离平衡常数
,电离平衡常数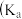 或
或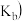 ,水解平衡常数
,水解平衡常数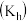 ,沉淀溶解平衡常数
,沉淀溶解平衡常数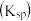 ,水的离子积常数
,水的离子积常数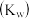 的叙述中错误的是
的叙述中错误的是

A.K值越大,正反应进行的程度越大,一般地说,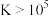 时,该反应进行得就基本完全了 时,该反应进行得就基本完全了 |
B.比较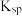 与离子积 与离子积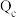 的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解 的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解 |
C.K、 或 或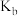 、 、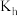 、 、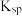 、 、 都与温度有关,温度越高,常数值越大 都与温度有关,温度越高,常数值越大 |
D.弱酸HA的 与NaA的 与NaA的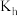 、水的离子积常数 、水的离子积常数 三者间的关系可表示为: 三者间的关系可表示为: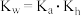 |
您最近一年使用:0次
2018-06-30更新
|
476次组卷
|
2卷引用:江西省宜春市万载中学2021-2022学年高二上学期第三次月考化学试题
名校
3 . 下列实验操作中,对应的实验现象以及实验结论都正确,且两者具有因果关系的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向稀硝酸中加入过量铁粉,充分反应后,再滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe 氧化为Fe3+ |
| B | 将少量铜粉加入1.0mol/L Fe2(SO4)3溶液中 | 固体溶解,溶液变蓝色 | 金属铁比铜活泼 |
| C | 0.1 mol/L MgSO4溶液中滴加过量NaOH 溶液,再滴加 0.1 mol/L CuSO4溶液 | 先生成白色沉淀,后变为浅蓝色沉淀 | Cu(OH)2溶度积比Mg(OH)2小 |
| D | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 金属铝熔化而不滴落下来 | 金属铝熔点比氧化铝低 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-05-11更新
|
2134次组卷
|
5卷引用:江西省万载中学2019-2020学年高二12月月考(创新班)化学试题
江西省万载中学2019-2020学年高二12月月考(创新班)化学试题【全国市级联考】安徽省合肥市2018届高三第三次教学质量检测理科综合化学试题(已下线)【百强校】吉林省实验中学2019届高三下学期六次月考理综-化学试题(已下线)小题22 难溶电解质的溶解平衡——备战2021年高考化学经典小题考前必刷(全国通用)河南省南阳市第一中学校2022届高三上学期第四次月考化学试题
4 . 已知25℃时,CaCO3饱和溶液中c(Ca2+)为5.3×10-5mol/L、MgCO3的饱和溶液中c(Mg2+)为2.6×10-3mol/L.若在5mL浓度均为0.01mol/L的CaCl2和MgCl2溶液中,逐滴加入5mL 0.012mol/LNa2CO3溶液,充分反应后过滤得到溶液M和沉淀N(不考虑溶液体积的变化)。下列观点不正确的是
| A.25℃时,Ksp(CaCO3)=2.8×10-9 |
| B.加入Na2CO3溶液的过程中,先生成CaCO3沉淀 |
| C.滤液M中:c(Cl-)>c(Na+)>c(Mg2+)>c(CO3-)>c(OH-) |
D.滤液M中:  |
您最近一年使用:0次
2018-04-16更新
|
909次组卷
|
3卷引用:江西省赣州市会昌中学2019-2020学年高二上学期第二次月考化学试题
5 . T℃下,三种硫酸盐MSO4(M: Pb2+、Ba2+、Sr2+)的沉淀溶解平衡曲线如图所示。已知pM=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是
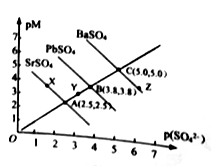

| A.溶度积:BaSO4>PbSO4>SrSO4 |
| B.Y 点对SrSO4是不饱和溶液,能继续溶解SrSO4 |
| C.Z点对应的溶液中c(Ba2+)42-),二者的浓度积等于1×10-10 |
| D.BaSO4不 可能转化成PbSO4 |
您最近一年使用:0次
名校
6 . 下列有关实验操作、现象和目的或结论的说法正确的是
| 选项 | 操作 | 目的或结论 |
| A | 向盛有少量Mg(OH)2 固体的试管中加入适量CH3COONH4 浓溶液,充分振荡,白色固体溶解 | NH4+与Mg(OH)2溶解出的OH-结合,导致Mg(OH)2溶解 |
| B | 海带提碘实验中,为了制取海带灰的浸取液,需要煮沸海带灰和水的混合物2-3min | 主要目的是去除溶液中的氧气,避免碘离子被氧化 |
| C | 保存硫酸亚铁溶液需加入少量稀盐酸和铁钉 | 防止Fe2+水解以及被氧气氧化 |
| D | 将Fe(NO3)2 晶体溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变红 | 检验Fe(NO3)2样品是否已被氧化而变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-02-23更新
|
422次组卷
|
3卷引用:江西省鹰潭市2020-2021学年高二上学期期末质量检测化学试题
7 . 下列说法正确的是
| A.pH<7 的溶液一定呈酸性 |
| B.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol/L |
| C.盐碱地不利于作物生长,通过施加适量石膏可以降低土壤碱性 |
| D.在NaCl和NaBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀 |
您最近一年使用:0次
名校
8 . 某温度下,向10mL 0.1mol/LCuSO4溶液中滴加0.1mol/L的Na2S溶液,滴加过程中溶液中−lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是

[已知:lg2=0.3,Ksp(ZnS)=3×10-25]

[已知:lg2=0.3,Ksp(ZnS)=3×10-25]
A.Na2S溶液呈碱性,是因为S2-离子发生了水解,用离子方程式可表示为:S2-+2H2O H2S+2OH- H2S+2OH- |
| B.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+) |
| C.向100mL Zn2+、Cu2+浓度均为10-5mol·L-1的混合溶液中逐滴加入10-4mol·L-1的Na2S溶液,Zn2+先沉淀 |
| D.该温度下Ksp(CuS)=4×10-36 |
您最近一年使用:0次
2018-01-26更新
|
456次组卷
|
2卷引用:江西省井冈山市宁冈中学2021-2022学年高三下学期开学考试化学试题
9 . 一定温度下,两种碳酸盐MCO3(M分别为A和B两种离子)的沉淀溶解平衡曲线如图所示。已知:pM=−lgc(M),p(CO32−)=−lgc(CO32−)。已知ACO3比BCO3溶解度更大。(不考虑阴阳离子的水解)。下列说法正确的是
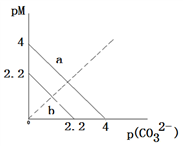

| A.线a表示ACO3的溶解平衡曲线 |
| B.该温度下,向ACO3的饱和溶液中加入Na2CO3溶液,一定能产生沉淀 |
| C.向0.1L 1mol/L的BCl2溶液中加入Na2CO3固体,当加入Na2CO3固体的质量为116.6g时,B2+离子恰好沉淀完全(B2+离子为10—5mol/L时认为沉淀完全) |
| D.ACO3的Ksp=10—4.4 |
您最近一年使用:0次
2018-01-11更新
|
1103次组卷
|
3卷引用:【全国百强校】江西省南昌市第二中学2018-2019学年高二上学期第三次月考化学试题
10 . 向含MgCl2和CuCl2的溶液中逐滴加入0.1 mol·L-1的NaOH溶液,沉淀的质量(m)与加入NaOH溶液体积(V)的关系如图所示,已知V2 =3V1,下列说法正确的是
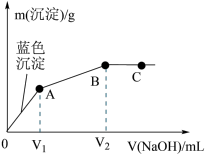

| A.原溶液中MgCl2和CuCl2的物质的量浓度相等 |
| B.该实验不能证明Cu(OH)2的Ksp比Mg(OH)2的Ksp小 |
| C.水的电离程度:A>B>C |
| D.若向Mg(OH)2悬浊液中加入CuCl2溶液,一定会有Cu(OH)2生成 |
您最近一年使用:0次
2018-01-01更新
|
494次组卷
|
8卷引用:鄱阳一中2017-2018学年度上学期高二年级第二次检测化学试卷



