名校
1 . 下列实验操作能达到实验目的的是
| 选项 | 实验操作 | 实验目的 |
| A | 在对甲基苯酚中滴少量酸性 溶液 溶液 | 证明羟基具有还原性 |
| B | 向紫色石蕊溶液中通入 至过量 至过量 | 验证 具有漂白性 具有漂白性 |
| C | 在医用酒精中加小块钠 | 证明乙醇会与钠反应 |
| D | 在AgCl浊液、AgI浊液中分别加入过量的同浓度浓氨水(白色沉淀溶解,黄色沉淀几乎不溶解) | 证明:Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7日内更新
|
134次组卷
|
2卷引用:江西省部分学校2023-2024学年高三下学期二轮复习联考验收化学试卷
2 . 常温下,向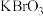 、
、 、
、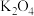 的混合液中滴加
的混合液中滴加 溶液,混合物中
溶液,混合物中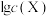 [
[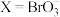 、
、 、
、 ]与
]与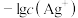 关系如图所示(已知
关系如图所示(已知 、
、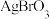 和
和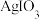 均难溶于水,且
均难溶于水,且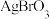 溶解度大于
溶解度大于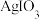 )。下列叙述正确的是
)。下列叙述正确的是
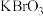 、
、 、
、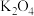 的混合液中滴加
的混合液中滴加 溶液,混合物中
溶液,混合物中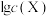 [
[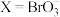 、
、 、
、 ]与
]与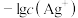 关系如图所示(已知
关系如图所示(已知 、
、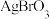 和
和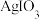 均难溶于水,且
均难溶于水,且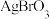 溶解度大于
溶解度大于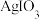 )。下列叙述正确的是
)。下列叙述正确的是
A. 代表 代表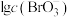 与 与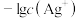 的关系 的关系 |
B.常温下,饱和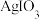 溶液中 溶液中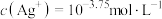 |
C.上述反应中,最后生成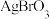 |
D.在含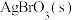 和 和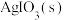 的浊液中 的浊液中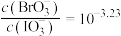 |
您最近一年使用:0次
3 . 络合反应的平衡常数称为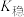 ,
,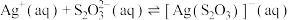
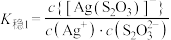 ,
,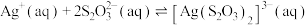
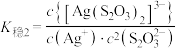 ,
, 。常温下,在含
。常温下,在含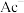 (
(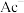 代表
代表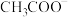 )和
)和 的混合溶液中滴加
的混合溶液中滴加 溶液,溶液中
溶液,溶液中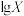 [
[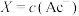 、
、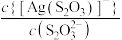 、
、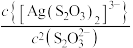 与
与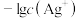 的关系如图所示(已知AgAc微溶于水)。下列叙述正确的是
的关系如图所示(已知AgAc微溶于水)。下列叙述正确的是
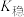 ,
,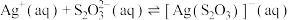
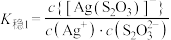 ,
,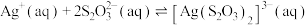
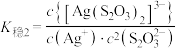 ,
, 。常温下,在含
。常温下,在含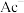 (
(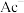 代表
代表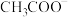 )和
)和 的混合溶液中滴加
的混合溶液中滴加 溶液,溶液中
溶液,溶液中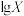 [
[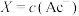 、
、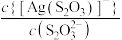 、
、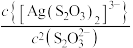 与
与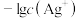 的关系如图所示(已知AgAc微溶于水)。下列叙述正确的是
的关系如图所示(已知AgAc微溶于水)。下列叙述正确的是
A. 代表 代表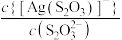 与 与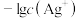 的关系 的关系 |
B.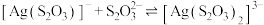 的 的 |
C.饱和AgAc溶液中 |
D.M点对应坐标为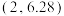 |
您最近一年使用:0次
2024-05-11更新
|
118次组卷
|
2卷引用:江西省部分学校2023-2024学年高三下学期二轮复习联考验收化学试卷
名校
解题方法
4 . 氯化钡是重要的化工原料,是制备其他钡盐的主要中间原料,以毒重石(主要成分为 ,还含有
,还含有 及含Ca、Mg、Fe、Al的化合物)为原料制备
及含Ca、Mg、Fe、Al的化合物)为原料制备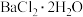 的工艺流程如下:
的工艺流程如下: 、
、 、
、 、
、 形式存在于溶液中。
形式存在于溶液中。
回答下列问题:
(1)在“浸取”时,除温度、酸的浓度、液固比等因素影响钡的浸出率外,还有___________ 因素。
(2)下表列举了不同温度、盐酸的浓度、液固比下钡的浸出率实验数据,每个实验只改变一个条件:
分析表中数据,温度越高钡的浸出率越低的可能原因是___________ ;判断“浸取”的最佳液固比为___________ 。
(3)常温时,几种金属离子沉淀的pH如图所示,加 时发生反应的离子方程式为
时发生反应的离子方程式为___________ ;“调pH(Ⅰ)”时,调节溶液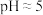 ,则“滤渣Ⅱ”的主要成分为
,则“滤渣Ⅱ”的主要成分为___________ (填化学式)。___________ 。
 ,还含有
,还含有 及含Ca、Mg、Fe、Al的化合物)为原料制备
及含Ca、Mg、Fe、Al的化合物)为原料制备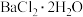 的工艺流程如下:
的工艺流程如下: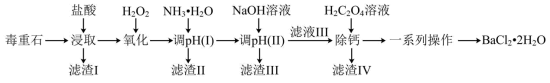
 、
、 、
、 、
、 形式存在于溶液中。
形式存在于溶液中。回答下列问题:
(1)在“浸取”时,除温度、酸的浓度、液固比等因素影响钡的浸出率外,还有
(2)下表列举了不同温度、盐酸的浓度、液固比下钡的浸出率实验数据,每个实验只改变一个条件:
| 改变的条件 | 温度(℃) | 盐酸的浓度(%) | 液固比 | ||||||||
| 30 | 55 | 75 | 10 | 15 | 20 | 25 | 3:1 | 4:1 | 5:1 | 6:1 | |
| 钡的浸出率(%) | 74.31 | 69.60 | 68.42 | 59.21 | 74.31 | 74.15 | 55.32 | 59.84 | 65.12 | 74.31 | 74.35 |
(3)常温时,几种金属离子沉淀的pH如图所示,加
 时发生反应的离子方程式为
时发生反应的离子方程式为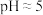 ,则“滤渣Ⅱ”的主要成分为
,则“滤渣Ⅱ”的主要成分为
您最近一年使用:0次
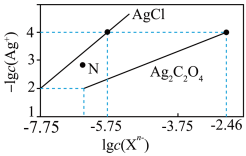
5 . 常温下,用 溶液分别滴定浓度均为
溶液分别滴定浓度均为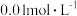 的
的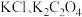 溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O
溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O 的水解)。其中Xn-表示
的水解)。其中Xn-表示 或
或 ,下列叙述错误的是
,下列叙述错误的是
 溶液分别滴定浓度均为
溶液分别滴定浓度均为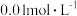 的
的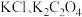 溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O
溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O 的水解)。其中Xn-表示
的水解)。其中Xn-表示 或
或 ,下列叙述错误的是
,下列叙述错误的是 
A.Ksp(Ag2C2O4)的数量级为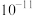 |
B. 点表示 点表示 的过饱和溶液 的过饱和溶液 |
C.向c(Cl-)=c(C2O )的混合溶液中滴入 )的混合溶液中滴入 溶液时,先生成 溶液时,先生成 沉淀 沉淀 |
D.常温下,Ag2C2O4(s)+2Cl-(aq) 2AgCl(s)+C2O 2AgCl(s)+C2O 的平衡常数为108.04 的平衡常数为108.04 |
您最近一年使用:0次
6 . 为研究沉淀的生成及转化,进行如下实验。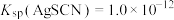
下列关于该实验的分析不正确 的是
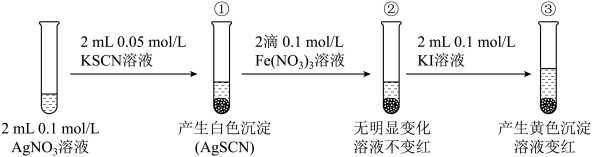
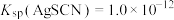
下列关于该实验的分析
A.①中产生白色沉淀的原因是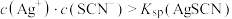 |
B.充分反应后①中 浓度为 浓度为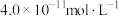 |
C.③中产生黄色沉淀可证明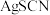 向 向 沉淀转化 沉淀转化 |
D.②中加入KI溶液后一定发生了反应 |
您最近一年使用:0次
2024-01-01更新
|
297次组卷
|
8卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期1月月考化学试题
江西省宜春市宜丰中学2023-2024学年高三上学期1月月考化学试题江西省宜春市丰城市东煌学校2023-2024学年高二上学期1月期末化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题四川省成都市第七中学2023-2024学年高一上学期12月月考化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题(已下线)专题06 沉淀溶解平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)辽宁省大连市第十二中学2023-2024学年高二上学期12月学情反馈化学试题(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
名校
解题方法
7 . MnO2是重要化工原料,由软锰矿制备MnO2的一种工艺流程如下:

资料:
①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。
②金属离子沉淀的pH:
③该工艺条件下,MnO2与H2SO4不反应。
(1)溶出
①溶出前,软锰矿需研磨,目的是___________ 。
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:
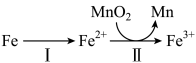
i.II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是___________ 。
ii.若I中Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2,而实际比值(0.9)小于2,原因是___________ 。
(2)纯化
已知:MnO2的氧化性与溶液pH有关。纯化时先加入MnO2后加入NH3·H2O,调溶液pH,说明试剂加入顺序及调节pH的原因:___________ 。
(3)电解
Mn2+纯化液经电解得MnO2,生成1molMnO2电子转移的数目为___________ 。
(4)产品纯度测定
向ag产品中依次加入足量bgNa2C2O4和足量稀H2SO4,如热至充分反应,生成CO2,再滴加cmol/L KMnO4溶液至剩余Na2C2O4恰好完全反应,消耗KMnO4溶液的体积为dL,产品纯度为___________ (用质量分数表示)。[已知:MnO2及 均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]

资料:
①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。
②金属离子沉淀的pH:
| Fe3+ | A13+ | Mn2+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.4 | 5.8 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 7.8 | 8.3 |
(1)溶出
①溶出前,软锰矿需研磨,目的是
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:

i.II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是
ii.若I中Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2,而实际比值(0.9)小于2,原因是
(2)纯化
已知:MnO2的氧化性与溶液pH有关。纯化时先加入MnO2后加入NH3·H2O,调溶液pH,说明试剂加入顺序及调节pH的原因:
(3)电解
Mn2+纯化液经电解得MnO2,生成1molMnO2电子转移的数目为
(4)产品纯度测定
向ag产品中依次加入足量bgNa2C2O4和足量稀H2SO4,如热至充分反应,生成CO2,再滴加cmol/L KMnO4溶液至剩余Na2C2O4恰好完全反应,消耗KMnO4溶液的体积为dL,产品纯度为
 均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
您最近一年使用:0次
2023-12-15更新
|
175次组卷
|
3卷引用:江西省上饶市广丰一中2023-2024学年高二上学期12月考试化学试卷
名校
解题方法
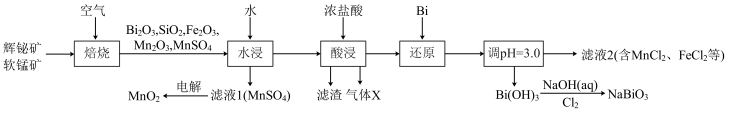
8 . 铋酸钠( )是常用的氧化剂,
)是常用的氧化剂, 是活性电极。以辉铋矿(主要成分为
是活性电极。以辉铋矿(主要成分为 ,含
,含 、
、 杂质)和软锰矿(主要成分是
杂质)和软锰矿(主要成分是 )为原料联合焙烧制备
)为原料联合焙烧制备 和
和 ,流程如下:
,流程如下:
已知:①金属活动性: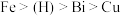 。
。
②几种金属离子的氢氧化物沉淀pH如下:
回答下列问题:
(1) 中Bi的化合价为
中Bi的化合价为___________ 。气体X是___________ (填化学式)。
(2)“焙烧”中 和
和 与空气反应生成
与空气反应生成 和
和 ,写出其反应的化学方程式:
,写出其反应的化学方程式:___________ 。被还原的元素是___________ (填元素符号)。
(3)“还原”中Bi的作用是___________ 。
(4)检验滤液2中是否有 的试剂是
的试剂是___________ (填化学式)。
(5)已知 难溶于水,
难溶于水, 难溶于冷水,写出常温下利用
难溶于冷水,写出常温下利用 制备
制备 的离子方程式:
的离子方程式:___________ 。
(6)为探究 和
和 的氧化性相对强弱,设计如下实验:
的氧化性相对强弱,设计如下实验:

实验中观察到试管B中溶液变蓝色。
由上述实验现象可知,氧化性:
___________  (填“>”或“<”)。与根据第(5)小题得出的
(填“>”或“<”)。与根据第(5)小题得出的 与
与 氧化性强弱关系相反,其主要原因是
氧化性强弱关系相反,其主要原因是___________ 。
 )是常用的氧化剂,
)是常用的氧化剂, 是活性电极。以辉铋矿(主要成分为
是活性电极。以辉铋矿(主要成分为 ,含
,含 、
、 杂质)和软锰矿(主要成分是
杂质)和软锰矿(主要成分是 )为原料联合焙烧制备
)为原料联合焙烧制备 和
和 ,流程如下:
,流程如下:
已知:①金属活动性:
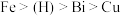 。
。②几种金属离子的氢氧化物沉淀pH如下:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
 | 1.5 | 2.8 |
 | 6.3 | 8.3 |
 | 8.1 | 10.1 |
(1)
 中Bi的化合价为
中Bi的化合价为(2)“焙烧”中
 和
和 与空气反应生成
与空气反应生成 和
和 ,写出其反应的化学方程式:
,写出其反应的化学方程式:(3)“还原”中Bi的作用是
(4)检验滤液2中是否有
 的试剂是
的试剂是(5)已知
 难溶于水,
难溶于水, 难溶于冷水,写出常温下利用
难溶于冷水,写出常温下利用 制备
制备 的离子方程式:
的离子方程式:(6)为探究
 和
和 的氧化性相对强弱,设计如下实验:
的氧化性相对强弱,设计如下实验:
实验中观察到试管B中溶液变蓝色。
由上述实验现象可知,氧化性:

 (填“>”或“<”)。与根据第(5)小题得出的
(填“>”或“<”)。与根据第(5)小题得出的 与
与 氧化性强弱关系相反,其主要原因是
氧化性强弱关系相反,其主要原因是
您最近一年使用:0次
2023-10-19更新
|
198次组卷
|
2卷引用:江西省大余中学2023-2024学年高三上学期10月月考化学试题
名校
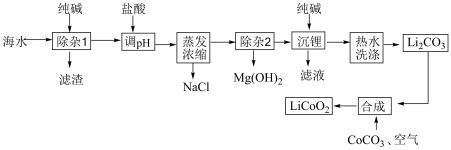
9 . 锂离子电池的应用很广泛,某种锂电池的正极材料为钴酸锂,该材料可以由海水(含较大浓度的LiCI及少量MgCl2、CaCl2、MnCl2等)为原料制备,其工艺流程如图所示:
已知:①在常温下几种难溶物质的溶度积常数如表
②Li2CO3微溶于热水,可溶于冷水。回答下列问题:
(1)“除杂1”步骤中除去的杂质离子为Mg2+和_____ 。
(2)“调pH”的目的是_____ 。
(3)金属镁可以通过电解熔融MgC12得到,写出由Mg(OH)2沉淀制MgCl2固体的具体操作_____ 。
(4)20℃时碳酸锂在水中的溶解度为1.295g,饱和溶液密度为1.0148g/cm3,其中Li2CO3的物质的量浓度为_____ 。(结果保留2位有效数字)
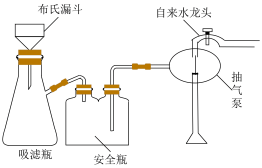
(5)“热水洗涤”的目的是_____ 。在实验室里洗涤Li2CO3时会采用如图所示装置,该装置较于普通过滤装置的优点为_____ 。
(6)“合成”工序需要高温条件,并放出能使澄清石灰水变浑浊的气体,写出该反应的化学方程式_____ 。

已知:①在常温下几种难溶物质的溶度积常数如表
| 物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
| K | 2.5×10-2 | 6.8×10-6 | 3.4×10-9 | 2.3×10-11 | 5.6×10-12 |
(1)“除杂1”步骤中除去的杂质离子为Mg2+和
(2)“调pH”的目的是
(3)金属镁可以通过电解熔融MgC12得到,写出由Mg(OH)2沉淀制MgCl2固体的具体操作
(4)20℃时碳酸锂在水中的溶解度为1.295g,饱和溶液密度为1.0148g/cm3,其中Li2CO3的物质的量浓度为
(5)“热水洗涤”的目的是

(6)“合成”工序需要高温条件,并放出能使澄清石灰水变浑浊的气体,写出该反应的化学方程式
您最近一年使用:0次
10 . 某废水处理过程中始终保持 饱和,即
饱和,即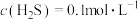 ,通过调节pH使
,通过调节pH使 和
和 形成硫化物而分离,体系中pH与
形成硫化物而分离,体系中pH与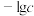 关系如图所示,c为
关系如图所示,c为 、
、 、
、 和
和 的浓度,单位为
的浓度,单位为 。已知
。已知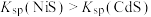 ,下列说法正确的是
,下列说法正确的是
 饱和,即
饱和,即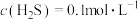 ,通过调节pH使
,通过调节pH使 和
和 形成硫化物而分离,体系中pH与
形成硫化物而分离,体系中pH与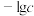 关系如图所示,c为
关系如图所示,c为 、
、 、
、 和
和 的浓度,单位为
的浓度,单位为 。已知
。已知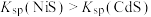 ,下列说法正确的是
,下列说法正确的是
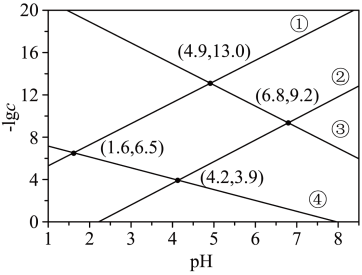
A.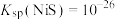 |
B.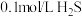 的单一溶液中粒子浓度大小关系为 的单一溶液中粒子浓度大小关系为 |
C.④为pH与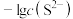 的关系曲线 的关系曲线 |
D.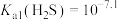 |
您最近一年使用:0次
2023-08-28更新
|
436次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期12月月考化学试题



